山刺玫果多糖抗疲劳及抗氧自由基水平机制研究
秦汝兰1,关颖丽1,吕重宁
(1.通化师范学院医药学院,吉林通化 134002;2.沈阳药科大学中药学院,辽宁沈阳 110016)
山刺玫果多为球形或卵形,又名刺玫果,野蔷薇果,为蔷薇科属山刺玫(RosadavuricaPall.)的成熟果实。因其酸甜可食,营养丰富,在民间深受喜爱,常用于泡茶、泡酒等,是一种高营养价值、药食同源的野生果类。其分布广泛,在中国的东北、内蒙古、山西、河北等地区均有生长[1]。现代研究表明,山刺玫果中含有丰富的维生素、多糖、黄酮、皂苷等成分,具有预防心血管疾病,抗氧化,提高免疫力等功效。基于刺玫果的营养价值,以其为主要原料开发的食品、保健品和功能性饮品受到广泛关注[2-4]。
多糖是以醛糖或酮糖通过糖苷键链接成高分子化合物,所以又称为多聚糖。经实验研究发现,多糖不仅具有抗氧化、抗肿瘤等作用,尤其在抗疲劳方面,表现出显著的功效。石娟等[5]研究发现,黄精粗多糖有利于延长小鼠负重游泳时间,同时能够降低运动后小鼠血清尿素氮含量及增加小鼠肝糖原含量。此外,黄精粗多糖亦可显著降低溴苯所致小鼠肝损伤的脂质过氧化产物MDA含量、增加过氧化物歧化酶GSH-Px含量;梁启超等[6]研究发现玫瑰花多糖能够在显著提高衰老小鼠血清和肝组织中超氧化物歧化酶和谷胱甘肽过氧化物酶活力的同时,显著降低丙二醛含量,表现出良好的体内抗氧化活性;王维[7]研究发现,黄蘑多糖在减缓疲劳和清除氧自由基方面也具有较好的作用,能够显著延长小鼠的力竭游泳时间、显著降低血乳酸含量,加快运动后小鼠体内血乳酸的消除速度,提高小鼠全血中超氧化物歧化酶活性,降低丙二醛含量。近年来,国外对于植物或菌类药物中多糖抗氧化作用的研究不断报道[8-9]。
前期化学成分以及体外活性实验研究发现,山刺玫果中含有丰富的多糖且具有显著的体外抗氧化活性。本文旨在通过检测小鼠竭游泳时间、转棒时间,血乳酸(BLA)、肝糖原(LG)、肌糖原(MG)、血尿素氮(BUN)含量及肝脏与血清中总抗氧能力(T-AOC)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物歧化酶(GSH-Px)的活性、丙二醛(MDA)含量,进一步从体内药理方面探讨山刺玫果多糖对小鼠抗疲劳作用及抗氧自由基水平的影响,为刺玫果资源进一步的开发利用提供有利的参考依据。
1 材料与方法
1.1 材料与仪器
山刺玫果 采于通化师范学院周边,经通化师范学院于俊林教授鉴定为刺玫果(RosadavuricaPall.);生晒参 购于通化县人参交易市场,产区为通化县,阴干,粉碎备用。BLA(血乳酸)试剂盒;LG(肝糖原)试剂盒;MG(肌糖原)试剂盒;BUN(血尿素氮)试剂盒;T-AOC(总抗氧化能力)试剂盒;SOD(超氧化物歧化酶)试剂盒;GSH-Px(谷胱甘肽过氧化物歧化酶试)剂盒;MDA(丙二醛)试剂盒 均购于南京建成生物工程研究所;洁净级健康雄性KM小鼠 150只,体重18~22 g,购于长春高新医学动物实验研究中心,实验动物生产许可证号:SCXK(吉)2017-0004。
KQ-250E超声波清洗器 昆山市超声仪器有限公司;TU-1901双光束紫外可见分光光度计 北京普析通用仪器有限责任公司;TGL-16B高速台式离心机 上海安亭科学仪器厂;Bio-TekELX800酶标仪 上海赛默生物科技发展有限公司。
1.2 实验方法
1.2.1 山刺玫果多糖的制备 新鲜山刺玫果→阴干→粉碎过20目筛→95%乙醇脱脂3 h→50 ℃烘干→加水提取(提取温度80 ℃,料液比1∶30,提取时间3 h)→离心→抽滤→取上清液浓缩至原来体积的1/5→加入4倍体积无水乙醇,4 ℃静置过夜→抽滤→冷冻干燥→山刺玫果粗多糖[10]。
1.2.2 葡萄糖对照品溶液的制备 准确称取干燥至恒重的葡萄糖对照品10.02 mg,置于50 mL的容量瓶中,加入蒸馏水溶解并定容至刻度,配制成浓度为0.204 mg·mL-1的葡萄糖对照品溶液,冰箱保存备用。
1.2.3 葡萄糖标准曲线的绘制 分别吸取“1.2.2”项下葡萄糖对照品溶液2.0、4.0、6.0、8.0、10.0 mL置于50 mL容量瓶中,蒸馏水稀释至刻度。取上述各对照品溶液2.0 mL于具塞试管中;加入4%苯酚溶液1.0 mL摇匀;迅速滴加7.0 mL的浓硫酸,摇匀静置5 min后于40 ℃的水浴中加热30 min,冷却至室温,测定在490 nm波长处的吸光度值[11],以葡萄糖对照品溶液浓度C为横坐标,吸光度值A为纵坐标,绘制标准曲线,得回归方程:Y=14.575C+0.0141,r=0.9991,结果表明,葡萄糖对照品溶液在浓度为0.008~0.041 mg·mL-1范围内呈现良好的线性关系。
1.2.4 山刺玫果多糖含量测定 准确称取“1.2.1”项下得到的山刺玫果粗多糖,用蒸馏水溶解后制成浓度为0.04 mg·mL-1的粗多糖溶液。吸取2 mL粗多糖溶液,按照“1.2.3”项下实验方法操作,平行3次,按照下列公式计算总多糖含量:
总多糖含量(%)=C1×V1×100/M
式中:C1为样品中总多糖浓度(mg·mL-1);V1为测定样品溶液体积(mL);M为样品质量(g)。
1.2.5 人参水煎液的制备 称取27 g人参粉末,加入200 mL蒸馏水煎煮30 min,2次,合并滤液配制成浓度为0.135 g·mL-1的溶液,冰箱冷藏放置,备用。
1.2.6 动物分组及给药方法 将小鼠随机分为空白组,阳性对照组(0.135 g·mL-1的自制人参水煎液),山刺玫果多糖低剂量组(25 mg·kg-1)、中剂量组(50 mg·kg-1)、高剂量组(100 mg·kg-1),每组8~10只。按照0.1 mL·10 g-1剂量灌胃给予小鼠,空白组灌服等剂量生理盐水,每日1次,连续给药21 d,灌胃期间小鼠自由饮水和摄食。
1.2.7 小鼠负重游泳实验 第21 d给药30 min后,将重量为小鼠体重5%的铅丝附于小鼠尾部,随后将小鼠放入水槽内,保持水温(25±2) ℃,以小鼠放入水槽开始计时,记录小鼠力竭时间(小鼠完全沉入水面10 s不能上浮的时间为力竭时间)[12]。
1.2.8 小鼠疲劳转棒实验 连续给药21 d时,进行小鼠疲劳转棒训练,3次。给药30 min后,进行转棒实验,记录25 r·min-1的转速下,小鼠置于转棒至跌落的时间[13]。
1.2.9 小鼠肌肉中MG及肝脏中LG含量的测定 称取100 mg“1.2.7”项下取出的各组小鼠肝脏。用生理盐水冲洗各组小鼠取出的股四头肌,滤纸吸干,称取100 mg。小鼠肌肉与肝脏均用锡箔纸包裹,-80 ℃冷藏,备用。测定各组小鼠肌肉及肝脏中MG和LG的含量。
1.2.10 小鼠血清及肝脏匀浆液中SOD、T-AOC、GSH-Px活性及MDA、BLA、BUN含量的测定 各组小鼠经口给药21 d,于末次给药30 min后,将小鼠置于[(25±2) ℃]
水槽中进行游泳实验,游泳60 min后取出小鼠,休息10 min后,摘眼球取血,12000 r·min-1离心10 min,得到血清。小鼠按照40 mg·kg-1剂量给予1%戊巴比妥钠麻醉后,迅速取出肝脏。部分肝脏用生理盐水按照1∶9比例制成10%的肝脏组织匀浆液,12000 r·min-1离心10 min,取上清液,备用。按要求测定各组小鼠血清及肝脏匀浆液中BUN、BLA、SOD、MDA和T-AOC、GSH-Px活性[14-16]。
1.3 统计学方法
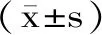
2 结果与分析
2.1 山刺玫果多糖含量测定结果
按照“1.2.4”多糖含量公式计算得出山刺玫果多糖含量为36.2%。
2.2 山刺玫果多糖对小鼠负重游泳时间及转棒时间的影响
如表1所示,通过负重游泳时间的比较可知,与空白对照组相比,山刺玫果多糖低、中、高剂量组的小鼠负重游泳时间均显著增加(P<0.05),其中,山刺玫果多糖高剂量组和阳性对照组游泳时间均显著长于空白对照组(P<0.01),表明山刺玫果多糖具有较强的增强疲劳小鼠运动耐力作用。此外,山刺玫果多糖中剂量组和高剂量组的转棒时间均较空白对照组明显延长(P<0.05),说明山刺玫果多糖具有抗疲劳作用。
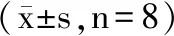
表1 山刺玫果多糖对小鼠负重游泳时间及转棒时间的影响Table 1 Effects of polysaccharides on loading swimmingtime and rod turning time in
注:*与空白对照组相比差异显著(P<0.05),**与空白对照组相比差异极显著(P<0.01);图2~图5同。
2.3 山刺玫果多糖对小鼠肌肉中LG及肝脏中MG含量的影响
由表2可知,与空白对照组相比,山刺玫果多糖低剂量组对疲劳小鼠肝糖原、肌糖原的储备量几乎没有影响(P>0.05),而中剂量组、高剂量组小鼠肌肉中MG及肝脏中LG含量均明显增加(P<0.05)。其中高剂量组和阳性对照组肝糖原储备量增加更为明显(P<0.01)。实验结果表明,山刺玫果多糖在一定程度上具有增强机体肌肉强健力和肝脏活力的作用。
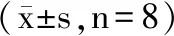
表2 山刺玫果多糖对小鼠LG及MG含量的影响Table 2 Effects of polysaccharides on thecontent of LG and MG in
2.4 山刺玫果多糖对小鼠血清中BUN及BLA含量的影响
由表3数据可知,与空白对照组相比,高剂量组小鼠血清中BUN含量明显降低(P<0.05),其中,阳性对照组小鼠血清中BUN含量降低更加显著(P<0.01),表明山刺玫果多糖能减少蛋白质分解,降低疲劳小鼠血清尿素氮的生成;与空白组比较,山刺玫果多糖中剂量组、高剂量组小鼠游泳后血乳酸浓度均降低(P<0.05),其中阳性组最为明显(P<0.01),表明山刺玫果多糖能够降低游泳小鼠血乳酸的生成,加快乳酸代谢。
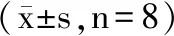
表3 山刺玫果多糖对小鼠BUN及BLA含量的影响Table 3 Effects of polysaccharides on thecontent of BUN and BLA in
2.5 山刺玫果多糖对小鼠肝脏、血清中SOD活性、MDA含量的影响
表4表明,随着山刺玫果多糖剂量的增加,小鼠血清及肝脏中SOD活力提高,MDA含量降低。与空白对照组比较,山刺玫果多糖中剂量组及高剂量组小鼠肝脏中SOD活力明显提高(P<0.05),阳性组提高更为显著(P<0.01),并且高剂量组和阳性组小鼠血清中SOD活力明显提高(P<0.05),说明山刺玫果多糖可以提高体内SOD活力,清除体内自由基能力;与空白对照组相比,山刺玫果多糖高剂量组小鼠肝脏中MDA含量明显降低(P<0.05),阳性组降低更为显著(P<0.01),此外,中剂量和高剂量组小鼠血清中MDA含量的降低具有统计学意义(P<0.05),结果提示,山刺玫果多糖能够避免小鼠剧烈运动后,大量MDA的积累对细胞所造成的伤害。
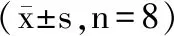
表4 山刺玫果多糖对小鼠肝脏、血清中SOD活性及MDA含量的影响Table 4 Effects of polysaccharides on the activity of SOD and content of MDA in liver and
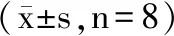
表5 山刺玫果多糖对小鼠肝脏、血清T-AOC及GSH-Px的活力的影响Table 5 Effects of polysaccharides on the activity of T-AOC and GSH-Px in liver and
2.6 山刺玫果多糖对小鼠肝脏、血清T-AOC及GSH-Px的活力的影响
由表5可见,与空白对照组相比,山刺玫果多糖中剂量、高剂量可使肝脏中T-AOC能力均有所增加(P<0.05),低剂量组未发现有明显优势。小鼠血清T-AOC活力测定结果中,低剂量组与中剂量组小鼠血清中T-AOC能力均显著增加(P<0.05),提示山刺玫果多糖可提高机体总抗氧化能力,减轻大强度运动所致氧化应激损伤,对运动引起的过氧化反应以及组织损伤具有一定的保护作用;小鼠肝脏及血清GSH-Px活力测定结果可知,高剂量组及阳性对照组肝脏与血清中的GSH-Px的活力显著提高(P<0.05),提示山刺玫果多糖能够产生较强的抗氧化作用,可防止酶分子氧化,维持并提高GSH-PX活性,加速自由基的消除。
3 结论与讨论
疲劳为一种状态,发生在机体生理过程不能维持及其机能在某一特定的水平或不能维持预定的运动强度时。抗疲劳的方式主要有延缓疲劳的产生或加速疲劳的消除[17]。当小鼠运动过度后,会出现机体的机能减弱,同时伴随血糖浓度的降低,这种现象和症状表明其机体处于疲劳状态。随着药理研究的不断深入,中药多糖的应用更加广泛,不但能够明显提高小鼠运动能力,缓解运动疲劳,还具有显著的抗氧化和清除自由基的作用。
目前,常采用小鼠转棒实验和负重游泳实验对小鼠运动耐力和疲劳状况进行测试,两种实验模型相结合能够比较客观地反映出小鼠运动疲劳的程度[18];当机体经过长时间运动后,为提供机体运动所需的能量,体内的糖原会进行分解,转变为乳酸,从而维持机体正常状态。而当糖原含量不足,不能为机体活动提供充足能量时,机体活动水平就会低于正常状态,出现疲劳现象。肝糖原能够为机体提供大量能量,机体内肝糖原的含量决定了能够为机体提供能量的多少。肌糖原则决定了机体耐力,肌糖原的含量越多,机体的耐力越好,运动时间也越长。当机体没有得到充分的能量供给时,机体内的糖会进行无氧代谢,蛋白质则进行分解代谢为机体提供能量,这就导致了体内BUN含量的增加。因此,BUN的含量在一定程度上可以反映机体的疲劳程度[19]。在无氧条件下,肌肉中的糖原会被分解产生乳酸,为机体提供能量,但大量乳酸的产生则会引起肌肉酸痛,从而导致肌肉运动能力的下降,缓解机体的疲劳状态也可以从减少乳酸含量的角度出发。本实验结果显示,山刺玫果多糖可延长小鼠负重力竭游泳时间,增加肝糖原含量而提高机体运动能力,增加血乳酸脱氢酶的活性,从而加快乳酸的分解,降低血清尿素氮和血乳酸的含量,延缓疲劳的发生,具有明显的抗疲劳作用。
运动性疲劳产生的重要原因是运动中超氧阴离子自由基的产生和血浆脂质过氧化物的升高[20]。因此,抗氧化作用的物质,不但可以提高体内抗氧化酶的活性,还可以清除超氧阴离子自由基以及降低血浆脂质的过氧化物,从而达到抗疲劳的效果。自由基作为一种强氧化能力的物质,其含量的变化与人体系统衰老密切相关。大量研究表明,小鼠体内本身具有SOD、GSH-Px等多种清除多余自由基的抗氧化活性酶,可降低小鼠体内活性氧自由基的活性,减弱其对机体的攻击力,抗氧酶活性的提高能够延缓运动疲劳[21]。生物体内,MDA作为脂质过氧化反应的终产物,当细胞受自由基氧化破坏时,其含量增加,由于细胞损伤,抑制了三磷酸腺苷(ATP)的释放,阻碍了机体能量的供应,机体疲劳随之产生[22]。T-AOC常用于反映机体抗氧化系统的功能状况,其大小与机体抗氧化能力息息相关,是机体状态表现的重要指标;同样,GSH-Px也可以反应机体对自由基的清除能力,能够降低机体过氧化氢的含量,使脂质的过氧化作用减弱[23]。实验结果可知,山刺玫果多糖可使小鼠肝脏和血清中SOD和GSH-Px活力提高,T-AOC能力增强,MDA含量降低,进一步表明山刺玫果多糖具有抗氧化作用。
本研究表明,山刺玫果多糖能够提高机体抗氧化酶活性,缓解机体运动疲劳状态,具有明显的抗疲劳作用。因此,作为药食两用中药山刺玫果的有效部位,山刺玫果多糖在用于抗疲劳、抗氧化药物和保健食品方面有着广泛的应用前景,本实验为进一步开发利用山刺玫果资源提供了理论依据。

