线叶旋覆花总黄酮的提取工艺优化及其抗氧化活性分析
钱慧琴,秦晶晶,魏 婧,王帅帅,李佳祥,张凌云,闫福林
(新乡医学院三全学院,河南新乡 453000)
线叶旋覆花(Inulalineariifolia)为菊科旋覆花属多年生草本植物,地上部分入药,作中药“金沸草”用,具有散风寒、化痰饮、消肿毒、祛风湿之效,治疗风寒咳嗽,伏饮痰喘,胁下胀痛,可疮肿毒,风湿疼痛[1]。现代药理作用表明,线叶旋覆花在抗肿瘤、抗炎、镇痛等方面具有显示较好的生物活性,其主要活性成分为倍半萜、二萜、三萜、黄酮类、生物碱等[2-4]。
黄酮类化合物是一种多羟基酚类的次生代谢产物,普遍存在于自然界中。黄酮类化合物在抗氧化活性、保护肝脏、抗炎、抗肿瘤、抗病毒、抗菌等方面都具有良好的生物活性,被广泛应用于药品、保健品、化妆品等领域[5-7]。目前,崔莹等[8]通过正交试验得到线叶旋覆花同属植物旋覆花总黄酮提取工艺的最佳因素水平组合,聂利月[2]、陈莉萍[9]对线叶旋覆花天然活性成分进行研究,而对于线叶旋覆花总黄酮提取工艺及其抗氧化活性的研究尚未见文献报道。
为了研究线叶旋覆花总黄酮最佳的提取工艺,评价其抗氧化活性,提高线叶旋覆花的临床应用价值,本试验以线叶旋覆花地上部位为材料,在单因素试验的基础上,采用响应面法寻找线叶旋覆花总黄酮的最佳提取工艺,并评价其对DPPH·和·OH的清除能力,以期为线叶旋覆花的开发和利用提供科学支撑。
1 材料与方法
1.1 材料与仪器
线叶旋覆花 采集于南阳市桐柏县,经药学院闫福林教授鉴定为菊科旋覆花属植物线叶旋覆花的地上部分;芦丁对照品 中国食品药品检定研究院;1,1-二苯基-2-苦基肼自由基(DPPH·) 东京化成工业株式会社;L-抗坏血酸(VC) 上海源叶生物科技有限公司;水杨酸、硫酸亚铁、30%过氧化氢、氢氧化钠、亚硝酸钠、硝酸铝、无水乙醇 天津市德恩化学试剂有限公司。
T6型新世纪紫外可见分光光度仪 北京普析通用仪器有限公司;HH-S数显恒温水浴锅 金坛市金南仪器厂;HA2004型电子分析天平 上海象平仪器仪表有限公司。
1.2 实验方法
1.2.1 线叶旋覆花预处理 将采集的线叶旋覆花地上部分洗净,用滤纸吸干,于60 ℃烘干,粉碎,过60目筛,将烘干样品放入广口瓶中,备用。
1.2.2 线叶旋覆花总黄酮的提取 精密称定线叶旋覆花茎叶粗粉约1 g,按一定液料比(mL/g)加入一定体积分数的乙醇溶液,摇匀,于一定温度下提取一定时间,之后过滤,滤液减压浓缩至浸膏,少量无水乙醇溶解并转移至25 mL容量瓶,无水乙醇定容,即得供试品溶液。
1.2.3 单因素试验 按照“1.2.2”项下线叶旋覆花总黄酮的提取方法,考察乙醇体积分数、提取温度、液料比和提取时间对线叶旋覆花总黄酮提取量的影响。
1.2.3.1 乙醇体积分数对总黄酮提取量的影响 固定提取温度80 ℃,液料比30∶1 mL/g,提取时间60 min,提取次数1次,考察乙醇体积分数为40%、50%、60%、70%、80%、90%时对总黄酮提取量的影响,确定适宜的乙醇体积分数。
1.2.3.2 提取温度对总黄酮提取量的影响 固定乙醇体积分数80%,液料比30∶1 mL/g,提取时间40 min,提取次数1次,考察提取温度为50、60、70、80、90 ℃时对总黄酮提取量的影响,确定适宜的提取温度。
1.2.3.3 液料比对总黄酮提取量的影响 固定乙醇体积分数80%,提取时间40 min,提取温度80 ℃,提取次数1次,考察液料比为10∶1、20∶1、30∶1、40∶1、50∶1、60∶1 mL/g时对总黄酮提取量的影响,确定适宜的液料比。
1.2.3.4 提取时间对总黄酮提取量的影响 固定乙醇体积分数80%,提取温度80 ℃,液料比30∶1 mL/g,提取次数1次,考察提取时间为10、20、30、40、50、60 min时对总黄酮提取量的影响,确定适宜提取时间。
1.2.4 响应面试验 在单因素试验的基础上,采用Box-Behnken法进行试验设计,以乙醇体积分数、提取温度、液料比、提取时间为考察因素,以线叶旋覆花总黄酮提取量为响应值,采用4因素3水平的试验,确定线叶旋覆花总黄酮的最佳提取工艺,试验因素和水平见表1。

表1 响应面试验设计因素与水平Table 1 Factors and levels used in response surface analysis
1.2.5 标准曲线的制备 精确量取浓度为100 mg/mL芦丁标准品溶液0.50、1、2、3、4、5 mL,分别置于6个10 mL容量瓶中,每个容量瓶中各加入0.4 mL 5%亚硝酸钠溶液,摇匀,放置6 min,各依次加入0.4 mL 10%硝酸铝溶液,6 min后再各加入4 mL 4% NaOH溶液,无水乙醇定容至刻度,摇匀,反应15 min后,于510 nm处测定其吸光度。空白对照组用相应的试剂溶液进行上述操作处理。以芦丁浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得回归方程为y=0.0113x+0.0184,相关系数r=0.9992。此方程具有良好的线性关系,可用于评价线叶旋覆花总黄酮的质量浓度。
1.2.6 线叶旋覆花总黄酮含量测定 精密吸取线叶旋覆花供试品溶液0.5 mL,置于10 mL容量瓶中,按 “1.2.5” 项下方法测吸光度。根据芦丁标准曲线回归方程,计算线叶旋覆花总黄酮质量浓度,然后总黄酮提取量计算见式1。
式(1)
其中:Y为线叶旋覆花总黄酮提取量,mg/g;C为线叶旋覆花总黄酮的质量浓度,mg/mL;V为测量总黄酮提取液体积mL;N为稀释倍数;m为线叶旋覆花干品质量,g。
1.2.7 线叶旋覆花总黄酮抗氧化活性测定
1.2.7.1 清除 DPPH·能力测定 参照Cai Hao[10]等的方法并加以修改,将最佳提取工艺条件下提取得到的线叶旋覆花总黄酮溶液配成0.03、0.06、0.08、0.10、0.14、0.20、0.24、0.26 mg/mL不同质量浓度的样品溶液,吸取2 mL不同质量浓度的样品溶液置于试管中,依次加入1.3×10-5mol/L的DPPH·乙醇溶液2 mL,摇匀,避光反应30 min后,于517 nm波长处测其吸光值A1。同时测定2 mL无水乙醇和2 mL DPPH·乙醇溶液的吸光度值A0,以及2 mL无水乙醇和2 mL不同质量浓度的线叶旋覆花总黄酮溶液的吸光度值A2。对照组为相同质量浓度的VC溶液。DPPH·清除率计算见式2。

式(2)
式中,A0为2 mL DPPH·乙醇溶液+2 mL无水乙醇;A1为2 mL DPPH· 乙醇溶液+2 mL样品溶液;A2为2 mL无水乙醇+2 mL样品溶液。
1.2.7.2 线叶旋覆花总黄酮清除羟基自由基能力测定 参照许建本等[11]的方法并加以修改,将最佳提取条件下提取得到的线叶旋覆花总黄酮溶液配成0.5、1.0、1.5、2.0、2.5、3.5、4.5、5 mg/mL不同质量浓度的样品溶液,吸取1 mL 不同质量浓度的样品溶液置10 mL容量瓶中,依次加入1 mL 9 mmol/L水杨酸-乙醇溶液,1 mL 9 mmol/L FeSO4,最后加入1.0 mL 8.8 mmol/L的H2O2启动反应,去离子水定容至刻度,于 37 ℃水浴放置30 min后,冷却,在510 nm处测定吸光值A1。同时测定以1 mL无水乙醇代替样品提取液的吸光度值A0,以及1 mL去离子水代替8.8 mmol/L的H2O2,测定吸光度值A2。对照组为相同质量浓度的VC溶液。羟自由基清除率计算见式3。

式(3)
式中,A0为空白吸光度;A1为样品溶液吸光度;A2为样品溶液的底吸光度。
1.3 数据处理
所有试验平行测定3次,运用响应面分析软件Design Expert 8.0.6、SPSS22.0及Excel进行相关图表的绘制以及数据的处理。
2 结果与分析
2.1 单因素试验结果
2.1.1 乙醇体积分数的影响 乙醇体积分数对线叶旋覆花总黄酮提取量的影响见图1。
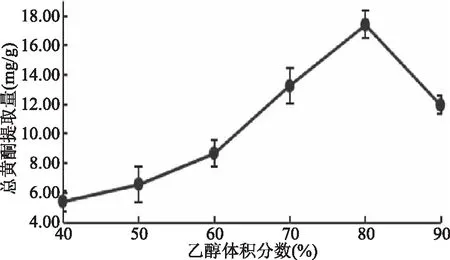
图1 乙醇体积分数对线叶旋覆花总黄酮提取量的影响Fig.1 Effect of ethanol concentrationon flavonoid yield from Inula lineariifolia
由图1可知,乙醇体积分数在40%~80%之间,线叶旋覆花总黄酮提取量随着乙醇体积分数的增大而增大;乙醇体积分数为80%时,总黄酮提取量达到最大值;乙醇体积分数超过80%,总黄酮提取量呈下降趋势。这与井文华等[12]的研究报道的乙醇对于总黄酮提取量影响的变化趋势一致。这可能是因为乙醇体积分数为80%时,线叶旋覆花黄酮类物质的溶出趋于饱和,随着乙醇体积分数继续增加,提取溶剂的极性相对降低,促进线叶旋覆花中亲脂性强的化学成分的溶出,最终导致线叶旋覆花总黄酮提取量相对下降。因此,选取80%乙醇体积分数为宜。
2.1.2 提取温度的影响 提取温度对线叶旋覆花总黄酮提取量的影响见图2。

图2 提取温度对线叶旋覆花总黄酮提取量的影响Fig.2 Effects of extraction temperatureon flavonoid yield from Inula lineariifolia
由图2可知,提取温度在40~80 ℃范围内,线叶旋覆花总黄酮提取量随着提取温度的增加而增大;提取温度达到80 ℃时总黄酮提取量达到最高;超过80 ℃时,总黄酮提取量呈下降趋势。这与曾桥等[13]研究报道的温度对总黄酮提取量影响的变化趋势一致。可能是因为温度升高,有利于加快分子运动的速度,线叶旋覆花中黄酮类化合物的渗透、扩散和溶解速度也会加快,黄酮类物质溶出量增加。当温度升高到一定程度,黄酮类物质的结构遭到破坏,且其他脂溶性杂质的溶出增加,致使总黄酮提取量降低[14]。所以,选取提取温度80 ℃为宜。
2.1.3 液料比的影响 液料比对线叶旋覆花总黄酮提取量的影响见图3。

图3 液料比对线叶旋覆花总黄酮提取量的影响Fig.3 Effects of liquid-to-solid ratioon flavonoid yield from Inula lineariifolia
由图3可知,液料比在10∶1~40∶1 mL/g范围内,线叶旋覆花总黄酮提取量随液料比的增加而增大;液料比为40∶1 mL/g时,总黄酮提取量最大;液料比超过40∶1 mL/g,总黄酮提取量呈现下降的趋势。这与王慧芳等[15]研究料液比对总黄酮提取量影响的研究结果一致。这可能是因为随着液料比的增加,增加乙醇与线叶旋覆花粗粉的接触面积,有利于黄酮类物质溶出;当液料比为40∶1 mL/g时,线叶旋覆花黄酮类化合物的溶出逐渐趋于动态平衡;继续增加液料比,非黄酮类可溶性物质溶出增多,同时,后续浓缩提取液的时间也会增加。所以,选取液料比 40∶1 mL/g为宜。
2.1.4 提取时间的影响 提取时间对线叶旋覆花总黄酮提取量的影响见图4。
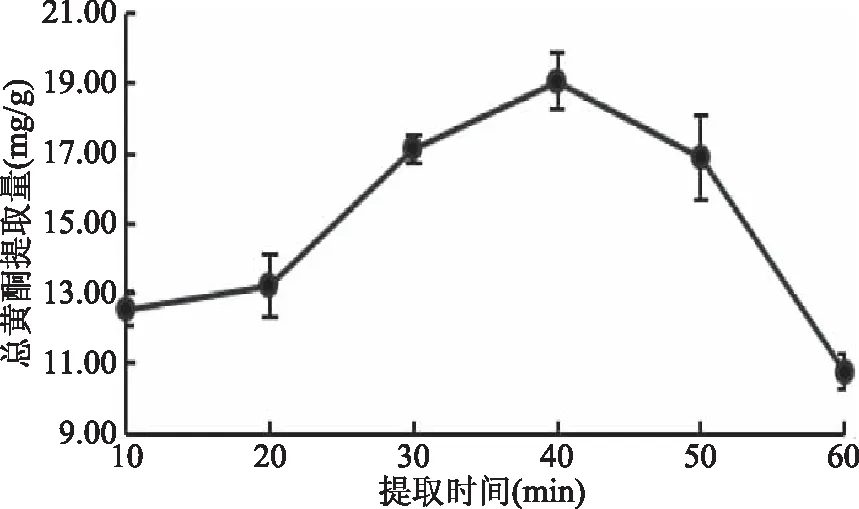
图4 提取时间对线叶旋覆花总黄酮提取量的影响Fig.4 Effect of extraction timeon flavonoid yield from Inula lineariifolia
由图4可知,提取时间在10~40 min之间,线叶旋覆花总黄酮提取量随着提取时间的增加而增大;当提取时间为40 min时,总黄酮提取量达到最高;超过40 min后,总黄酮的提取量呈现下降的趋势。这与林香信等[16]研究提取时间对总黄酮提取量影响的研究结果一致。这可能是因为提取时间过短,黄酮类物质不易溶出,使得总黄酮提取量较低。随着提取时间的延长,线叶旋覆花茎叶与乙醇充分接触,使线叶旋覆花黄酮类物质充分溶出,40 min时,黄酮类物质已基本溶出。40 min后,继续增加提取时间,在长时间高温提取的情况下,黄酮类物质可能发生氧化、降解或者是增加其他物质的溶出,致使总黄酮提取量下降。因此,选取提取时间40 min 为宜。
2.2 响应面法优化线叶旋覆花总黄酮提取工艺
2.2.1 响应面试验设计结果 根据单因素试验结果,选择乙醇体积分数(A)、提取温度(B)、料液比(C)、提取时间(D)4个因素按照表2设计进行试验,得到线叶旋覆花总黄酮提取量(Y),见表2。

表2 响应面优化试验设计与结果Table 2 Experimental design with experimental values offlavonoid yield for response surface analysis
2.2.2 响应面回归模型的建立及显著性分析 采用Design-Expert 8.0.6软件对试验结果进行回归拟合,得到以线叶旋覆花总黄酮提取量对为响应值的回归方程:Y=22.73-9.00A+0.31B-0.68C-1.21D-2.89AB+2.70AC-1.70AD+0.097BC+2.75BD-0.31CD-1.95A2+0.48B2-1.67C2-1.51D2(R2=0.9828),响应面回归模型方差分析结果见表3。
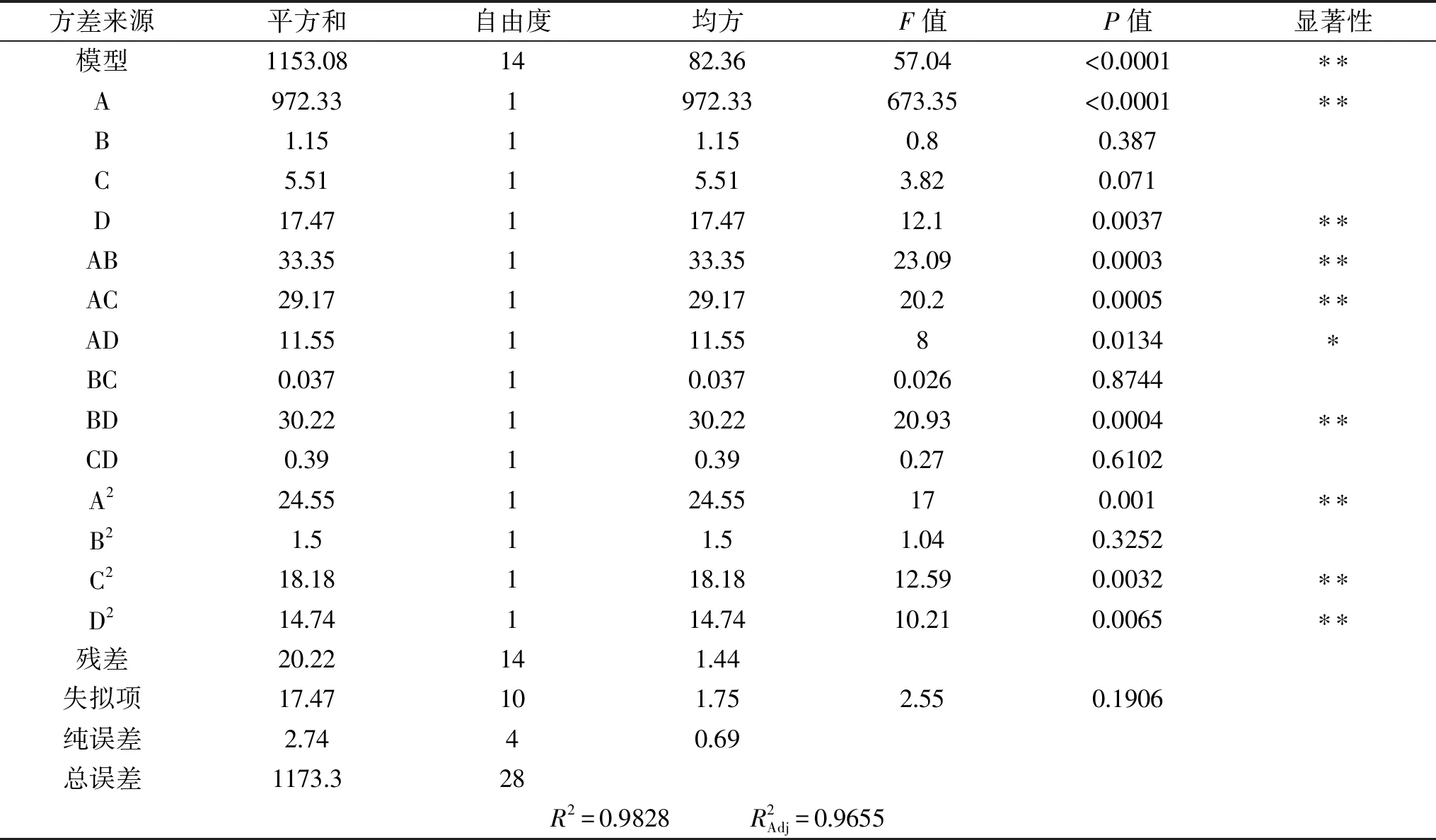
表3 响应面回归模型方差分析Table 3 The response surface quadratic model analysis of variance
模型中因素一次项乙醇体积分数(A)、提取时间(D),二次项A2、C2、D2对线叶旋覆花总黄酮提取量有极显著的影响。交互项中的乙醇体积分数(A)和提取温度(B)、乙醇体积分数(A)和液料比(C)、提取温度(B)和提取时间(D)对线叶旋覆花总黄酮提取量影响显著,交互项乙醇体积分数(A)和提取时间(D)有显著影响,其余项均不显著。根据F值的大小,各个因素对线叶旋覆花总黄酮提取量的影响顺序依次为:乙醇体积分数(A)>提取时间(D)>液料比(C)>提取温度(B)。
2.2.3 响应面优化 各因素交互作用对线叶旋覆花总黄酮提取量影响的响应面见图5~图8。图5~图8所呈现的响应曲面坡度陡峭,说明乙醇体积分数与提取温度、乙醇体积分数与液料比、乙醇体积分数与提取时间、提取温度与提取时间对线叶旋覆花总黄酮提取量的影响显著,这与响应面回归模型分析结果一致。

图5 乙醇体积分数与提取温度的响应曲线Fig.5 RSM analysis for interactive effects ofalcohol concentration and extraction temperature
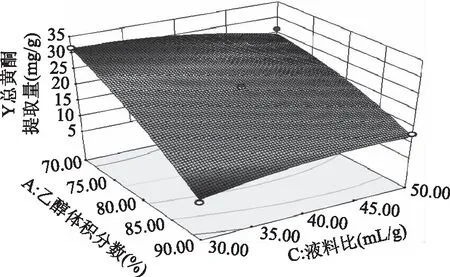
图6 乙醇体积分数与液料比的响应曲线Fig.6 RSM analysis for interactive effects of alcoholconcentration and solvent-to-solid ratio
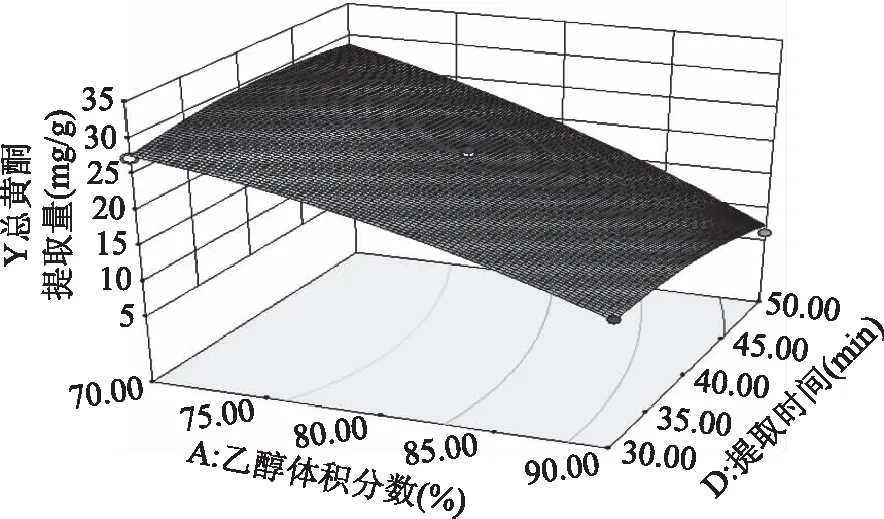
图7 乙醇体积分数与提取时间的响应曲线Fig.7 RSM analysis for interactive effects ofalcohol concentration and extraction time
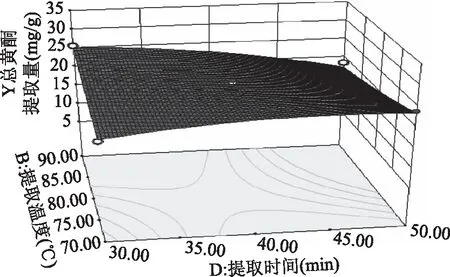
图8 提取温度与提取时间的响应曲线Fig.8 RSM analysis for interactive effects ofextraction temperature and extraction time
2.2.4 最优工艺及验证试验 由Design-Expert 8.0.6软件得出的最佳提取工艺为:乙醇体积分数70.28%,提取温度87.71 ℃,液料比31.37∶1 (mL/g),提取时间40.40 min,此条件下线叶旋覆花总黄酮提取量最高,预测值为33.982 mg/g。为了验证此条件的有效性,并结合实验可操作性,将最佳提取工艺修正为:乙醇体积分数70%、提取温度87 ℃、液料比31∶1 mL/g、提取时间40 min,此条件下,重复3次试验,线叶旋覆花总黄酮提取量为(33.62±0.0207) mg/g,与预测值基本一致,说明该模型预测的线叶旋覆花总黄酮的提取工艺参数可靠可行。
2.3 抗氧化活性实验结果与分析
2.3.1 清除DPPH·的能力 如图9所示,当线叶旋覆花总黄酮质量浓度在0.03~0.24 mg/mL范围内,对DPPH·的清除率随着质量浓度的增加显著增大;当质量浓度超过0.24 mg/mL,对DPPH·清除率趋于平缓。通过SPSS 22.0软件数据分析,线叶旋覆花总黄酮对DPPH·的半数清除率IC50为0.074 mg/mL,VC对DPPH·的半数清除率IC50为0.082 mg/mL,由此可见,线叶旋覆花总黄酮对DPPH·的清除能力高于VC,表现出较强的抗氧化活性。

图9 线叶旋覆花总黄酮和VC的DPPH·清除能力Fig.9 DPPH free radical scavenging capacity offlavonoids from Inula lineariifolia and VC
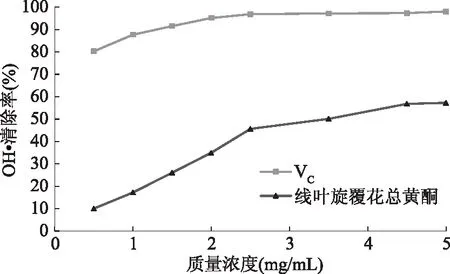
图10 线叶旋覆花总黄酮和VC的OH·清除能力Fig.10 hydroxyl radical scavenging capacity offlavonoids from Inula lineariifolia and VC
2.3.2 线叶旋覆花总黄酮清除羟基自由基的能力 如图10所示,线叶旋覆花总黄酮的质量浓度在0.5~4.5 mg/mL范围内,对OH· 的清除能力随着质量浓度的增加逐渐增强,当线叶旋覆花总黄酮质量浓度超过4.5 mg/mL,对OH·的清除逐渐趋于平缓,基本保持在57%以上,其清除能力始终弱于VC,但依然有着明显的清除羟基自由基的作用。这可能是因为VC本身对羟自由基的清除能力较高,且线叶旋覆花最佳提取温度过高,其他杂质溶出过多,后期提取液分离纯化不彻底,最终导致黄酮类化合物与其他物质之间的相互作用,致使线叶旋覆花总黄酮对羟自由基的清除能力弱于VC[17]。
3 结论
通过响应面法建立线叶旋覆花总黄酮提取工艺的回归方程,计算出最佳提取条件为:乙醇体积分数为70%、提取温度为87 ℃、液料比为31∶1 mL/g、提取时间40 min,此条件下,线叶旋覆花总黄酮提取量为(33.62±0.0207) mg/g,本研究可为线叶旋覆花总黄酮的有效提取提供可靠依据。体外抗氧化活性研究表明,线叶旋覆花总黄酮对DPPH自由基的清除能力明显高于VC,但是对羟基自由基的清除能力明显弱于VC。线叶旋覆花具有一定的抗氧化活性,可以为线叶旋覆花总黄酮的生物活性物质的开发提供理论依据。下一步主要探讨线叶旋覆花总黄酮成分的组成,以及黄酮类化合物抗肿瘤方面的生物活性,进一步提高线叶旋覆花的附加值,产生更高的经济效益。

