不同11S/7S比值原料豆乳的乳液特性研究
,4
(1.东北农业大学食品学院,黑龙江哈尔滨 150030;2.北部湾大学食品工程学院,广西钦州 535011;3.国家大豆工程技术研究中心,黑龙江哈尔滨 150028;4.东北农业大学大豆生物学教育部重点实验室,黑龙江哈尔滨 150030)
豆乳是以大豆为原料制备的植物蛋白饮料,在我国具有悠久的历史。豆乳中富含蛋白质、脂肪、碳水化合物、矿物质等物质,营养丰富[1-2],深受消费者欢迎。大豆经浸泡、磨浆、过滤、均质、热处理、灭菌等工艺环节制成商业豆乳[3],因此豆乳品质会受加工工艺的影响,如加热杀菌会导致豆乳蛋白发生聚集和变性,使豆乳中蛋白质溶解度增加[4-5],均质工艺可降低豆乳蛋白粒径,增加蛋白分散性,提高豆乳的物理稳定性[6-7]。另外,原料中蛋白组成也会影响豆乳在制备豆腐方面的品质特性,张新艳等[8]研究发现原料中可溶性蛋白含量高的豆乳氯化钙凝聚性差,11S/7S比值大(2.40)的原料豆乳较易在Ca2+存在条件下凝固。Tezuka等[9]证实原料11S中亚基A1和A2多的豆乳蛋白易聚集,导致生成的豆腐断裂应力值高。但目前鲜有原料中蛋白11S/7S比值对豆乳乳液特性的研究。
大豆蛋白由2S、7S、11S、15S蛋白组成,其中11S(大豆球蛋白)和7S(β-伴大豆球蛋白)是大豆蛋白的主要组成成分,约占总蛋白的70%,决定了大豆蛋白的主要功能特性[10]。7S球蛋白是一个三聚体的糖蛋白,由α、α′和β三个亚基通过疏水作用和氢键组成[11]。11S球蛋白由酸性亚基A和碱性亚基B组成,AB亚基通过疏水键和二硫键堆积使11S球蛋白形成六聚体[10]。Perrechil等[12]研究显示7S具有良好的乳化特性,它可使胶体溶液保持稳定,而11S组分凝胶性能突出,它在溶液中易于凝聚,因此由7S作为乳化剂比11S作为乳化剂的胶体溶液稳定性好[13]。但与分离提纯的11S和7S蛋白不同,豆乳是一个多相混合体系,特别是经加热、均质后豆乳中蛋白构象和存在状态均发生改变,与蛋白纯天然形式存有差别,因此增加了原料中蛋白11S/7S比值对豆乳特性影响的不确定性。
本实验采用7种不同11S/7S比值原料大豆制备豆乳,通过考察蛋白溶解度、粘度、蛋白粒径分布、Zeta电位、游离巯基、疏水性指数和沉淀率,探讨大豆蛋白11S/7S比值对豆乳乳液特性及稳定性的影响,以期为提供适宜豆乳加工的大豆品种提供科学理论支持。
1 材料与方法
1.1 材料与仪器
7个大豆品种(品种1、品种2、品种3、黑农52、黑农64、黑农68、黑农84)均为干豆,前三个大豆品种数据处于未公开阶段,故统一采用编号为V1,V2,V3,V4,V5,V6,V7 均由黑龙江省绿色食品科学研究院提供;十二烷基硫酸钠(SDS) 北京博奥拓达科技有限公司;Tris试剂、甘氨酸、EDTA试剂、丙烯酰胺、甲叉双丙烯酰胺、四甲基乙二胺(TEMED)、考马斯亮蓝R-250、5,5′-二硫双-2-硝基苯甲酸(DTNB) 北京索莱宝科技有限公司;8-苯胺基-1-萘磺酸(ANS) Sigma公司。
DYCZ-24EN双垂直电泳仪 北京六一公司;TU-1901双光束紫外分光光度计 北京普析通用仪器有限责任公司;Kjeltec 8400全自动定氮仪 福斯分析仪器公司;NDJ-8S旋转粘度计 上海平轩科学仪器有限公司;激光粒度仪(Zeta size Nano-ZS90) 英国马尔文公司;F-4500荧光分光光度计 日本HITACHI公司。
1.2 实验方法
1.2.1 大豆分离蛋白(SPI)的提取 参照周宇峰方法[14]并稍作修改,将不同品种大豆磨碎后分别过60目筛,将大豆粉与正己烷按质量比(g/g)为1∶10的比例混合,25 ℃室温下搅拌2 h后,离心(8000 r/min,15 min,20 ℃),弃上清液,保留沉淀,重复3次,得到脱脂大豆,自然风干后用于提取大豆分离蛋白。
参考尹秀莲方法[15]并稍作修改。将各品种脱脂大豆溶于水使其料液质量比(g/g)为1∶10,用1 mol/L NaOH调pH至8.5,搅拌1 h,离心(10000 r/min,15 min,20 ℃),取上清液,沉淀加水进行二次提取,将两次离心得到的上清液混合,用1 mol/L HCl调节pH至4.5,搅拌1 h,离心(10000 r/min,10 min,20 ℃),弃上清液。将沉淀加一定量的水溶解,用1 mol/L NaOH调节pH至7.0,透析液冻干后得到SPI,用于电泳点样。
1.2.2 蛋白亚基含量测定 参考周宇峰方法[14]并稍作修改,采用SDS-PAGE凝胶电泳,浓缩胶和分离胶浓度分别为5%和12%(5%浓缩胶由30%丙烯酰胺溶液、0.5 mol/L Tris-HCl溶液(pH6.8)、10% SDS、10%过硫酸铵和TEMED配制;12%分离胶由30%丙烯酰胺溶液、1.5 mol/L Tris-HCl溶液(pH8.8)、10% SDS、10% AP和TEMED配制)。用分离胶和浓缩胶制成凝胶之后,将样品煮沸5 min后进行上样,上样量为5 μL,将电泳装置与电源相接,初始电压为80 V,当样品跑至分离胶时将电压调至120 V。条带跑至距底端1 cm时,切断电源,剥离凝胶,固定12 h后,用考马斯亮蓝R-250进行染色4 h,再进行脱色,凝胶底色脱到透明后,用Image Lab扫描软件进行扫描,分析大豆分离蛋白各亚基组分的相对含量。
1.2.3 豆乳的制备 参照Mullin方法[16]稍作修改,将不同品种大豆用10倍质量的水浸泡过夜,过滤多余水分,按水与大豆蛋白质比例23∶1添加制备豆乳用水,用破碎机高速混合4 min,经纱布过滤得到生豆乳,将各生豆乳中蛋白浓度调节至一致,经80 MPa均质后,100 ℃沸水浴加热25 min制得熟豆乳。
1.2.4 溶解度的测定 参照姜梅方法[17]并稍作修改,将豆乳在4 ℃、10000 r/min条件下离心10 min,用凯氏定氮法测定上清液中的蛋白质含量。在本实验豆乳中的蛋白质溶解度按下面公式计算。

1.2.5 豆乳蛋白的粒径分布 参照Wang方法[18]稍作修改,将豆乳稀释200倍,利用激光粒度仪检测豆乳粒径,遮光度为43%~47%,其中蛋白折射率为1.451,分散剂折射率为1.330。
1.2.6 粘度的测定 采用NDJ-8S旋转粘度计测定豆乳粘度,采用1号转子,测定温度为25 ℃。
1.2.7 Zeta电位测定 参照施小迪方法[19]稍作修改,将豆乳稀释100倍后,采用激光粒度仪测豆乳Zeta电位,测定温度为25 ℃。
1.2.8 游离巯基的测定 参照阮奇珺方法[20]并稍作修改。取1 mL豆乳稀释液(稀释30倍)加4 mL的Tris-Gly缓冲液(0.086 mol/L Tris、0.09 mol/L甘氨酸、4 mmol/L EDTA,pH8.0)和0.05 mL浓度为4 mg/mL的DTNB,25 ℃保温15 min后,于412 nm处测吸收值,以不加DTNB的样品作为空白。

式中:A412:加DTNB时样品的吸光度与不加DTNB时样品的吸光度的差值;D:样品稀释系数;C:样品的蛋白质浓度 mg/mL。

表1 不同品种大豆蛋白亚基含量及11S/7S比值Table 1 Soybean protein subunit contents and 11S/7S ratio of different varieties
注:表中同列不同字母表示差异显著(P<0.05)。
1.2.9 荧光光谱及表面疏水性的测定 参照左锋方法[21]并稍作修改。
荧光光谱的测定:用pH7.0磷酸盐缓冲液将豆乳稀释至蛋白浓度为0.1 mg/mL,用F-4500荧光分光光度计进行测定,激发波长为290 nm,发射光谱范围为300~450 nm,狭缝间距均为5 nm。
表面疏水性的测定:用pH7.0磷酸盐缓冲液将豆乳稀释,10000 r/min速度下离心20 min,取上清液配制浓度分别为0.02、0.04、0.06、0.08 mg/mL的溶液,加入20 μL浓度为8×10-3mol/L的ANS溶液,于避光处反应15 min后,用F-4500荧光分光光度计进行测定,激发波长为370 nm,发射波长为490 nm,狭缝间距均为5 nm。以荧光强度对蛋白浓度作图,得到的斜率即为豆乳蛋白的表面疏水指数H0。
1.2.10 豆乳物理稳定性的测定 豆乳物理稳定性用沉淀率表达。具体测定方法参照胡明明[22]方法并作修改,取50 mL豆乳于离心管中,离心(3000 r/min,45 min,20 ℃),倒出上清液,并将离心管倒置5 s后,称取此时沉淀物的质量,沉淀率按下式计算。

1.3 数据处理
所有实验均进行3次,采用SPSS 16.0软件进行ANOVA差异显著性分析和相关性分析,P<0.05时为差异显著性,采用Origin 8.0绘图。
2 结果与分析
2.1 大豆蛋白亚基组成的测定
通过多个品种大豆分离蛋白的SDS-PAGE凝胶电泳实验结果,筛选出7个不同11S/7S比值的大豆品种,各品种大豆中蛋白亚基组成如图1所示。七个品种大豆蛋白亚基组成基本一致,但不同品种间相同亚基含量存在差异。

图1 不同品种大豆蛋白组分电泳图Fig.1 Electrophoresis of different soybean protein components注:M为蛋白标准品的分子质量,V1~V7为大豆品种。
表1显示不同品种大豆中各亚基相对含量不同,导致各品种大豆中蛋白11S/7S比值存有差异。各品种大豆11S/7S比值在0.55~5.09之间。其中V1的11S/7S比值最小,为0.55,V3的11S/7S比值稍高于V1,为1.36,V6的11S/7S比值为2.64,V4、V5、V7的11S/7S比值处于3.0和3.5之间,V2的11S/7S比值最大,为5.09。除V4与V5之间无显著性差异(P>0.05)外,其他各品种间11S/7S比值均存在显著性差异(P<0.05)。
2.2 溶解度分析
图2显示11S/7S比值不同的原料豆乳蛋白质溶解度存在差异。11S/7S比值较低的V3蛋白溶解度最高,为80.26%。其次是11S/7S比值最低的V1,蛋白溶解度78.62%,然后为V6。11S/7S比值处于3.00~3.49间的V4、V5、V7豆乳蛋白溶解度之间无显著性差异(P>0.05),在71%左右。11S/7S比值最大的V2豆乳蛋白溶解度最低,为60.45%。总体上,11S/7S比值越大的原料,其豆乳蛋白溶解度越小。

图2 不同11S/7S原料豆乳的溶解度Fig.2 Solubility of soymilk in different 11S/7S soybean注:不同字母表示数值间差异显著(P<0.05)。图4~图6、图8、图9同。
溶解度是蛋白质水合能力的重要体现,蛋白质水合作用越强其溶解度越大[17]。7S是一种糖蛋白,易与水分子结合,因此亲水性能较好;而11S由于不含糖,亲水性弱[23]。V1和V3中7S组分含量较高,11S含量低,且经加热后7S聚集,导致蛋白溶解度高。V2中11S含量高,导致蛋白亲水性弱,溶解度低。Nik等[10]研究发现,不同基因型原料豆乳经加热后11S/7S比值低的豆乳溶解性好,这与本文研究结论一致。
2.3 豆乳粒径分布
图3显示豆乳粒径分布由于原料中11S/7S比值不同而存在差异。11S/7S比值较小的V1、V3、V6的豆乳粒径均分布在较小粒径区域内,粒径分布均匀,呈单峰。伴随11S/7S比值的增大,V5、V4、V7、V2豆乳粒径分布范围逐渐增加,粒径分布曲线右移。特别是V2、V5在0~0.30 μm和0.40~0.90 μm处呈双峰分布,显示两个品种的豆乳粒径分布不均。

图3 不同11S/7S原料豆乳蛋白粒径分布Fig.3 Particle size distribution of soymilkprotein in different 11S/7S soybean

表2 不同11S/7S原料豆乳蛋白平均粒径Table 2 Average particle size of soymilk protein in different 11S/7S soybean
表2显示蛋白平均粒径最小的是11S/7S比值最小的V1制备的豆乳,仅为0.27 μm,其次是11S/7S稍大的V3豆乳,为0.30 μm,然后依次为V6,V5、V4、V7,11S/7S比值最大的V2平均粒径最大,达0.52 μm。即大豆中蛋白11S/7S比值越高,其制备的豆乳平均粒径越大。大豆蛋白11S组分中S-S含量较多,受热时S-S易于架桥,同时S-S键易与其他基团发生交联反应产生聚合,从而使蛋白高分子化[23],7S组分中α′和α亚基受热时以可溶性蛋白形式存在[24]。V1、V3、V6中7S组分含量较高,加热后的豆乳蛋白可溶性强,不易聚集,因此蛋白平均粒径较小且粒径分布均一。V2、V5、V4、V7中11S组分含量较高,因此豆乳蛋白易聚集,分散性差,导致蛋白平均粒径偏大且粒径分布不均,增加了豆乳的不稳定性。Nik[25]研究大豆蛋白亚基组成和加工条件对豆乳粒径分布的影响,发现热处理能改善豆乳粒径,但11S/7S比值高(1.18~1.5)的豆乳平均粒径比11S/7S比值低(0.21~0.65)的平均粒径大,这与本文研究结果一致。
2.4 粘度分析
图4显示豆乳粘度最低的是11S/7S比值最低的V1和V3,在5 mPa·s左右;其次是11S/7S比值2.64的V6,粘度6.17 mPa·s,然后为11S/7S比值3.00~3.49的V4、V5、V7,三者的粘度无显著性差异。11S/7S比值最高的V2粘度最高,为12.37 mPa·s。即豆乳粘度随原料中11S/7S值的增加而升高。

图4 不同11S/7S原料豆乳的粘度Fig.4 Viscosity of soymilk in different 11S/7S soybean
粘度体现溶液的流体性质,与蛋白水合作用密切相关,蛋白亲水能力强,其溶液粘度低[17]。另外粘度受蛋白粒径影响,粒径小的蛋白分散性好,水合能力强,其溶液粘度小,而粒径大的蛋白分散性弱,其溶液粘度较高[26]。7S含量高的V1、V3等原料豆乳中蛋白平均粒径小(见2.3),溶解性好(见2.2),提高了豆乳颗粒的分散性,因此豆乳粘度小。而11S含量多的V2等原料豆乳受热后11S组分中的二硫键发生交联导致蛋白聚集,蛋白粒径大,同时二硫键的架桥使蛋白交联形成坚固、稳定的网状结构,阻碍了蛋白与水的结合[27],从而增加了豆乳粘度。
2.5 Zeta电位分析
不同原料豆乳Zeta电位情况如图5所示。Zeta电位绝对值最高的是11S/7S最低的V1和V3制备的豆乳,分别为23.93、23.47 mV。其次是V6,为22.63 mV,然后为11S/7S比值在3.00~3.49范围内的V4、V5、V7;11S/7S比值最高的V2豆乳Zeta电位绝对值最低,为19.1 mV。即原料大豆中11S/7S比值越高,豆乳电位绝对值越低。
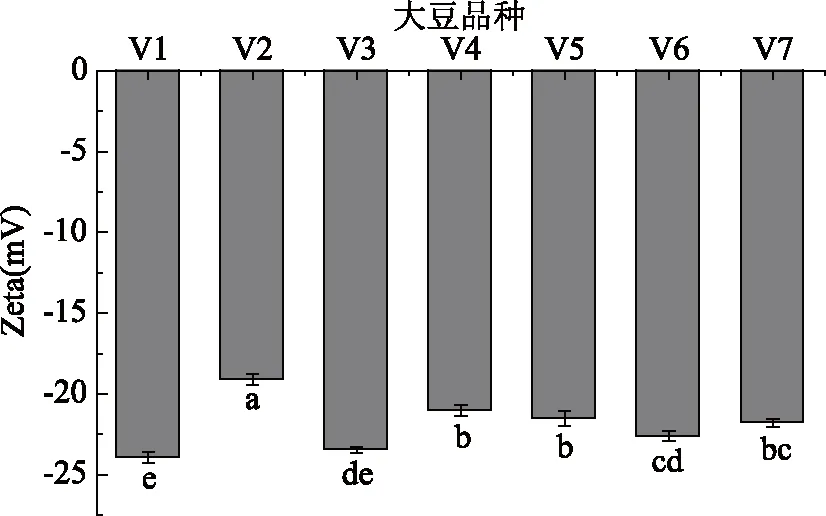
图5 不同11S/7S原料豆乳蛋白Zeta电位Fig.5 Zeta potential of soymilkprotein in different 11S/7S soybean
Zeta电位是衡量分散体系稳定性的重要标准。蛋白间电位绝对值高,即所带电荷多,彼此间排斥力大,蛋白不易聚集,体系稳定,反之,蛋白间Zeta电位绝对值低,所带电荷少,蛋白分子间排斥力小,分子倾向于聚集[28],体系不稳定。研究发现分散体系中粒径小的物质电位绝对值较高,反之,粒径大的物质其Zeta电位绝对值较低[27]。另外,Xu等[13]在研究由大豆分离蛋白、7S、11S分别作为乳化剂制备的乳状液时,发现pH为7.0时,由7S球蛋白作为乳化剂的乳状液Zeta电位绝对值要大于11S球蛋白作为乳化剂的乳状液,即7S球蛋白表面带有更多的电荷。本实验中各原料所制备的豆乳pH均在7.0附近。V1、V3中7S蛋白含量高,且豆乳中蛋白平均粒径小,因此Zeta绝对值最大,相应地,伴随原料中11S/7S比值的增加,豆乳Zeta电位绝对值逐渐减少。V2中11S含量最多,且蛋白平均粒径最大,因此豆乳中蛋白Zeta绝对值最小。本研究中11S/7S比值介于3.00~3.49之间的原料豆乳Zeta电位绝对值无显著性差异(P>0.05)。
2.6 游离巯基分析
适量的游离巯基,能够改善蛋白质的柔性,提高豆乳蛋白的乳化能力和稳定性[5]。不同11S/7S比例的原料豆乳中游离巯基情况如图6所示。11S/7S比值较低的V3豆乳中游离巯基含量最高,为5.04 μmol/g,其次为11S/7S比值最低的V1,为5.29 μmol/g,然后依次为V6、V5、V4、V7。11S/7S比值最大的V2豆乳中游离巯基含量最低,为2.09 μmol/g。总体上,豆乳中游离巯基的含量随11S/7S比值的增大而减小。本实验中11S/7S比值在3.00~3.49范围内的V4、V5、V7豆乳游离巯基含量无显著性差异(P>0.05)。

图6 不同11S/7S原料豆乳中游离巯基含量Fig.6 Content of free thiol groupin soymilk in different 11S/7S soybean
豆乳短时受热时11S球蛋白会解离出比7S更多的游离巯基,但高温长时加热时,11S解离的游离巯基会再次结合生成S-S键,导致11S最终的游离巯基总量降低[29]。由于本实验中豆乳100 ℃长时加热(25 min),造成11S含量高的豆乳中游离巯基含量低,而7S含量高的原料豆乳中游离巯基含量高。
2.7 豆乳的荧光强度与表面疏水性
豆乳的荧光强度实际上反映的是豆乳蛋白中疏水性色氨酸残基的荧光峰[30]。图7为不同11S/7S比值原料豆乳的荧光强度。V3豆乳的荧光强度最大,其次为V1制备的豆乳,然后依次为V6、V5、V7、V4。蛋白11S/7S比值最高的V2豆乳荧光强度最低。即豆乳荧光强度随原料中11S/7S比值的增大而减小。

图7 不同11S/7S原料豆乳的荧光光谱Fig.7 Fluorescence spectra of soymilkin different 11S/7S soybean
杨昱等[31]研究发现在pH1~13范围内,大豆7S蛋白的荧光强度都高于大豆11S的荧光强度,即7S中暴露在蛋白表面的色氨酸残基(疏水基团)更多。因此7S含量高的V3、V1荧光强度较大,相应地,随原料中11S/7S比值的增加,豆乳荧光强度逐渐降低,V2中11S/7S比值最大,因此荧光强度最低。
不同11S/7S比值的原料豆乳表面疏水指数H0如图8所示。V3豆乳表面疏水指数最高,为810.92,其次为V1,为782.13,然后依次为V6、V5、V4、V7。11S/7S比值最大的V2豆乳表面疏水指数最低,为534.57,即豆乳表面疏水指数随原料大豆中11S/7S比值的增大而减小,这与豆乳的荧光强度变化趋势一致。11S/7S比值在3.00~3.49范围的V4、V5、V7豆乳表面疏水指数无显著性差异。

图8 不同11S/7S原料豆乳的表面疏水性指数H0Fig.8 Surface hydrophobicity index(H0)ofsoymilk in different 11S/7S soybean
表面疏水性是蛋白重要的功能性质,它是维持蛋白质三级结构的主要作用力,决定蛋白质的空间构象[32]。多项研究表明大豆7S球蛋白比11S球蛋白含有更多的疏水性氨基酸,蛋白表面存有更多的疏水基团,即7S表面疏水作用强于11S球蛋白[33]。本实验各原料中11S和7S含量不同,因此豆乳表面疏水性指数存在差异。V1、V3中7S含量较多,因此具有较高的表面疏水性,相应地,伴随原料中11S比例的增加,豆乳表面疏水性指数逐渐降低,11S含量最多的V2表面疏水性最低。值得注意的是V3中11S/7S比值高于V1,但其豆乳荧光强度和疏水性指数却高于V1,这也许是在11S与7S含量差异不大的情况下,豆乳经高温热处理后,蛋白受热变性,蛋白分子链展开并且亚基解离,导致原包埋于11S蛋白结构内部的疏水基团暴露于蛋白表面,从而增加了表面疏水指数[34]。本研究中豆乳荧光强度,表面疏水指数与其游离疏基变化趋势一致。齐宝坤等[35]和Gu等[36]研究发现不同品种大豆分离蛋白的表面疏水性与游离疏基变化趋势一致,这与本实验的研究结果一致。
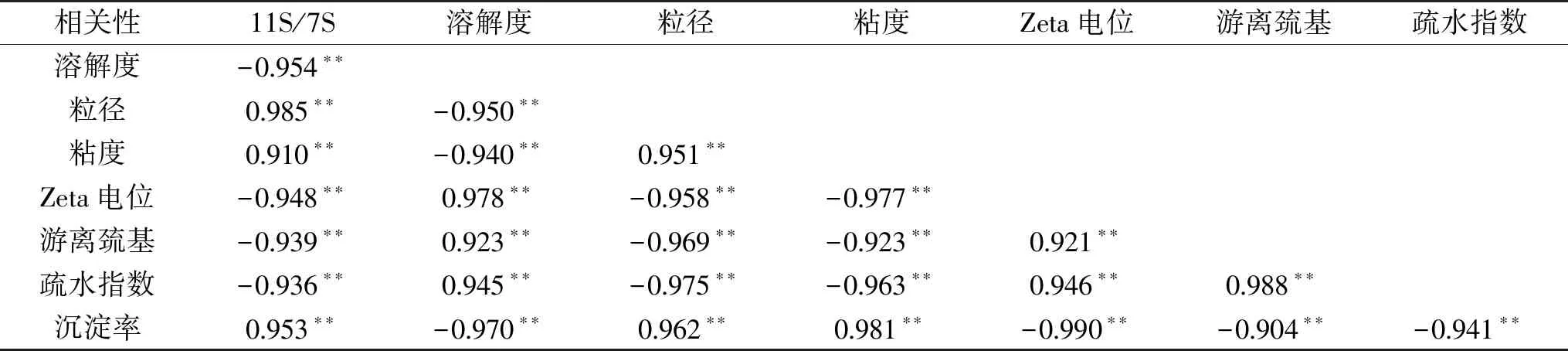
表3 大豆蛋白11S/7S比值与各指标相关性分析Table 3 Correlation analysis of 11S/7S ratio of soybean protein and various indexes
注:**极显著相关(P<0.01)。
2.8 豆乳的物理稳定性
豆乳贮存过程中易发生蛋白沉淀的不稳定现象,严重影响豆乳的感官品质。本实验中豆乳物理稳定性主要通过豆乳离心后的沉淀率表示。沉淀率越高意味豆乳的稳定性越低。图9显示11S/7S比值不同的原料豆乳沉淀率存在差异。豆乳沉淀率最低的是11S/7S比值最低的V1和V3,分别为2.02%、2.21%。其次是11S/7S稍高的V6,沉淀率为2.32%。然后是11S/7S比值在3.00~3.49范围内的V4、V5、V7,但三者豆乳沉淀率彼此间无显著性差异,均在2.70%左右。11S/7S比值最大的V2豆乳沉淀率最高,为3.41%。即11S/7S比值大的原料豆乳沉淀率高,豆乳稳定性低。

图9 不同11S/7S原料豆乳的沉淀率Fig.9 Precipitation rates of soymilkin different 11S/7S soybean
根据Stocks原理可知,粒子自然沉降或上浮的速度与粒子直径有关,若粒子直径大,则粒子沉降速度加快,从而破坏沉降平衡[22]。根据2.3实验结果可知11S/7S比值低的V1、V3和V6制备的豆乳蛋白平均粒径小,因此其沉淀率也较低;而11S/7S比值大的V2制备的豆乳平均粒径最大,所以沉淀率最高;V4、V5、V7平均粒径介于中间,因此沉淀率也介于所有品种之间。另外蛋白11S/7S比值小的豆乳Zeta电位绝对值大,对蛋白聚集起到了有效的抑制作用,因此沉淀率低,提高了豆乳的稳定性。左锋[21]在探究微压煮浆对豆乳蛋白粒子的影响中发现,蛋白组分Zeta电位绝对值增高可以降低豆乳的沉淀率,从而提高豆乳的储藏稳定性,这与本实验的研究结果一致。
2.9 大豆原料中蛋白11S/7S比值与各指标相关性分析
大豆原料中蛋白11S/7S比值与豆乳相关指标的关系如表3所示,大豆蛋白11S/7S比值与豆乳蛋白溶解度、Zeta电位绝对值、游离巯基含量、表面疏水指数呈极显著负相关(P<0.01),与豆乳蛋白粒径、粘度、沉淀率呈极显著正相关(P<0.01)。表明大豆原料中蛋白11S/7S比值与豆乳乳液特性和稳定性存在密切的相关性。另外,各指标间也存在紧密的相关性,豆乳蛋白溶解度、Zeta电位绝对值、游离巯基含量、表面疏水指数之间呈极显著正相关(P<0.01),而与粒径、粘度、沉淀率呈极显著负相关(P<0.01)。
3 结论
本实验结果显示当原料中蛋白11S/7S比值处于0.55~2.64时,豆乳中蛋白溶解度、Zeta电位绝对值和表面疏水性高,提高了蛋白的分散性,抑制了蛋白粒子间的聚集,因此沉淀率低,豆乳稳定性好;当原料中蛋白11S/7S比值处于3.0~5.09时,蛋白溶解度、Zeta电位绝对值和表面疏水性较低,导致蛋白易于聚集,豆乳沉淀率高,稳定性较差。而原料中蛋白11S/7S比值处于3.0~3.49时,各品种豆乳的稳定性没有显著差异。相关性结果显示大豆原料中蛋白11S/7S比值与豆乳蛋白溶解度、Zeta电位绝对值、游离巯基含量、表面疏水指数呈负相关(P<0.01),与蛋白粒径、豆乳粘度、沉淀率呈正相关(P<0.01)。因此,11S/7S比值较小(0.55~2.64)的大豆原料更适宜豆乳的生产。

