儿茶素类物质生物利用度研究进展
,2,*
(1.北京联合大学生物化学工程学院,北京 100191;2.生物活性物质与功能食品北京市重点实验室,北京 100191;3.北京联合大学功能食品科学技术研究院,北京 100023)
儿茶素类物质存在于多种植物及其制品中,如葡萄、茶叶、咖啡等,因其具有抗炎、抗氧化、抗癌等多种生理活性作用而受到广泛关注[1-4]。儿茶素分子以C6-C3-C6为骨架结构(如图 1),C 环 上C2和C3 位是手性碳原子。由于取代基团及位置不同,常见的儿茶素单体有 8 种:儿茶素(+)-catechin(C),表儿茶素(-)-epicatechin(EC),棓儿茶素(+)-gallocatechin(GC),表棓儿茶素(-)-epigallocatechin(EGC),儿茶素没食子酸(+)-catechingallate(CG),表棓儿茶素没食子酸(-)-epicatechingallate(ECG),棓儿茶素没食子酸(+)-gallocatechingallate(GCG)与表棓儿茶素没食子酸(-)-epigallocatechingallate(EGCG)。随着研究的深入,发现儿茶素类物质虽然具有多种生物活性,但其生物利用率较低,且受多种因素影响,如儿茶素本身的性质、化学稳定性及其在复杂生物体内的稳定性[5-6]。本文对近年来儿茶素类物质生物利用度影响因素及提高其生物利用度措施的相关研究现状进行综述,以期对其进一步开发利用提供参考。
1 儿茶素生物利用度的影响因素
1.1 儿茶素的溶解性
溶解度是指物质溶解于某种特定体积溶剂中形成均一溶液的最大量。溶解度与物质本身的化学结构、晶体状态以及溶剂的组成、溶剂的温度、pH等因素有关。溶解性对于口服物质的生物利用度至关重要,因为只有溶解的物质才有可能被胃肠道吸收。另外,溶出速度也对儿茶素的生物利用度起重要作用。如果溶出速度过慢,超出胃肠的蠕动吸收周期,还没有吸收就会被排出了[7]。Muller[8]综述了具有较高的生物利用度的物质的特征,如物质的分子量小于550 Da,有适宜的亲脂性与亲水性,且在pH=7.4的情况下,不带或仅部分带电等。儿茶素单体及其低聚体不溶于氯仿、石油醚、苯等非极性溶剂,溶于水、甲醇、乙醇、丙酮等极性溶剂。而极性强的物质难以通过生物膜的脂质双分子层,所以儿茶素类物质在消化道内的吸收效率很低。在体外实验中,儿茶素经常被溶于低浓度的有机溶剂[9],如甲醇、二甲基亚砜,这是否会提高儿茶素的溶解度或进一步提高其生物利用度还未见报道。
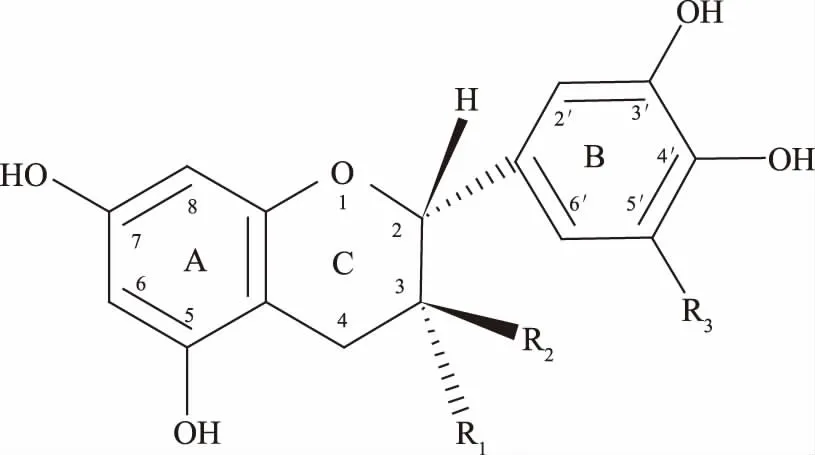
图1 儿茶素单体结构通式Fig.1 The structural formula of monomeric catechins
1.2 儿茶素的物理化学稳定性
儿茶素类物质在储存过程中,含量会逐渐下降。Friedman等[5]对市售的8种袋装茶叶中儿茶素物质在储存6个月内的稳定性进行研究,将茶叶置于20 ℃的环境中,分别存放1周、1个月、2个月及6个月时取样,用HPLC对样品中儿茶素的含量进行测定并对比,结果发现儿茶素的总量逐渐减少,其中含量较高的EGCG与ECG的减少量也较多。
1.2.1 温度的影响 儿茶素在热处理的过程中,可能会发生多种反应,如氧化、聚合及差向异构化[10-12]。Wang R等[10-11]的实验结果表明,茶儿茶素的异构化降解遵循一级反应,反应动力学的速率常数遵循阿伦尼乌斯方程。每摩尔EGCG差向异构化为GCG,每摩尔ECG差向异构化为CG,分别需要117.2、119.3 kJ热量。当温度在44 ℃以下时,以EGCG降解反应为主,当温度高于44 ℃时,(-)(GCG)差向异构化为(-)-EGCG的反应加剧,当温度升高到98 ℃或更高时,差向异构化变得更加突出。将浓缩的茶叶儿茶素加热到120 ℃保持2 h内,顺式结构的儿茶素(ECGC,EGC,ECG,EC)遵循明显的一阶降解反应,而反式的儿茶素在加热过程中可能发生了多种反应,如氧化、自身的降解以及异构化,在达到120 ℃ 40 min后,其百分含量变化达到一个高度后呈现平缓的趋势。在不同温度下(25、40、60、80、100、120 ℃),顺式儿茶素均呈现一阶降解反应,较高温度下降解的速率更快。在持续加热时,浓度较高的儿茶素溶液较浓度低的溶液降解速度慢,这可能跟儿茶素浓度较高相应的溶液pH也较高有关系[6]。
1.2.2 湿度的影响 Ortiz等[13]将绿茶干粉置于22 ℃环境中,湿度从0%~85%,放置3个月,用HPLC检测样品中的儿茶素(EC、EGC、ECG与EGCG)的含量变化。结果发现,随着湿度的增大,单种儿茶素及儿茶素总量的化学降解都显著增强了。湿度在43%以下的儿茶素在3个月内能保持化学稳定,但出现了明显的结块现象。实验中还设置了在绿茶粉中添加蔗糖、柠檬酸及VC的处理组,发现添加酸的组在湿度达到58%后降解明显,尤其是同时添加了柠檬酸与VC的绿茶粉,降解最严重。
1.2.3 pH的影响 pH对儿茶素的稳定性影响较大,屠幼英[14]在对绿茶提取物理化性质进行研究时发现,pH4.0~6.0是儿茶素类物质比较稳定的pH范围。何小解等[15]利用模拟胃肠液环境对儿茶素的稳定性进行实验,其中模拟胃肠液的pH分别是1.3和7.6,结果发现1 h后,人工模拟胃液中儿茶素含量减少了50.3%,4 h时趋于稳定,减少了59.4%;而在人工模拟肠液中,儿茶素在1 h时减少了15.3%,5 h时减少了30.9%,即较高和较低的pH都会降低儿茶素的稳定性。
不同结构的儿茶素受pH的影响不同,顺式儿茶素在pH4~5.2之间最稳定,超过5.2,降解速度随pH升高而增快。当pH低于4时,儿茶素的降解速度也加快。反式儿茶素的比例,在pH1.5时最低,当pH大于4或之上时,随着pH的升高而增加,暗示异构化也随着pH的升高而加剧[6]。另外,无论在酸性还是碱性pH下,二聚体比单体的稳定性都差。B2与B5在模拟胃液(pH1.8)中,会降解为表儿茶素或各自的异构体。当在模拟的小肠溶液或碱性pH下孵育时,单体和二聚体(C、EC、B2、B5)几小时内几乎全部降解[16]。
1.3 胃肠环境的影响
根据Muller[8]综述,易于通过口服吸收的药物,一般符合多个条件,如分子量不超过500 Da,有合适的亲脂性和亲水性,在pH7.4不带电荷或带部分电荷等。胃肠道消化液的pH、各种酶类的作用以及在血浆中的稳定性都对其生物利用度起决定性作用。儿茶素在肠道菌群酶的作用下,被代谢为其葡萄糖苷化、磺酸化产物,还会发生环裂变、还原及水解等反应[17]。这些糖苷化的儿茶素因为分子量大、极性强、亲脂性弱,被动扩散通过小肠的速度很慢。而通过肠道微生物糖苷酶作用将糖苷水解除去后,能提高其通过小肠吸收的水平[18]。Catterall等[19]研究了饮食剂量的大鼠,茶抗氧化剂C和EC的生物利用度和药代动力学特性。将这些化合物的氚化衍生物经口服或静脉注射给大鼠,剂量水平与人类的饮食摄入量相当。在静脉注射这两种化合物后,大约三分之一的剂量通过尿液排出,三分之二通过粪便排出,这表明大量儿茶素经由胆道排泄。当同样的剂量被口服时,尿液中每种化合物的排出量只有经静脉注射时排出量的5%。对比口服和静脉注射后曲线下的区域发现,C和EC的生物利用度均小于5%。口服儿茶素3 h后血液中氚与水中的氢发生交换,而大鼠静脉注射后不发生这种交换现象,可能是肠道菌群微生物的作用。
1.4 其他物质对儿茶素吸收的影响
有关其他物质是否对儿茶素的吸收造成干扰,有不同的观点。Peters等[20]研究普通食品成分如蔗糖、维生素C对儿茶素吸收的影响,生物利用度分别通过SD大鼠和体外消化吸收Caco-2细胞模型进行实验。结果表明EGC与EC的体外吸收率(约51%~53%)比EGCG和ECG(<20%)高,单独加入蔗糖或同时加入蔗糖与维生素C可适当提高这几种儿茶素的吸收率。CaCO-2细胞实验中同时加入蔗糖与维生素C后,EGC,EGCG和ECG的积累显著高于其他配方,说明蔗糖与维生素C能够通过提高茶叶的可及性和肠道的吸收提高儿茶素的生物利用度。而Draijer等[21]认为其他物质会降低儿茶素的吸收,在他们的研究中发现,空腹时服用脱咖啡因的茶叶儿茶素提取物,与进食时相比,血浆中游离EGCG的平均浓度增加了3.5倍以上。
2 提高儿茶素的生物利用度的方法
鉴于儿茶素类物质低微的生物利用度,科学工作者已经开展了大量的研究工作来尝试提高其利用率,如与其他物质配伍食用、对儿茶素进行结构修饰和采用各种大分子材料对儿茶素进行纳米封装,其中纳米封装的方法研究较多。
2.1 与其他物质配伍食用
胡椒碱是从胡椒科家族植物提取出来的酰胺生物碱。胡椒碱能够抑制不同黄酮类物质如槲皮素、EGCG与葡萄糖苷酸转移酶的结合,降低代谢提高其生物利用率[22]。儿茶素与牛奶混合后,棓酰化的儿茶素如ECG与EGCG与牛奶中的蛋白质结合力较强,而非棓酰化的儿茶素如EC与EGC与牛奶中蛋白质之间的结合较弱。游离的儿茶素含量降低,但在模拟胃液中孵育时,与蛋白质结合的儿茶素被释放出来,儿茶素总的量并没有减少。儿茶素在模拟胃液的酸性环境中较为稳定,而在肠道消化液中不稳定。与牛奶中的蛋白质结合后提高了Caco-2模型实验中儿茶素的渗透系数,并且,Caco-2细胞在孵育2 h后其儿茶素的回收率也大大提高[23]。
2.2 儿茶素结构修饰
Amawi等[24]认为可以通过结构修饰如甲基化、糖苷化、羟基上进行疏水化修饰等提高黄酮类物质的生物利用度,这些衍生物具有母体的药效团,能够保持其原有的活性。儿茶素分子3′或5位羟基发生糖苷取代后在pH4~8之间的稳定性一般较儿茶素本身更高,尤其是(+)-儿茶素3′-O-(-D-吡喃葡萄糖苷。通过大鼠肠灌注实验结果发现,(+)-儿茶素3′-O-(-D-吡喃葡萄糖苷,(+)儿茶素5-O-(-D-吡喃葡萄糖苷两种糖苷取代物在肠中能够大量脱去糖苷,通过测定对比灌入肠中和流出肠的液体,发现前者能够更好地被肠道吸收[25]。
过醋酸修饰过的EGCG,在生物弱碱性环境中更稳定,并且在蛋白酶抑制作用与诱导癌细胞死亡表现出更好的作用效果[26]。Wang等[27]发现过醋酸修饰过的EGCG,不仅可以降低子宫内膜癌细胞分泌的血管内皮生长因子A,而且可以抑制肿瘤相关巨噬细胞分泌的血管内皮生长因子A。
另外,儿茶素结构类似物的研究也取得了良好的效果,如Chen等[28]研究合成的EGCG结构类似物能够活化AMPK,抑制细胞增殖,上调细胞凋亡细胞周期蛋白依赖性激酶抑制剂p21,下调mTOR通路,并抑制人乳腺癌细胞中干细胞数量。Ahmed等[29]的研究发现合成的结构类似物具有较强的抗增殖、抗血管生成和抗纤维化活性。
2.3 纳米封装
在医疗和功能性食品领域,为了提高儿茶素类物质的生物利用度,针对其封装进行了大量研究,尤其是利用自然界中易于获取且价格低廉的生物材料,如蛋白质、脂类及糖类物质,有文献对这些物质在EGCG封装方面的研究进展进行了综述[30-32]。
2.3.1 蛋白质作为封装材料 牛血清白蛋白(BSA)、酪蛋白、乳清蛋白及植物源蛋白都具有提高EGCG利用率的作用。Yadav等[33]把BSA装载到C与EC上,制作蛋白质纳米粒子,所得到的C-BSA纳米粒子与 EC-BSA纳米粒子在不同温度下(37、47、57 ℃)都是稳定的。DPPH法检测封装后的纳米粒子发现其抗氧化活性并没有减弱。并且装载BSA后的C与EC抑制A549细胞系的能力有所提高。酪蛋白封装后的EGCG在结肠癌细胞中仍具有抗恶性细胞增生的活性[34],酪酸钠具有较高的EGCG负载量[35]。以脱脂米糠为原料,制备的米糠分离蛋白与茶儿茶素结合后,EGCG和总儿茶素的体外消化回收率分别从10.5%和17.7%提高到29.5%和31.6%[36]。
2.3.2 碳水化合物封装材料 碳水化合物广泛存在于自然界中,在农产品加工过程中会产生大量的以碳水化合物为主的副产物,如米糠、豆渣、果蔬皮等。石萌[37]研究以米糠、豆渣和燕麦麸为初选材料,进行儿茶素类物质封装材料的研究。结果发现米糠对儿茶素类具有最佳吸附性能,米糠经脱脂处理后,对儿茶素尤其是EGCG的吸附能力有明显提高。采用拟一级和拟二级速率方程对脱脂米糠负载儿茶素类的吸附动力学进行模拟,发现其吸附动力学符合二级速率方程。经模拟胃肠道消化环境实验后,发现米糠包埋后的儿茶素在经肠胃液消化后比未经包埋的儿茶素的回收率更高。
也有研究发现儿茶素与环糊精结合后有利于提高儿茶素的稳定性及其生物利用度。环糊精与儿茶素的络合常数随着温度与pH的升高而降低。在相同温度与pH条件下,羟丙基-β-环糊精与EC的络合常数小于其与C的络合常数,环糊精对EC有更强的保护作用[38]。
壳寡糖也是常用的封装材料[39-41],Dube等[39]用离体的小鼠空肠进行实验,发现经壳寡糖封装后的儿茶素在小肠内的吸收率明显提高。其中C从(206.8±12.6)ng/cm2提高到(302.1±46.1) ng/cm2而EGCG从(57.9±7.9) ng/cm2提高到(102.7±12.4) ng/cm2。Dube认为儿茶素吸收增强的机制不是通过对肠道细胞旁或细胞外被动转运过程的影响,也不是通过对外排蛋白的影响,而是由壳寡糖封装后儿茶素稳定性增强,是其保留浓度明显提高的结果,C由94.9%±3.8%提高到99.7%±0.7%,EGCG从 1.3%±1.7%提高到56.9%±3.0%。在另一个实验中,Dube等[40]还发现壳寡糖封装提高了EGCG在血浆中的浓度,这有可能是由EGCG在胃中和空肠中的浓度有所提升造成的。Hong等[41]研究EGCG在壳聚糖和天冬氨酸自组装纳米颗粒中的包封作用对其有效性的影响。以30~50 kDa天冬氨酸和3~5 kDa壳寡糖为原料,以1∶1的质量比制备了平均直径约93 nm的空白纳米颗粒,将EGCG负载于纳米颗粒中,得到平均直径102 nm的EGCG-壳寡糖-天冬氨酸纳米颗粒,这种颗粒可显著提高EGCG对兔动脉粥样硬化的治疗效果。
将这些碳水化合物作为封装材料,不仅能够起到提高儿茶素类物质生物利用度的作用,同时也降低了农产品加工业的废弃物的污染,提高了生物质的综合利用率。
2.3.3 脂类作为封装材料 脂类物质从90年代早期就已经开始应用,目前是药物输送中常用的纳米系统之一[42]。其作为纳米封装材料具有多种优势:物理稳定性高、缓释效果好、较高的负载能力以及较好的耐受性[43]。脂类纳米封装一般有两种形式:固体脂质纳米颗粒(SLN)和纳米结构脂质载体(NLC)。SLN含有完全结晶的脂滴,具有高度有序的晶体结构。NLC是一种改进的SLN,其脂质相在室温下同时含有固体和液体脂质。SLN和NLC结合了聚合物颗粒、脂质体和乳液的优点,是较为理想的纳米封装材料[44]。
在Radhakrishnan等[45]的研究中,采用SLN对EGCG进行封装以提高其在生物环境中的稳定性。通过细胞增殖检测EGCG和EGCG负载纳米颗粒(EGCG-SLN)的抗癌活性,发现EGCG-SLN对MDA-MB 231人乳腺癌细胞的杀伤力是纯EGCG的8.1倍,对DU-145人前列腺癌细胞的杀伤力是纯EGCG的3.8倍。阳离子脂质纳米颗粒(LNs)也已被用于测试EGCG的持续释放和特异性位点。实验发现,使用阳离子LNs可以延长EGCG的释放时间[46]。
另外,研究发现脂质体是一种具有类脂质双分子结构的新型药物载体,可以选择性地转运药物,起到缓释作用,使活性分子免受酶及其它因素破坏,延长有效作用时间。儿茶素经脂质体包封后,在组织中分布密度高,靶向性增强;消除缓慢,生物半衰期和有效血药浓度时间延长,口服吸收较完全,生物利用度有所提高[47]。
纳米颗粒的脂质核心不仅使纳米颗粒的组装结构更加稳固,而且使其具有较好的生物相容性,从而为高效的药物递送提供了一种隐形载体。因此脂类物质也是儿茶素类物质的封装合适的材料。
3 研究难点
对儿茶素类物质的生物利用度进行研究的难点之一在于其复杂的分子结构。因为儿茶素分子中存在手型碳原子,其单体有8种结构,由这些单体组成的多聚体的异构体个数将会随着聚合度以指数方式增长。而不同的异构体具有不同的生物利用度,如Donovan等[48]比较了大鼠空肠和回肠中(-)catechin与(+)catechin在原位灌注10、30、50 μmol/L各种儿茶素对映体的吸收情况。在所研究的浓度中,小肠对(-)catechin的吸收都没有对(+)catechin的吸收高(P<0.01)。又如Baba等[49]研究对比大鼠在口服C、EC后,血浆及尿液中这两种物质及其代谢产物的含量,发现EC在大鼠体内的生物利用度较C高,而且,C与EC在大鼠的胃肠道中可能存在竞争作用。而聚合度大于3的儿茶素的分离纯化就已经非常困难,因此对其多聚体生物利用度的研究受到分离技术的限制难以进行。目前的研究主要集中在儿茶素单体或者是此类物质的粗提物,对儿茶素聚合体生物利用度的研究有待于分离分析技术的进一步发展。
另外,在利用纳米封装提高儿茶素生物利用度研究中,也有诸多困难,如在用脂类物质进行封装时,寻找能用于食品的表面活性剂并不容易。虽然在实验室内进行的纳米封装效果良好,但如何降低高昂的成本并进行规模化生产仍然是一个难题。
4 展望
虽然对儿茶素的研究已经开展了很多,国内外市场上也已经出现多种以儿茶素类物质为主要功效成分的保健食品,但至今其构效关系方面的研究仍然很欠缺,因此市场上这些产品的质量可谓参差不齐。对儿茶素类物质的构效关系研究以及生物利用度提高方面的研究对相关产品的开发起着决定性的作用。今后的研究需要在提高儿茶素类物质的分离纯化技术,以及儿茶素类物质生物利用度提升方面努力,找到成本较低、食用安全且适合企业生产的方法。

