利用高效液相色谱法测定不同发酵时长郫县豆瓣酱酱中的8种生物胺
,*
(1.四川省食品发酵工业研究设计院,四川成都 611130;2.四川东坡中国泡菜产业技术研究院,四川眉山 620030)
生物胺(biogenic amine,BA)是一类低分子量的碱性含氮化合物,可在微生物代谢分泌的氨基酸脱羧酶、转氨酶的作用下,通过游离氨基酸的脱羧反应,醛、酮类物质的胺化或转氨作用产生[1]。生物胺广泛存在于酸乳[2]、奶酪[2]、酒类[3]、酱油[4]、食醋[5]以及泡菜[6]等发酵食品中,往往具有较强毒性,人在超量摄入后会出现头痛、呼吸窘迫、血压异常、心悸、过敏等不良症状[7]。生物胺还会与食品中的亚硝酸盐发生反应,生成具有强致癌性的亚硝基胺类化合物[8]。因此,生物胺一般被看作一种食品内源性危害物,用以表征腐败菌繁殖和不良代谢产物积累的程度。鉴于其对食品品质及安全性的不良影响,食品加工储存中,应尽可能采取措施抑制生物胺的生成。
色谱法是检测食品中生物胺的重要方法,不仅能有效分离鉴定样品中的生物胺组分,还可检测样品中各类生物胺的含量。在各类色谱法中,高效液相色谱(high performance liquid chromatography,HPLC)法是测定生物胺最常用、最可靠的手段之一。现有研究表明,利用HPLC测定食品体系中的生物胺,具有良好的重复性、灵敏度和准确性[9-10]。
郫县豆瓣酱是西南地区著名的传统调味品,主要利用蚕豆瓣、辣椒等原料经微生物发酵制成。郫县豆瓣酱以其独特的风味深受消费者欢迎,广泛应用于川菜烹饪和特色食品加工,被誉为“川菜之魂”[11]。传统工艺制作的郫县豆瓣酱需经过“晴天晒、雨天盖、白天翻、夜晚露”[12]的发酵阶段,往往持续数月甚至数年,以在多种微生物的参与下形成良好的风味。此阶段中,郫县豆瓣酱的微生物群落结构会发生明显的变化[13],这些微生物中不乏具有高氨基酸脱羧能力的菌株,能够催化氨基酸脱羧产生生物胺,因此,郫县豆瓣酱后发酵过程中生物胺的生成应引起人们足够的关注。然而,目前对郫县豆瓣酱中生物胺的研究还十分少见,传统发酵食品领域也没有专门针对郫县豆瓣酱中生物胺的检测方法。本研究利用高效液相色谱法(HPLC),对不同发酵时长郫县豆瓣酱中的8种生物胺(色胺、β-苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺和精胺)含量进行了分析,以期为郫县豆瓣酱生物胺的控制与监测研究提供相应的数据参考。
1 材料与方法
1.1 材料与仪器
发酵1、10、12、24、30、42、54、96个月的郫县豆瓣酱 取样自成都市郫都区某豆瓣生产企业,样品从陶制发酵缸中采集后置于-20 ℃保存备用;色胺、β-苯乙胺、腐胺、尸胺、精胺、亚精胺、1,7-二氨基庚烷、乙腈、脯氨酸、乙酸铵 色谱纯,美国Sigma公司;酪胺 色谱纯,德国Dr公司;丹磺酰氯(DNS-Cl)、组胺,色谱纯 美国霍尼韦尔公司;正己烷、甲醇、丙酮,色谱纯 德国Merck公司;碳酸氢钠、氢氧化钠、盐酸 分析纯,成都科龙化学试剂厂。
LC-2030液相色谱一体机(配有紫外检测器、柱温箱和自动进样器) 日本岛津制作所;TGL-20bR冷冻离心机 上海安亭科学仪器厂;VORTEX-2旋涡混合器 美国GENE公司;HH-2数显恒温水浴锅 金坛市晶波实验仪器厂;TP-214型分析天平 美国Denver公司;Orion 868酸度计 美国Orion公司;Milli-Q超纯水器 美国Millipore公司;0.22 μm有机系滤器 上海安谱科学仪器有限公司;Thermo移液器(200~1000 μL) 美国Thermo Fisher公司。
1.2 实验方法
1.2.1 溶液的制备
1.2.1.1 内标溶液的制备 准确称取1,7-二氨基庚烷0.1 g于100 mL容量瓶中,用0.1 mol/L盐酸溶解并定容,即得1 mg/mL内标储备液。取10 mL内标储备液,用0.1 mol/L盐酸定容至100 mL,即得0.1 mg/mL内标使用液。
1.2.1.2 生物胺标准液的制备 生物胺单标储备液(600 mg/mL):准确称取各生物胺标准品0.0600 g,用0.1 mol/L HCl溶液溶解并定容至100 mL,-20 ℃储存。生物胺混标工作液:分别吸取各单标储备液1.0 mL于10 mL容量瓶中,用0.1 mol/L HCl定容至刻度,混匀。然后将其稀释并加入适量内标储备液,制得含有25 mg/L内标且各标样质量浓度分别为60、40、20、10、5、2.5和1 mg/L的生物胺混标工作液待用。
1.2.2 试样中生物胺的提取及衍生 预处理及衍生过程参照Frias J等的方法[14],并做优化改进,以适用于郫县豆瓣酱样品。将样品切碎研磨后,准确称取10 g置于离心管中,加入1.25 mL内标工作液和15 mL 0.1 mol/L HCl溶液,混匀后震荡提取30 min,4000 r/min离心10 min,取上清液。沉淀依照相同方法重复提取1次。合并2次上清液并混匀,用0.1 mol/L HCl溶液定容至50 mL待用。
准确取上清液1.0 mL,然后依次加入200 μL NaOH溶液(2 mol/L)、300 μL饱和NaHCO3溶液、2.0 mL DNS-Cl溶液(10 mg/mL),混匀后于40 ℃避光衍生60 min,加入200 μL脯氨酸溶液(100 mg/mL),漩涡震荡1 min后于室温避光放置15 min,以去残余的DNS-Cl试剂。随后加入0.4 g NaCl,漩涡振荡,加入1.0 mL乙醚,涡旋振荡30 s,静置分层后,吸出上层有机相,重复操作2次,合并有机相,40 ℃挥发至干,用1.0 mL乙腈溶解残留物,0.22 μm有机系滤器过滤后4 ℃避光保存备用。
1.2.3 高效液相色谱条件 高效液相色谱条件参照Frias J等的方法[14],并做改进。色谱柱:Dikma Diamonsil C18分析色谱柱(250 mm×4.6 mm,5 μm);流速:0.8 mL/min;柱温:35 ℃;进样量:10 μL;采用二元梯度洗脱,流动相A:0.01 mol/L乙酸铵缓冲液—乙腈(90∶10,V/V),流动相B:乙腈-0.01 mol/L乙酸铵缓冲液(90∶10,V/V);梯度洗脱程序如下:0~22 min,60%~85%流动相B,23~24 min,85%~100%流动相B,25~32 min,100%流动相B,33~37 min,100%~60%流动相B,各色谱峰在250 nm处检出。
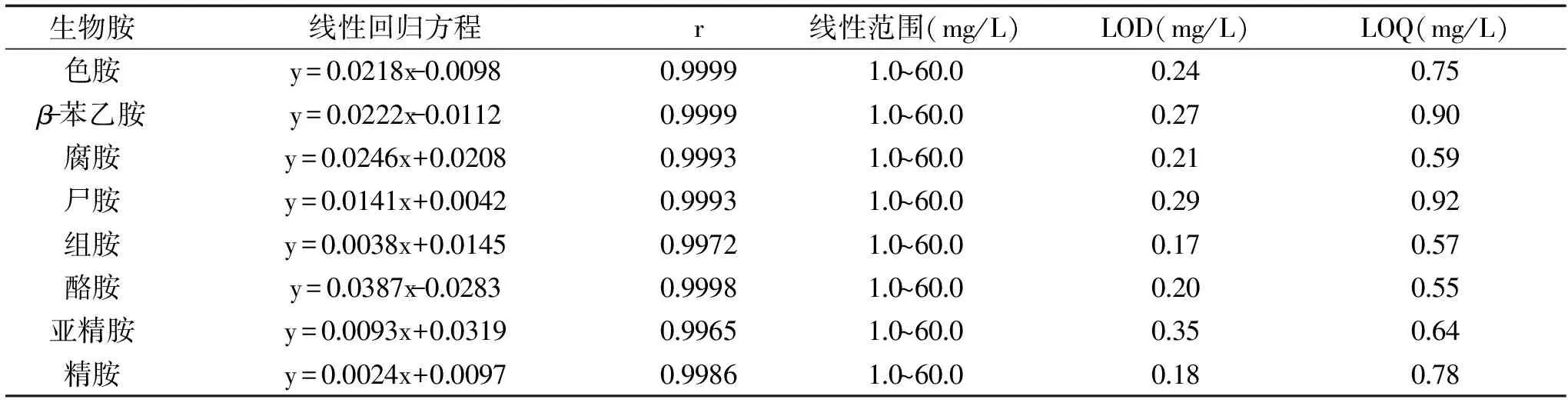
表1 HPLC测定8种生物胺的回归方程、线性范围、检出限和定量限Table 1 Regression equation,linear range,detection limit and quantitative limit for thedetermination of 8 biogenic amines by high performance liquid chromatography
1.3 数据处理
采用IBM SPSS statistic 22统计分析软件进行数据的线性回归分析,使用Origin 9.1软件对实验数据进行统计和作图。
2 结果与讨论
2.1 标准曲线的构建
生物胺在测定之前需要进行衍生处理以产生紫外光区的特征性吸收峰。本研究中,样品通过单磺酰氯衍生法衍生完成后,基于1.2.3的色谱条件,将混标色谱图与单标进行比对,根据保留时间确定了8种生物胺的出峰顺序,如图1。
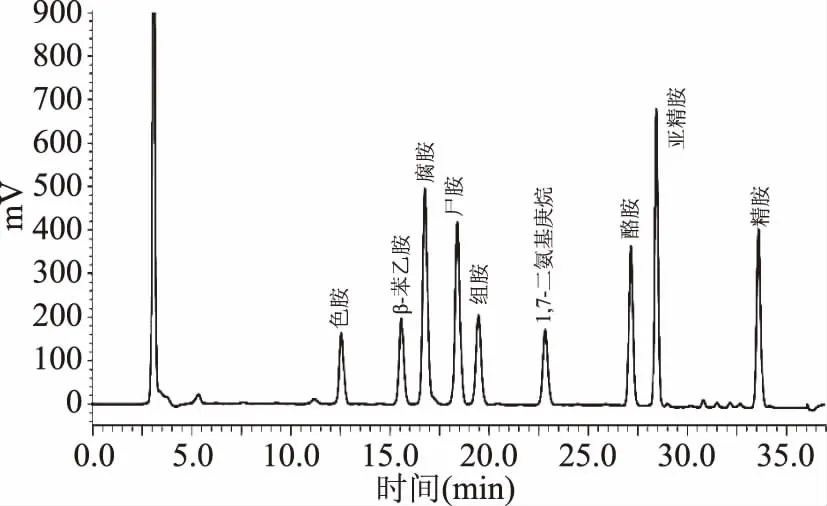
图1 40 mg/L生物胺混标的DNS-Cl衍生物高效液相色谱图Fig.1 HPLC chromatographic profile of DNS-Clderivatives of 40 mg/L biogenic amine standards
如图1所示,8种生物胺皆在进样后35 min内出峰,各色谱峰无重叠、峰形对称完整,说明所采用的洗脱程序能够较好地分离郫县豆瓣酱样品中的各种生物胺。通过与单标保留时间的对比可知,该混标中各生物胺的出峰顺序依次为色胺(12.70 min)、β-苯乙胺(15.71 min)、腐胺(16.94 min)、尸胺(18.57 min)、组胺(19.61 min)、酪胺(27.26 min)、亚精胺(28.52 min)和精胺(33.61 min)。
2.2 方法学考察结果
2.2.1 线性范围、检出限、定量限 制备不同质量浓度(1、2.5、5.0、10.0、20.0、40.0、60.0 mg/L,含有25 mg/L内标)的生物胺混标进行上样检测,以进样浓度为自变量,各生物胺与内标的峰面积之比为因变量,得到8种生物胺的线性回归方程及其回归系数(r)。此外,将生物胺混标工作液稀释后上样检测,以3倍信噪比(S/N)作为各生物胺的检出限(limit of detection,LOD),以10倍信噪比作为各生物胺的定量限(limit of quantitation,LOQ),测定仪器所能检出和定量的最低浓度,结果如表1所示。
由表1可知,8种生物胺回归方程的回归系数(r)均大于0.99,表明各生物胺标品的回归模型均具有显著性,各生物胺标曲在1.0~60.0 mg/L的范围内线性关系良好。同时各生物胺的LOD在0.17~0.35 mg/L之间,LOQ在0.55~0.92 mg/L之间。现有色谱条件下,各生物胺的LOD与LOQ均低于线性范围的最小值,说明各生物胺在1.0~60.0 mg/L的范围可被准确定量。
2.2.2 精密度实验结果 对质量浓度为40 mg/L的生物胺混标溶液连续进样7次,同时加入内标定量,根据定量结果测定生物胺测定方法的日内重复性,结果见表2所示。各生物胺日内7次测定结果的相对标准偏差范围在0.04%~0.56%之间,T Tao等利用高效液相色谱测定腐乳中的生物胺,其结果表明日内连续6次进样的相对标准偏差为1.56~3.22%[15],本研究中各生物胺测量值的相对标准偏差均小于1%,说明实验采用的检测方法精密度较高。
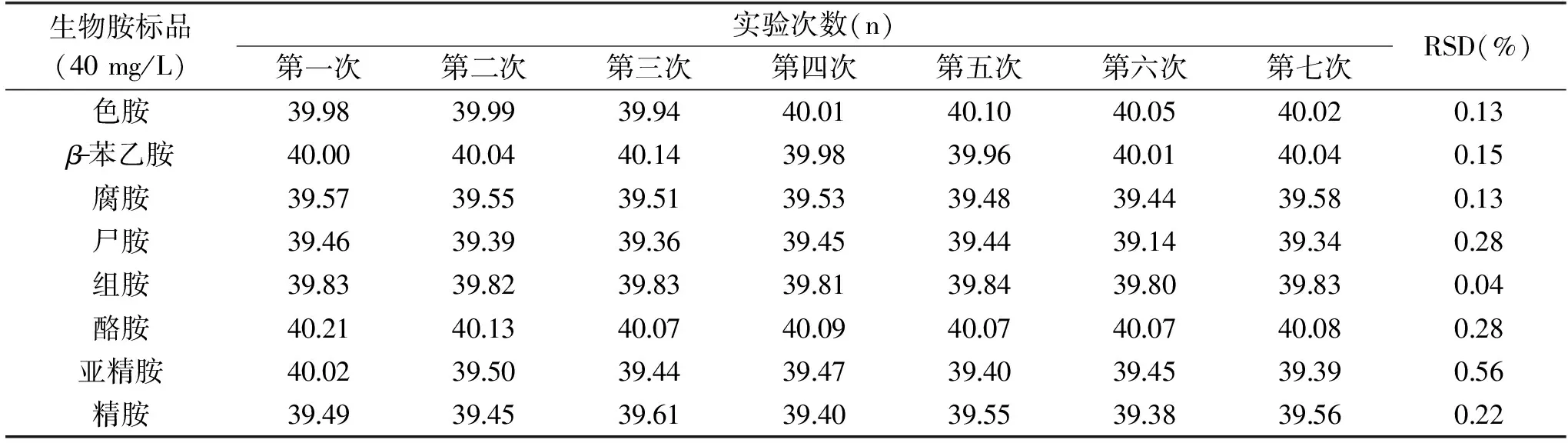
表2 仪器日内重复性测定结果Table 2 Results of intra-day repeatability determination
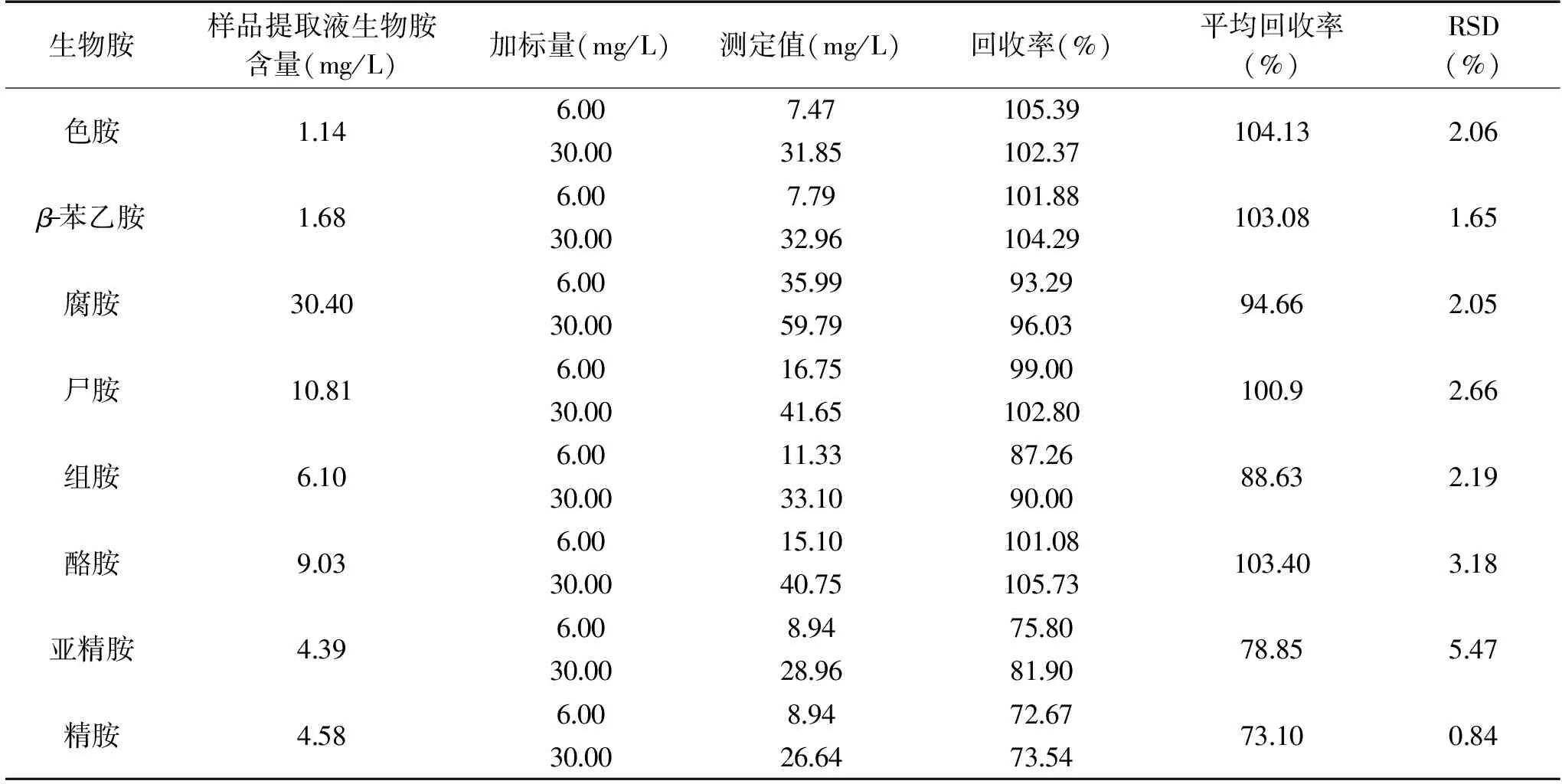
表3 郫县豆瓣酱中生物胺的回收率Table 3 Recoveries of biogenic amines in broad bean paste
2.2.3 加标回收率实验结果 称取郫县豆瓣酱10 g,按照1.1.2的方法制备成50 mL提取液,同时加入内标至最终质量浓度为25 mg/L,分别加入生物胺标准品至最终质量浓度为6.0和30.0 mg/L,吸取1 mL提取液测定生物胺,各加标水平样品独立测定3次,所得平均回收率和相对标准偏差结果如表3所示。
由表3可知,8种生物胺标准品的平均回收率在73.10%~104.13%之间,相对标准偏差在0.84%~5.47%之间。Tao等[15]对腐乳生物胺的研究中,各生物胺的回收率在83.6%~103.5%之间,相对标准偏差在1.26%~5.24%之间,与本研究结果类似。本研究所采用的测定方法能够满足实际检测对数据准确度的要求,因此用来检测郫县豆瓣酱样品中生物胺含量是可行的。
2.3 不同发酵时长郫县豆瓣酱样品生物胺含量分析
按照本研究方法对不同发酵时长(1、10、12、24、30、42、54、96个月)的郫县豆瓣酱进行生物胺检测,并将样品中各生物胺与内标峰面积的比值带入标准曲线,求得各样品的生物胺含量。检测结果如图2所示。
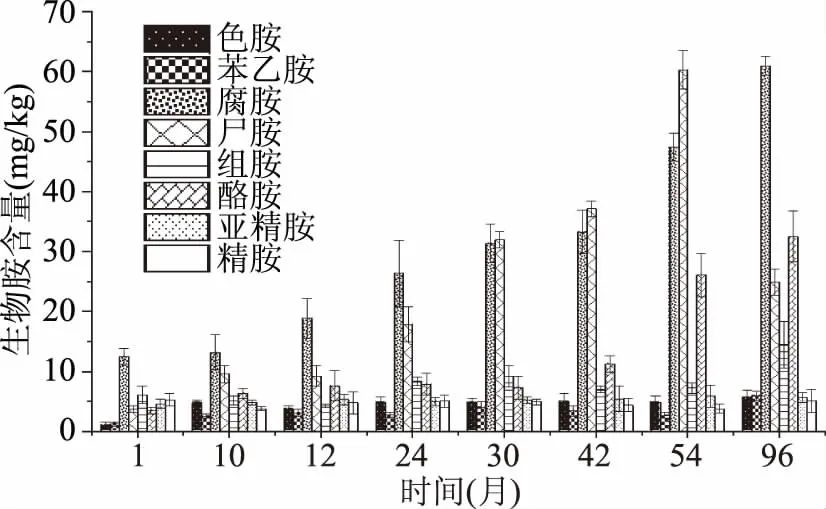
图2 不同发酵时长郫县豆瓣酱中生物胺含量的变化Fig.2 Changes of biogenic amine contentsin Pixian broad bean pastes with different fermentation time
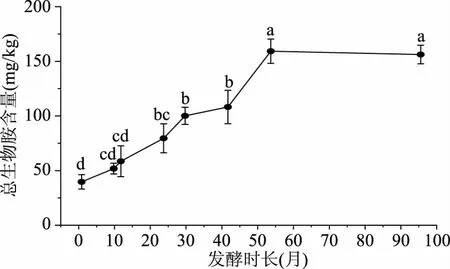
图3 不同发酵时长郫县豆瓣酱中总生物胺的含量Fig.3 Total biogenic amines in Pixianbroad bean pastes with different fermentation time注:图中各点上的不同字母代表样本间具有显著性差异(P<0.05)。
由图2可看出,8种生物胺在不同发酵时长的郫县豆瓣酱中均可检出,其中腐胺、尸胺、酪胺和组胺的含量相对较高,是郫县豆瓣酱中的主要生物胺,其他生物胺含量相对较低。随着郫县豆瓣酱发酵时间的延长,腐胺不断累积,含量逐渐增加,发酵1~96月间,腐胺含量由(12.46±1.43) mg/kg增长至(60.98±1.53) mg/kg;郫县豆瓣酱中的尸胺含量在发酵前54个月增长迅速,是所有生物胺中增长最快的一种,由初始的(3.70±0.55) mg/kg增长至54个月的(60.30±3.24) mg/kg,但在发酵第96个月明显下降,仅有(24.88±2.12) mg/kg。此外,豆瓣酱发酵至54个月之后,组胺和酪胺明显积累,分别由1个月时的(6.10±1.43) mg/kg和(3.47±0.57) mg/kg,增长至96个月的(14.45±3.88) mg/kg和(32.48±4.21) mg/kg。色胺、β-苯乙胺、亚精胺、精胺在不同发酵时间的郫县豆瓣酱中的含量均在6 mg/kg以下,且在郫县豆瓣酱发酵期间变化较小,含量趋于稳定。
腐胺与尸胺是食品中常见的生物胺[16],对鱼肉制品[17]、香肠及发酵豆制品[18]的研究均表明,腐胺、尸胺在生物胺中占有相当比例。腐胺来自于精氨酸的脱羧和转氨基反应及鸟氨酸的脱羧反应,而尸胺主要由赖氨酸脱羧生成,研究表明郫县豆瓣酱制作的主要原料蚕豆和面粉中的精氨酸和赖氨酸含量相对较高[19-20],这可能为发酵过程中腐胺和尸胺的生成提供了丰富的底物。本实验室之前的研究发现,芽孢杆菌属(Bacillus)是郫县豆瓣酱发酵中的主导微生物[21];蒯辉等[22]对豆瓣酱的研究也报道了类似的结果。而对韩国豆酱(cheonggukjang)的研究则表明,芽孢杆菌的量与豆酱中的尸胺、腐胺和组胺呈现明显的正相关[23]。因此,可以推测郫县豆瓣酱中含量较高的尸胺和腐胺是芽孢杆菌对原料中丰富的精氨酸和赖氨酸作用的结果。此外,在发酵42个月之后,组胺含量明显增加,这也可能与芽孢杆菌有关。随着发酵时间的延长,豆瓣酱中腐胺和尸胺的含量不断增长,这说明在郫县豆瓣酱发酵过程中产生这些生物胺的微生物持续活动。发酵54个月后,尸胺的含量明显下降,这可能是因为分解尸胺的某些微生物,如枯草芽孢杆菌(Bacillussubtilis)[24]作用的结果。Qi W等[25]发现在酱油中接种易变圆酵母(Candidaversatilis)和鲁氏结接合酵母能够显著提高豆瓣酱中酪胺的含量。鉴于接合酵母(Zygosaccharomyces)和假丝酵母(Candida)在豆瓣酱后发酵阶段的重要作用[21,26],酪胺可能来自于酵母菌对原料种酪氨酸的代谢。其余生物胺的含量均相对较低,这可能与原料中生成这些生物胺的氨基酸含量较低有关。
将不同样品中的八种生物胺的含量加和,得到各样品中的总生物胺含量,结果见图3所示。由图3可知,发酵时长从1个月增加到96个月,郫县豆瓣酱的生物胺含量大幅增加,总生物胺含量从(37.86±6.69) mg/kg增加到(155.09±8.53) mg/kg,增长达4倍有余。郫县豆瓣酱中的总生物胺含量在1~54个月中增长较快,而54个月后则趋于稳定。目前,除组胺外,相关标准法规中尚没有对食品中的生物胺含量做出限制[1]。据估计,食品中的生物胺含量达到1000 mg/kg时,会对人体健康产生危害[1],食品中的色胺含量达到100~800 mg/kg,β-苯乙胺含量在30 mg/kg时也会引起人的毒性反应[7]。对比以上数据,不同年份郫县豆瓣酱的生物胺含量均低于这些标准,就生物胺含量来说,本研究所取的豆瓣酱是相对安全的。
3 结论
本研究利用高效液相色谱,测定了不同发酵时长郫县豆瓣酱中的8种生物胺(色胺、β-苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺和精胺)含量。所采用的高效液相色谱检测方法能同时检测郫县豆瓣酱中的8种生物胺,色谱分离度较好;8种生物胺检出限在0.17~0.35 mg/L之间,定量限在0.55~0.92 mg/L之间,各生物胺标品在1.0~60.0 mg/L的浓度范围内的线性关系良好,且可准确定量;本方法日内7次进样的相对标准偏差为0.04%~0.56%,加标回收率为73.10%~104.13%,具有较高的精密度和准确度。采用该方法对发酵时长为1~96月不等的郫县豆瓣酱中8种生物胺进行检测,结果表明,郫县豆瓣酱中的主要生物胺为腐胺、尸胺、酪胺和组胺,随着发酵时长的增加,腐胺含量不断增加,尸胺前期增加较快,但发酵96个月明显下降,酪胺和组胺含量在发酵42个月以后含量有所增加,其他生物胺含量较低且相对稳定;郫县豆瓣酱中的总生物胺含量在发酵1~96个月内逐渐积累,从(37.86±6.69) mg/kg增加到(155.09±8.53) mg/kg,并在发酵第54个月达到稳定;对比以往的毒理学数据,本研究样品中生物胺的含量是相对安全的。郫县豆瓣酱中生物胺生成与发酵条件及微生物的关系以及郫县豆瓣酱生物胺安全性的评价仍有待进一步的研究。

