臭氧氧化乙硫氮的效率、能耗及中间产物生成研究
傅平丰,马艳红,林小凤,李 根
(北京科技大学土木与资源工程学院,北京 100083)
乙硫氮是硫化矿浮选常用捕收剂,代号SN-9,易与重金属离子络合,增加重金属在生物体中的累积量,例如,乙硫氮会增加斑马鱼、虹鳟体内重金属镉的累积量,表现出较高的生物毒性[1-3]。乙硫氮在酸性介质中易水解,产物为二硫化碳与二乙胺,在pH=5时,其水解速率常数为9.2×10-4s-1,半衰期为0.2 h,二乙胺经消毒剂(如Cl2和O3)氧化,会生成剧毒的消毒副产物N-亚硝基二乙胺(NDEA),是典型的亚硝胺类物质,具有潜在细胞毒性、遗传毒性和致癌性[4]。因此,浮选废水排放前需有效去除残留的乙硫氮捕收剂。

浮选废水中有机药剂净化方法主要有物理化学法(如吸附、混凝沉淀)、生化法、化学氧化和高级氧化法(臭氧氧化、光催化、Fenton氧化等)。物理化学法能去除浮选废水中绝大部分有药剂,但吸附剂成本高,会产生二次污泥[5]。生化法运行成本较低,但有机浮选药剂属于人工合成产物,生物可降解性差,例如,苯胺黑药等捕收剂对微生物有较高的毒性。以次氯酸钠为氧化剂的化学氧化法虽然净化效率高,但在净化体系中因引入氯而产生氯苯等二次污染物。臭氧氧化法已应用于市政给水和工业污水处理,随着产臭氧设备的大型化,该工艺的能耗不断降低。O3具有很强的氧化性,氧化还原电位达2.07 V,O3分解可产生·OH自由基,其氧化还原电位达2.85 V,可无选择性与多种有机污染物反应,氧化生成醛类和羧酸类等易生物降解的小分子产物,提高浮选废水可生化性[6-9]。张萌等使用臭氧降解丁基黄药,丁基黄药去除率达95%,COD去除率达42%[10]。马洪涛用臭氧氧化100 mg/L乙硫氮模拟废水,乙硫氮去除率可达100%,但TOC去除率仅为20.8%[11]。本文研究在较低臭氧投加量(1.16 mg/(min·L))下臭氧氧化乙硫氮的效率、能耗及中间产物生成规律,为臭氧氧化工艺应用于硫化矿浮选废水的高效处理提供理论基础。
1 试验方法
1.1 试验材料与药剂
乙硫氮(C5H10NS2Na·3H2O),分析纯,购自上海阿拉丁生化科技股份有限公司,其余化学试剂如重铬酸钾、二乙胺等购自国药集团化学试剂有限公司,纯度为分析纯。试验过程中用水均为去离子水。
1.2 试验装置
试验装置如图1所示,圆柱形反应器高为1 240 mm,内径为53 mm,有效容积为2 L。O3气体由空气源臭氧发生器(青岛维斯特电子净化设备有限公司,SW-004型)产生,通过多孔玻璃板进入反应器。
模拟废水中乙硫氮浓度为100 mg/L,以0.05 mol/L NaOH或HCl溶液将初始pH调至10.0;调节臭氧气体的流量,控制臭氧投加速率为0.62~1.27 mg/(min·L),当2 L乙硫氮模拟废水注入反应器后,通入臭氧气体开始降解试验。乙硫氮降解试验的温度控制在25±2℃;臭氧氧化乙硫氮的时间为90 min,每隔一定时间取水样,测定水样中乙硫氮、TOC、及离子的浓度。

图1 臭氧氧化降解乙硫氮的试验装置
1.3 分析方法与计算
使用紫外-可见分光光度计(UV-5500PC,上海精密仪器仪表有限公司)测定水样中乙硫氮浓度,最大吸收波长为256 nm;使用TOC测定仪(TOC-V,日本岛津公司)测量水样中TOC;以铬酸钡分光光度法测定水样中浓度;使用离子色谱仪(792 BASIC IC,瑞士万通中国有限公司)测定水样中浓度。以二乙胺乙酸铜分光光度法测定水样中CS2浓度,用碘量法测定水样中H2S浓度,用固相微萃取/气相色谱-质谱(SPE/GC-MS,GCMS-QP2010,日本岛津公司)定性鉴定乙硫氮降解过程中有机产物的类型。
有机污染物矿化是指分子中有机态碳、氮、磷、硫转变为无机态小分子或离子的过程,因此矿化率是评价有机物转化为无机物的一个重要指标。本文中,碳元素矿化率定义为:

式中,γC为碳元素矿化率,%;TOC0为总有机碳初始浓度,mg/L;TOCt为总有机碳在时刻t的浓度,mg/L。
硫、氮元素矿化率计算公式为:

式中,γ为元素硫或氮的矿化率,%;Manion为或的相对分子量;N为乙硫氮分子中硫原子或氮原子的个数;Canion为或离子在时刻t的浓度,mg/L;C0为乙硫氮初始浓度,%。
2 结果与讨论
2.1 臭氧氧化乙硫氮的效率与水质参数变化
当臭氧投加速率为1.16 mg/(min·L)时,臭氧氧化100 mg/L乙硫氮(SN-9)模拟废水,乙硫氮浓度、COD及水质参数(溶液pH和电导率)随时间的变化如图2所示。结果表明,随着臭氧氧化时间的延长,乙硫氮的浓度快速下降,当时间达到60 min时,乙硫氮的浓度已从100 mg/L下降到0.87 mg/L,90 min时,乙硫氮浓度进一步降低到0.13 mg/L,此时乙硫氮去除率达99.87%;与乙硫氮不同的是,溶液COD浓度下降较慢,降解90 min时,乙硫氮溶液COD只从96.89 mg/L降到57.71 mg/L,COD去除率为40.44%。以上结果表明,乙硫氮较易被臭氧氧化,而其产生的中间产物却较难被臭氧或·OH自由基进一步分解。

图2 O3氧化乙硫氮的效率
从图2(b)可知,随着乙硫氮的降解,溶液pH值不断降低,表明有水溶性有机酸或无机酸生成,如H2S、H2SO3、H2SO4等。此外,因O3分解生成·OH自由基需要有OH-离子作为链式反应的激发剂,会消耗水中OH-离子,可降低溶液的pH值。在溶液pH下降的时间内,溶液的电导率却不断上升,降解90 min后,溶液的电导率从92 μS/cm上升到178 μS/cm,电导率的上升直接证明乙硫氮溶液中离子数量增加,结合乙硫氮的分子结构式,可以判断乙硫氮中C=S、-CN断裂,进而被氧化为S2-、、等离子,导致溶液电导率的不断增加。
臭氧与乙硫氮反应有两种途径。一是直接反应,在酸性条件下,具有偶极型的臭氧在有机分子的双键位置发生选择性强的环加成反应,从而使有机物得到降解,反应速度慢。二是间接反应,在碱性条件下,臭氧分解产生的·OH自由基参与降解过程,氧化能力强且没有选择性,可降解绝大部分有机污染物[11-14]。
2.2 臭氧投加速率对乙硫氮降解效率和能耗的影响
为比较不同高级氧化工艺降解有机物的去除能耗,Bolton等提出了Electrical Energy Per Order(EE/O)以衡量降解过程中的能耗,此参数是指在1 m3被污水中使污染物溶液降低一个数量级所需的电能(kW·h)[15]。当EE/O值小于10 kW·h/m3时,此高级氧化工艺在能耗上是可接受的。EE/O值(kW·h/(m3·order))按式(4)计算,本文中产生1 kg的臭氧按15 kW·h电能消耗计[16]。不同O3投加速率下臭氧氧化乙硫氮的速率常数及EE/O值如表1所示。

式中,Pel为耗电量,kW·h;t为降解时间,min;V为乙硫氮模拟废水溶积,L;C为时刻t乙硫氮的浓度,mg/L;C0为初始时刻乙硫氮的浓度,mg/L。
由图3可知,当臭氧投加速率由0.62 mg/(min·L)增至1.27 mg/(min·L)时,乙硫氮的降解速率常数由0.019 9 min-1增至0.082 6 min-1,表明增加臭氧投加量可显著强化乙硫氮的降解;此时,降解能耗EE/O值由2.076 kW·h/(m3·order)降至0.247 kW·h/(m3·order),臭氧投加量增加,但EE/O值下降,主要原因是乙硫氮的降解速率常数有显著增加。以上结果表明,在较低臭氧投加速率下,适当增加臭氧投加量,可以提高乙硫氮的降解效率,并降低其处理能耗。臭氧投加速率增加,会增加乙硫氮与臭氧分子和·OH自由基等强氧化性物种的接触机会,从而提高降解反应速率。但从图3可见,当臭氧投加速率从1.16 mg/(min·L)增加到 1.27 mg/(min·L)时,臭氧氧化乙硫氮降解的能耗相差不大,表明进一步提高臭氧投加速率,可能不会降低工艺能耗,原因是臭氧在水中溶液度较低,投加过多的臭氧并不会全部溶解于水中,可能从反应器中逸出而造成浪费。
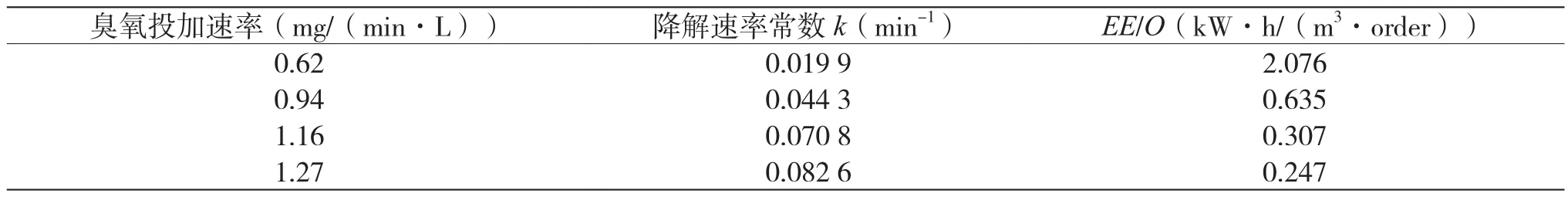
表1 不同O3投加速率下臭氧氧化乙硫氮的速率常数及EE/O值

图3 O3投加速率对乙硫氮降解速率和EE/O值的影响
2.3 乙硫氮中碳、硫和氮元素的矿化
当臭氧投加速率为1.16 mg/(min·L)时,臭氧氧化乙硫氮过程中溶液TOC、和浓度随时间变化关系如图4所示。可见,随着臭氧氧化时间延长,TOC浓度不断降低,同时和离子浓度不断增加,表明乙硫氮及有机中间产物可以被彻底矿化成无机离子、H2O和CO2,乙硫氮分子中有机态的硫和氮经历一系列氧化过程,可以转化高价态的和离子。

图4 O3氧化乙硫氮时TOC、和浓度变化
如表2所示,降解90 min后,乙硫氮的C元素矿化率只有17.85%,而此时乙硫氮降解率高达99.87%,根据图2(a)数据,COD去除率也只有40.44%,结果表明,臭氧氧化可以彻底分解乙硫氮捕收剂,但是绝大部分都转化成各种中间有机产物,表现出较高浓度的TOC和COD值。乙硫氮降解后会生成小分子的有机酸、酫和酯类中间产物,此类有机物与臭氧反应的速率常数小,导致O3氧化此类有机物的效率较低[9-10]。
表2 降解90 min后TOC、和浓度及C、S和N的矿化率

表2 降解90 min后TOC、和浓度及C、S和N的矿化率
检测成分 浓度(mg/L)元素 矿化率(%)TOC 50.56 C 17.85 SO42- 18.66 S 16.62 NO36.82 N 18.81-
2.4 含硫副产物CS2和H2S的生成
当臭氧投加速率为1.16 mg/(min·L)时,臭氧氧化乙硫氮时溶液中CS2和H2S浓度随降解时间的变化情况如图5所示,在90 min的降解过程中,溶液中CS2浓度整体较低,降解90 min时其浓度只有0.298 mg/L,表明中间产物CS2不易于溶液中累积起来,O3和·OH自由基可快速分解CS2产物。与CS2不同的是,随着乙硫氮的降解,溶液中H2S浓度快速增加,60 min时达到4.825 mg/L,达到CS2浓度的近20倍,反应60 min后,其浓度开始下降,结果表明,在乙硫氮降解过程中,H2S产物累积明显。溶液中累积了CS2和H2S,表明乙硫氮中-CSS-基团确实可被氧化成CS2和H2S等含硫副产物,此类含硫副产物再经过一系列的氧化过程,可最终转成为离子。虽然乙硫氮被臭氧氧化分解,但被转化CS2和H2S等含硫副产物,导致降解90 min时硫元素矿化率较低。
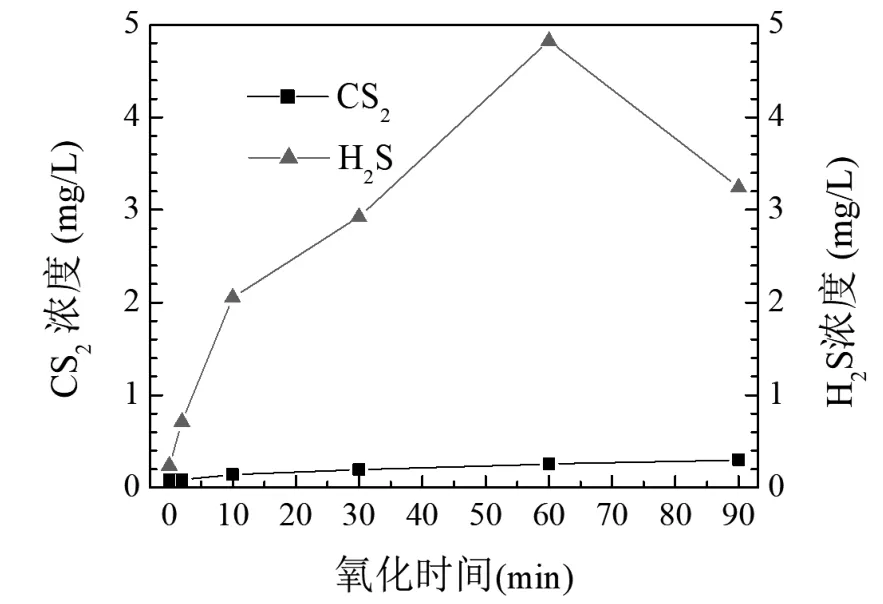
图5 乙硫氮降解过程中CS2和H2S浓度变化规律
2.5 有机中间产物鉴定分析
当臭氧投加速率为1.16 mg/(min·L)时,臭氧氧化乙硫氮20 min和90 min后取样,水样经固相微萃取(SPE)富集有机物,萃取产物用GC-MS法测定分析有机中间产物。SPE/GC-MS法分析水样中的中间产物结果如图6、表3和表4所示。

图6 乙硫氮降解20 min和90 min的GC-MS总离子色谱图

表3 乙硫氮降解20 min时中间产物分布

表4 乙硫氮降解90 min时中间产物分布
可见,降解20 min时检测到4种酰胺副产物,N,N-二乙基甲酰胺是主要有机副产物,还有如丝氨醇、3-甲基邻二氮杂苯等其他含氮有机产物,此外,也检测到苯甲酸和戊酸等有机酸和酯类产物。当降解时间延长到90 min时,GC-MS没有检测到二氢朐腺嘧啶、N-羟基苯甲醛肟酸甲酯等含氮有机物,有机物的种类也大幅减小,表明在乙硫氮降解过程中,此类有机物也被同步降解,转化成其他有机物或无机离子。当降解时间由20 min延长至90 min时,N,N-二乙基甲酰胺的峰面积百分比由33.75%减少到23.5%,表明主要副产物N,N-二乙基甲酰胺也被快速降解。结合图4和表2中有机碳和氮的矿化率,可见,降解90 min时,虽然乙硫氮捕收剂已经彻底被分解,但是仍然有N,N-二乙基甲酰胺、3-氨基二氢噻吩-2-酮和正二十六烷等大量有机产物存在,导致较低的碳元素矿化率。
3 结论
乙硫氮捕收剂易被臭氧氧化,臭氧投加速率为1.16 mg/(min·L)时,降解90 min乙硫氮和COD的去除率分别达99.87%和40.44%;臭氧投加速率增加,乙硫氮的降解速率快速增加,能耗EE/O值降低,当臭氧投加速率为1.16 mg/(min·L)时,EE/O值为0.307 kW·h/(m3·order),表明臭氧氧化乙硫氮在能耗上是可接受的。臭氧氧化乙硫氮90 min时,乙硫氮中碳、硫和氮元素的矿化率分别为17.85%、16.62%和18.81%,乙硫氮被去除后残留有较多有机中间产物;乙硫氮经臭氧氧化过生成CS2和H2S含硫副产物,但溶液中H2S浓度约为CS2的20倍,中间产物CS2被易被氧化,不易在溶液中累积。SPE/GC-MS分析表明,臭氧氧化乙硫氮时生成大量如N,N-二乙基甲酰胺等酰胺类含氮有机中间产物,延长降解时间可大幅减少中间产物的种类,降低中间产物的浓度,但即使乙硫氮去除率达99.87%,降解液中仍有大量中间产物存在。

