老年急性髓系白血病诱导治疗的疗效及预后
毛建平 薛连国 贾韬 王莹 陈泽 赵利东
(连云港市第一人民医院血液科,江苏 连云港 222002)
急性髓系白血病(AML)是老年人高发的一种恶性肿瘤性疾病,中位年龄为65~70岁。但由于具有独特的临床及生物学特点,其化疗缓解率仅为45%,5年生存率为10%左右,早期死亡率却高达30%〔1〕。按中国AML治疗指南,60岁以上推荐标准剂量的“3+7”方案,但其缓解率较低。有研究显示含小剂量阿糖胞苷(Ara-C)方案具有治疗老年AML的优势〔2〕,但随着姑息治疗的优化改善,何种治疗策略仍未达成统一。本文回顾性分析老年AML患者的临床资料,总结分析其疗效及预后因素。
1 资料与方法
1.1一般资料 收集2009年1月至2016年12月连云港市第一人民医院收治初治年龄≥60岁AML〔非急性早幼粒细胞白血病(APL)〕患者65例临床资料,AML诊断参照世界卫生组织(WHO)分类标准。临床资料包括年龄、性别、骨髓增生异常综合征(MDS)史、FAB分型、体能状态(PS)评分;白细胞计数、血小板计数、血红蛋白、乳酸脱氢酶(LDH)水平、白蛋白水平、骨髓增生程度、骨髓原始细胞比例、染色体核型分析、免疫分型表达情况等。根据美国东部肿瘤协作组(ECOG)评分标准进行PS评分〔3〕。参照2014年美国国立综合癌症网络(NCCN)指南〔4〕,将染色体核型分为:预后良好、预后中等及预后不良核型。
1.2治疗方法与分组 65例患者中男35例,女30例;中位年龄为67(60~83)岁。FAB分型包括:M1型14例(21.5%),M2型21例(32.3%),M4型5例(7.7%),M5型14例(21.5%),M6型3例(4.6%),未分型8例(12.3%)。11例(16.9%)既往有MDS病史,其中转化为M2型4例,M6型2例,M1、M4、M5型各1例,未分型2例。45例(69.2%)患者接受诱导缓解化疗(化疗组),其中标准剂量Ara-C方案组21例(32.3%),小剂量Ara-C方案组24例(36.9%);20例(30.8%)患者行姑息治疗纳入姑息治疗组。接受诱导缓解化疗与姑息治疗两组除年龄、ECOG评分外,在性别、有无MDS病史、FAB分型,治疗前谷丙转氨酶(ALT)、乳酸脱氢酶(LDH)等实验室检查基线资料比较,差异无统计学意义(P>0.05)。见表1。标准剂量Ara-C方案包括DA、MA、HA或IA方案:DA〔柔红霉素(DNR) 30~45 mg/m2/d,d1~3;Ara-C100 mg/(m2·d),d1~7〕,MA〔米托蒽醌(MIT) 10 mg/d,d1~3;Ara-C 100 mg/(m2·d),d1~7〕,HA〔高三尖杉酯碱(HHT) 2~4 mg/d,d1~7;Ara-C 100 mg/(m2·d),d1~7〕,IA〔去甲氧柔红霉素(IDA) 8~10 mg/(m2·d),d1~3;Ara-C 100 mg/(m2·d),d1~7〕。小剂量Ara-C方案包括CAG、HAG方案:CAG〔阿柔比星(ACL) 10 mg/d × (4~8)d;Ara-c 15~20 mg/m2,1次/12 h,d1~14;粒细胞集落刺激因子(G-CSF) 300 μg/d,d1~14〕,HAG〔HHT 1 mg/(m2·d),d1~14;Ara-C 15~20 mg/m2,1次/12 h,d1~14;G-CSF 300 μg/d,d1~14〕。标准剂量Ara-C方案组诱导化疗达完全缓解(CR)后,给予原诱导方案巩固化疗1个疗程,再给予HA、MA、DA方案交替巩固治疗。小剂量Ara-C方案组达CR后继续预激方案(CAG、HAG)等巩固治疗。姑息治疗包括成分输血、高白细胞者予羟基脲降白细胞等治疗。
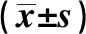
表1 接受化疗与姑息治疗的老年AML患者临床资料比较
1.3疗效评估 疗效判断标准参照文献〔5〕,包括CR率、无病生存(DFS)率及早期死亡率。缓解情况依国内标准分为CR、部分缓解(PR)、未缓解(NR)及复发〔5〕。早期死亡为确诊后4 w之内发生死亡〔1〕。DFS时间:获得CR患者,从CR之日至复发或者CR状态下的死亡之日。总生存(OS)时间为患者确诊之日起至死亡之日或末次随访的时间。通过住院及门诊复诊病例及电话的方式进行随访。随访截止时间为2017年12月31日。
1.4统计学方法 采用SPSS20.0统计软件进行χ2、t检验,Kaplan-Meier法绘制生存曲线,比较采用Log-rank检验,P<0.05为差异有统计学意义;采用COX比例风险模型进行多因素预后分析,采用Logistic回归法进行早期死亡率的危险因素分析。
2 结 果
2.1化疗疗效分析
2.1.1诱导缓解化疗方案疗效比较 标准剂量Ara-C方案组CR率为52.4%(11/21),小剂量Ara-C方案组CR率为41.7%(10/24),两组间差异无统计学意义(χ2=0.176,P=0.675)。两组6个月DFS率分别为38.1%(8/21)和29.2%(7/24),差异无统计学意义(χ2=0.100,P=0.751)。中位OS时间分别为17.9(0.6~67.2)个月和16.1(0.87~102.77)个月,两组差异无统计学意义(Log-rankχ2=1.171,P=0.229)。两组3年OS率分别为33.3%(7/21)和25%(6/24),差异无统计学意义(χ2=0.082,P=0.775)。两组早期死亡率分别为9.5%(2/21)和8.3%(2/24),差异无统计学意义(χ2=0.02,P=0.889)。化疗后CR患者中位生存期25.9(4.2~102.77)个月,未达CR患者中位生存期9.3(0.6~27.2)个月,两者比较差异有统计学意义(Log-rankχ2=21.024,P<0.001)。见图1。
2.1.2化疗组与姑息治疗组之间疗效比较 化疗组与姑息治疗组中位OS时间分别为16.27(0.60~102.77)个月和3.00(0.53~15.77)个月,两组差异有统计学意义(t=19.386,P<0.001),化疗组生存时间明显延长。见图2。化疗组早期死亡率〔8.9%(4/45)〕与姑息治疗组早期死亡率〔20%(4/20)〕差异无统计学意义(χ2=1.584,P=0.238)。两组3年OS率分别为28.9%(13/45)和5%(1/20),差异有统计学意义(χ2=4.676,P=0.031)。
2.2影响预后的相关因素分析 对患者预后进行单因素分析结果显示,年龄、ECOG评分≥3分、白细胞计数≥100.0×109/L、LDH水平超过正常值2倍、ALT水平升高、肌酐水平升高、染色体核型、是否接受诱导缓解化疗是老年AML患者的预后影响因素,差异有统计学意义(P<0.05),见表2。进一步采用COX比例风险模型进行多因素分析,引入水准设为0.05,剔除水准设为0.10结果显示,白细胞计数≥100×109/L、ECOG评分≥3分、预后不良染色体核型、是否接受诱导缓解化疗是影响患者预后的独立危险因素,见表3。
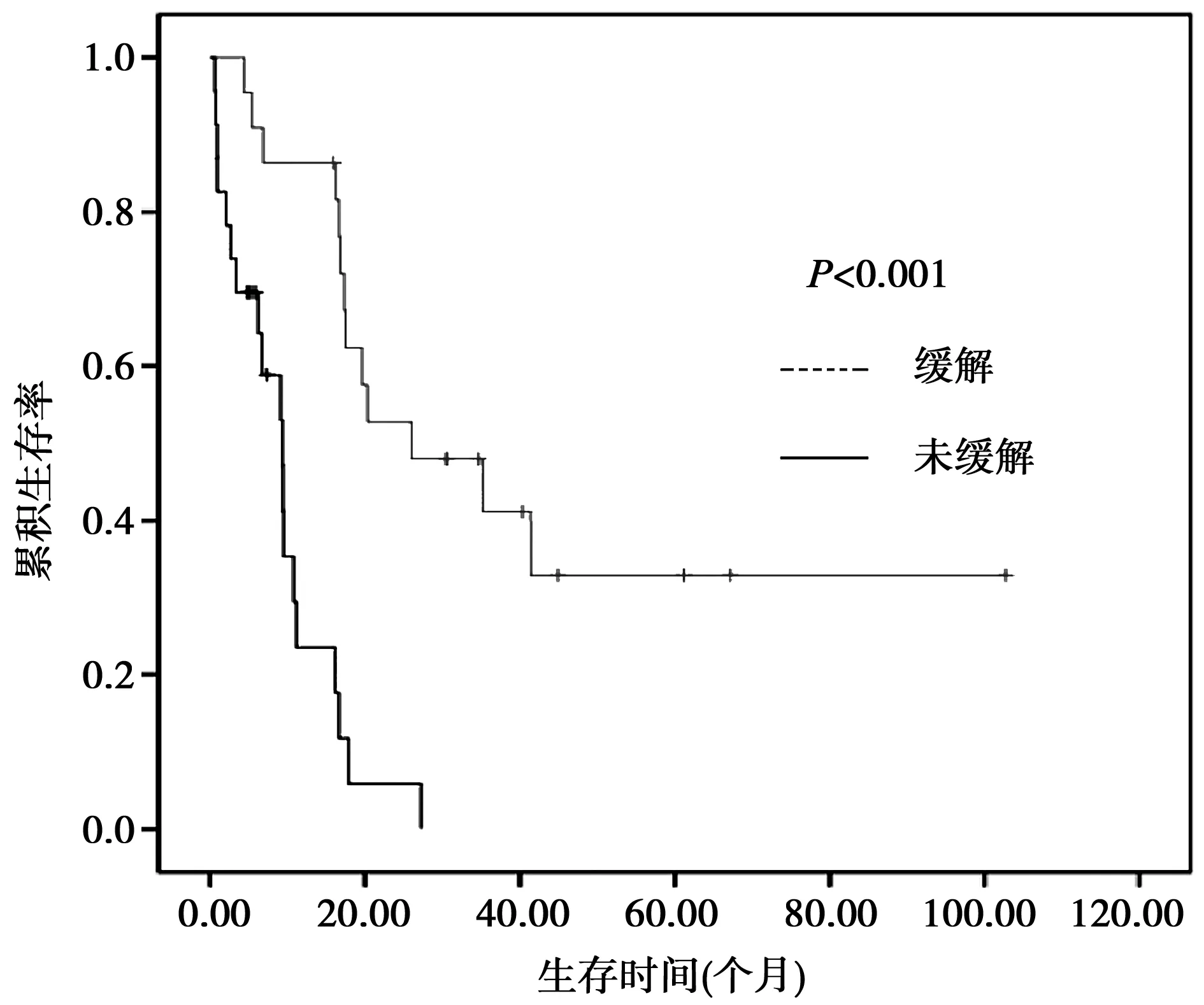
图1 化疗组患者达CR与未达CR者生存曲线比较
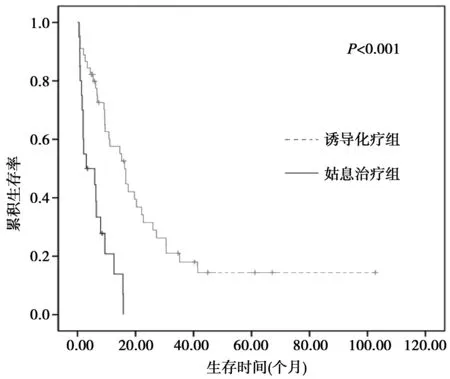
图2 化疗组与姑息治疗组患者生存曲线比较
2.3早期死亡相关因素分析 接受化疗及姑息治疗两组患者发生早期死亡的主要原因为脑出血、感染性休克及严重肺部感染等。对影响患者早期死亡的因素进行单因素分析结果显示,ECOG评分、白细胞计数、LDH水平、ALT水平≥正常值2倍、是否缓解是老年AML患者早期死亡的影响因素,差异有统计学意义(P<0.05),见表2。多因素Logistic回归分析采用多元逐步回归分析,引入水准设为0.05,剔除水准设为0.10,结果显示,只有白细胞计数≥100×109/L是老年AML患者早期死亡的独立危险因素(回归系数2.323,标准误0.824,Waldχ2值7.952,P=0.005,OR:10.208,95%CI:2.031~51.313)。
表2 影响老年AML患者中位OS时间及早期死亡的单因素分析
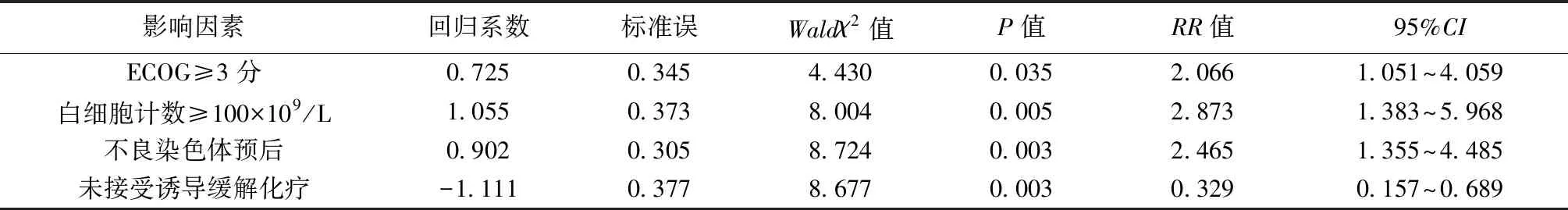
表3 影响老年AML患者预后的COX比例风险模型多因素分析
3 讨 论
老年AML患者存在并发症多、器官功能下降、体能状态差、不良核型等众多不良预后因素〔6〕,虽然强化化疗可使其获得CR,但化疗相关毒副作用限制了其应用〔7〕,因此对老年AML患者的治疗存在挑战和不确定性。目前,众多老年AML患者选择不接受治疗,但有研究表明接受任何治疗的患者比接受姑息治疗的患者能获得更好的预后〔8〕。本研究显示接受化疗患者无论在中位生存期还是总生存率上明显优于姑息治疗患者,而早期死亡率并没有增加。
在美国,“3+7”诱导方案为治疗初诊年龄60岁以上AML患者的标准方案,CR率可达75%〔9〕,而国内“3+7”DA方案的柔红霉素剂量小于60 mg/m2,故其CR率也下降,其CR率在44%~60%〔8,10,11〕。基于上述研究结果,我们探讨了本组病例标准剂量Ara-C方案CR率52.4%,与文献报道的结果接近,小剂量Ara-C方案CR率为41.7%,虽低于标准方案组,但无明显差异;其早期死亡率及DFS与标准方案相比,也无明显差异。因此,小剂量Ara-C方案取得了较好的临床疗效,其CR率及总有效率均不亚于常规的DA方案,可延长老年AML的总生存时间〔12〕,小剂量Ara-C方案在老年AML中是一个可行方案。
本研究结果显示初诊时白细胞计数≥100×109/L、未接受诱导缓解化疗、染色体高危核型等是影响老年AML患者预后的独立危险因素,结果与文献报道相符〔11〕。高白细胞数代表着肿瘤负荷高,提示预后不良。不良染色体核型高危组1年生存率仅为16%〔13〕。体能状态也是影响预后的因素,本组研究显示PS评分>2分的患者预后差,与郑志海等〔10〕的报道相一致。本研究结果显示,仅白细胞计数≥100×109/L是老年AML患者早期死亡率的独立危险因素,年龄并未增加早期死亡率。且本文与众多研究结果相似〔8,11〕,接受化疗与姑息治疗相比,早期死亡率并未增加,虽无统计学差异,但仍低于姑息治疗患者。因此,NCCN、ELN及EMSO对于不适合强化疗、体能状态评分差的老年AML患者均推荐低剂量的化疗〔14〕。但是真实老年AML世界中,年龄仍是影响治疗的非常重要因素,按照中国AML治疗指南,年龄在60~75岁、不适合标准剂量化疗及年龄≥75岁可以选择小剂量化疗或支持治疗〔15〕。更重要的是,临床医生在给具体患者做出适当决策的治疗过程中,应根据他们的疾病状态、年龄、并发症、预后因素及患者经济条件等因素综合考虑,不能仅因年龄较大而放弃诱导化疗,只有争取达到CR才能使得老年AML患者获得更长的生存时间,通过本组的研究显示,小剂量Ara-C方案的化疗仍是老年及不适合标准方案化疗的AML患者的一线治疗。

