子宫内膜息肉不孕症患者增殖期与种植窗期子宫内膜组织VEGF、Ki-67表达变化
冯苗,韩立薇,吴穗妹,李玉华,李蕾蕾,李艳秋,张碧云
(广东省计划生育专科医院,广州510600)
子宫内膜息肉(EP)是一种常见的宫腔内良性病变,是引起不孕症的常见原因之一。有研究报道,16.5%~26.5%的不明原因性不孕症患者合并EP[1]。近年来,随着超声技术不断发展和宫腔镜广泛应用,EP的检出率越来越高。不孕症患者助孕前常规行宫腔镜检查,EP的检出率高达23.6%[2]。目前,EP的病因和发病机制尚不完全清楚,普遍认为与雌孕激素受体失调、炎症刺激、氧化应激、细胞因子表达异常及细胞增殖与凋亡失调等有关[3]。血管内皮生长因子(VEGF)是一种作用于血管内皮细胞的细胞因子,具有促进内皮细胞增殖、分化,增加微血管通透性及诱导血管生成等作用,是判断种植窗期子宫内膜容受性的生物标志物之一。Ki-67是一种与细胞增殖相关的核抗原。有研究报道,VEGF、Ki-67异常表达与绝经后妇女EP形成和术后复发有关。但在育龄期EP不孕症患者增殖期与种植窗期子宫内膜组织中VEGF、Ki-67表达的报道较少。为此,本研究观察了育龄期EP不孕症患者增殖期与种植窗期子宫内膜组织VEGF、Ki-67表达变化,旨在探索VEGF、Ki-67异常表达与EP形成和术后复发及子宫内膜容受性的关系。现报告如下。
1 资料与方法
1.1 临床资料 选择2018年4~12月在广东省计划生育专科医院就诊的、因不孕症行宫腔镜检查发现宫腔内赘生物并经病理证实为EP患者84例(观察组),其中初发63例、复发21例,年龄20~35(30.3±3.5)岁,不孕年限1~12(4.7±3.1)年。所有患者经全面检查排除输卵管、子宫畸形,内分泌、免疫系统疾病及男方因素等导致的不孕症。同期选择在广东省计划生育专科医院就诊的,因男方因素所致的不孕症,宫腔镜检查未发现宫腔内赘生物且病理证实为正常子宫内膜者43例(对照组),年龄20~40(31.3±3.9)岁,不孕年限1~10(5.6±3.3)年。两组年龄、不孕年限具有可比性。本研究经广东省计划生育专科医院医学伦理委员会批准,患者或其家属知情同意。
1.2 VEGF、Ki-67表达检测 观察组入院后行宫腔镜检查,其中处于增殖期62例(复发21例均处于增殖期)、种植窗期22例,留取EP组织、EP周围0.5~1.0 cm肉眼观察无异常子宫内膜组织(以下称周围组织);对照组入院后亦行宫腔镜检查,其中处于增殖期23例、种植窗期20例,留取正常子宫内膜组织(以下称正常组织)。
所有组织10%中性甲醛固定,梯度乙醇脱水、二甲苯透明、浸蜡,常规石蜡包埋,4 μm厚连续切片。切片经59 ℃电热恒温干燥箱过夜,二甲苯脱蜡,梯度乙醇脱水,3% H2O2室温孵育5~10 min以灭活内源性过氧化物酶,微波加热修复抗原。5%正常山羊血清封闭10~15 min,分别加入鼠抗人VEGF单克隆抗体、兔抗人Ki-67多克隆抗体,4 ℃湿盒中孵育过夜。次日,加入生物素化二抗,37 ℃孵育30 min,DAB显色,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片,显微镜下观察。用PBS代替一抗作为阴性对照,用已知阳性的乳腺癌组织作为阳性对照。
采用双盲法由两位病理科医师独立阅片。VEGF阳性染色定位于细胞质,呈浅黄色至棕褐色颗粒;Ki-67阳性染色定位于细胞核,呈浅黄色至棕褐色颗粒。每张切片随机选取10个400倍视野,评估染色强度;计数每视野阳性细胞,计算阳性细胞比例。染色强度评分:未着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞比例评分:无阳性细胞为0分,<5%为1分,5%~<50%为2分,50%~<70%为3分,≥70%为4分。以染色强度评分和阳性细胞比例评分综合评价,二者之和≥3分为VEGF或Ki-67阳性表达[4]。
1.3 统计学方法 采用SPSS13.0统计软件。计数资料比较采用χ2检验或Fisher精确概率法。P<0.05为差异有统计学意义。
2 结果
2.1 两组增殖期VEGF、Ki-67阳性表达比较 见表1。
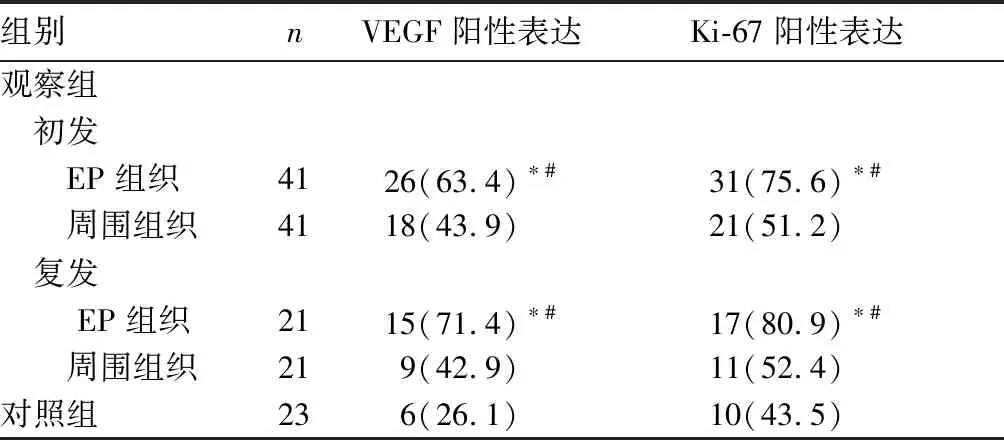
表1 两组增殖期VEGF、Ki-67阳性表达比较[例(%)]
注:与对照组比较,*P<0.05;与同发病状态周围组织比较,#P<0.05。
2.2 两组种植窗期VEGF、Ki-67阳性表达比较 见表2。

表2 两组种植窗期VEGF、Ki-67阳性表达比较[例(%)]
注:与对照组比较,*P<0.05。
3 讨论
EP是子宫内膜基底层的局限性良性增生,有蒂突向宫腔,由少量致密纤维结缔组织组成的间质、管壁较厚的血管及子宫内膜腺体组成,好发于育龄期或围绝经期妇女,是引起育龄期妇女不孕症的常见原因之一[5,6]。目前,临床治疗通常采用宫腔镜电切术。EP切除后不仅能提高育龄期不孕症患者自然妊娠率,还能改善辅助生殖技术助孕的育龄期不孕症患者妊娠结局,但术后复发率高达13.3%[7]。众所周知,子宫内膜在正常月经周期中经历增殖、分化、脱落的周期性变化,而EP组织同正常子宫内膜一样也存在周期性变化。因此推测,EP在宫腔内占位机械性干扰胚胎着床并造成子宫内膜微环境改变,有可能是导致EP不孕的重要原因[6,8]。
VEGF是血小板生长因子超家族的重要成员之一,是目前已知作用最强的促血管生成因子,能直接作用于血管内皮细胞,通过与其特异性受体结合,促进血管内皮细胞增殖并增加其通透性,介导血管内皮细胞迁移和浸润,从而有利于血管形成[9]。VEGF在月经周期各时期子宫内膜中均有表达,对内膜血管生成和血管通透性改变及月经来潮后内膜再生至关重要。在增殖期,子宫内膜上皮细胞表达的VEGF主要作用于间质,可促进内皮细胞增殖、新生血管形成。在分泌期,子宫内膜VEGF表达增加,可使内膜微血管密度和血管通透性增加,内膜间质明显水肿,为胚胎着床提供了必需的条件。在增殖期,对照组子宫内膜组织VEGF弱阳性表达,有利于血管生成,从而促进月经后的内膜修复;观察组无论是初发还是复发EP组织VEGF阳性表达均明显高于周围组织和对照组,EP组织VEGF过表达引起组织内新生血管过度生成并伴有间质纤维组织增加,显微镜下可见成束或成索的大血管,这是EP组织区别于正常子宫内膜组织的一个重要特征[10];复发EP组织VEGF阳性表达明显高于初发EP组织,VEGF高表达反映了血管内皮细胞增殖、迁徙和血管构建水平高,这可能是导致EP复发的原因之一。VEGF作为判断子宫内膜容受性的生物学标志之一,能为种植提供血管化的容受性。在种植窗期,对照组子宫内膜组织VEGF阳性表达增加,有助于胚胎着床和早期绒毛血管形成;观察组EP组织及周围组织VEGF阳性表达均明显低于对照组,其阳性表达降低可能与子宫内膜下血流灌注减少,从而影响子宫内膜容受性有关[11],最终导致胚胎着床失败,继而引起不孕[12]。
Ki-67是一种与细胞增殖相关的核抗原,定位于人10号染色体,其功能与有丝分裂密切相关[13]。Ki-67反映细胞增殖活性的效果要明显优于PCNA指数、DNA指数、DNA倍体含量等指标。Ki-67在增生期子宫内膜组织中弱表达,而在分泌期子宫内膜组织中几乎不表达。有研究证实,Ki-67过表达在子宫内膜病变的发生、发展中具有重要作用。对照组增殖期子宫内膜组织Ki-67弱表达,表明处于活跃的增生状态,有利于子宫内膜修复和再生[14];观察组无论是初发EP组织还是复发EP组织Ki-67阳性表达均明显高于周围组织和对照组;而种植窗期,两组子宫内膜组织几乎无Ki-67阳性表达,从而限制了子宫内膜增生,有利于子宫内膜的周期性脱落。这些结果表明,Ki-67高表达可能与EP的形成及术后复发有关,Ki-67表达增加是细胞增殖活性和有丝分裂增强的标志,提示EP是一种细胞增殖性疾病,腺体细胞和间质细胞有丝分裂增强,有更多的细胞进入增殖周期,但局限于EP内,并不是组织失控性增生[15],故在育龄妇女中起源于EP的子宫内膜癌非常少见。EP病理组织学常见的是单纯性或复杂性增生,伴或不伴整个子宫内膜增生[16]。
综上所述,EP不孕症患者增殖期EP组织VEGF、Ki-67高表达可能与EP形成和术后复发有关,而种植窗期EP组织VEGF低表达可能与子宫内膜容受性欠佳有关。这一结论有可能为EP不孕症患者治疗方案选择乃至研发治疗EP的靶向药物提供理论依据。

