脂联素对P.g LPS刺激下人牙龈成纤维细胞分泌TNF-α、IL-6、PGE2及MMP-1的影响
王丽美 肖 俐 支 敏 吕沛颖 高鹏飞 王永兰
牙周炎,一类由多种因素引起的牙周组织的慢性进展性炎症反应,在我国,成人牙周病的发病率高达80~90%[1]。牙周炎主要侵犯牙周支持组织,晚期牙周炎还影响患者的全身健康[2~4]。肥胖作为全球范围内的流行病,近10 年来已有大量的研究表明其与牙周炎具有相关性[5,6]。脂肪因子作为脂肪组织分泌的一类生物活性分子被人们广泛研究,而其中脂联素作为唯一负性调节的因子,可以促进脂肪酸的氧化,增加胰岛素敏感性,在许多慢性炎症疾病中发挥抗炎作用[7,8]。大量研究表明在牙周炎与肥胖相关疾病中均表征为低脂联素血症,而其相关机制仍不明确[9,10]。
细菌及其产物是牙周炎的主要始动因子,P.g作为细菌红色复合体中最具代表性的一员,在牙周感染位点尤其是深牙周袋中含量升高而被广泛研究[11]。P.g的致病原包括牙龈素、脂多糖等,脂多糖作为革兰阴性细菌细胞外膜上一类最主要的大分子抗原,因其对牙周组织极高的毒性,而成为一类关键的毒力因子[12]。牙周组织的破坏包括牙槽骨和牙周软组织的破坏,主要由炎症介质包括如IL-6 和PGE2,及组织破坏性酶包括如MMP-1 等介导。而TNF-α 等初级炎症介质可以诱导趋化因子向牙周组织聚集,加重结缔组织的破坏和破骨细胞性骨吸收。目前关于脂联素在牙周组织炎症反应中的调控,大多数研究者着眼于脂联素直接对牙周组织炎症介质的影响,如Dominik 的研究[13]表明,在口腔上皮细胞中,脂联素降低了IL-1β 和IL-6 的表达,促进了IL-10 和血红加氧酶-1 (heme oxygenase-1,HMOX1)表达。而关于脂联素在牙周微生物致病方面起的调控作用目前国内外研究甚少,有必要进一步深入研究。本实验拟通过研究APN 对P.gLPS 刺激HGFs 分泌TNF-α、PGE2、IL-6 和MMP-1 的调控,探索脂联素在牙周炎致病机制中所起的作用,从而为进一步揭示牙周炎与肥胖相关性的内在机制提供依据。
资料和方法
一、材料
1.人牙龈成纤维细胞的培养及分组:选取自2017 年03 月至2017 年05 月因需要拔除埋伏阻生智齿在天津医科大学口腔医院颌面外科就诊的患者共5 位(年龄18~24 岁,平均22 岁),排除患有全身系统性疾病如糖尿病、心血管病等,妊娠,吸烟,近3个月内使用抗生素史者,患者知情同意,在术中收集新鲜且色形质正常、无明显炎症的的牙龈组织。运用组织块培养法培养原代HGFs 并进行传代,当细胞传至5 代时将细胞接至12 孔板进行实验,随机分为3 组,每组设置3 个复孔:①空白对照组,10%FBS 培养基;②2μg/mlP.gLPS+10%FBS 培养基刺激;③2μg/mlP.gLPS +1μg/ml APN+10%FBS 培养基刺激。
2.主要试剂及仪器:RT-PCR 试剂盒(sigma,美国);引物(生工,上海);P.gLPS(InvivoGen,美国);APN(Peprotech,英国)。
二、方法
1.人牙龈成纤维细胞的培养与鉴定:运用组织块培养法培养原代人牙龈成纤维细胞进行传代,显微镜下形态学观察与细胞免疫细胞化学法-SP 法鉴定所培养的细胞为中胚层来源的人牙龈成纤维细胞,且不含上皮细胞。
2.P.gLPS 或联合APN 刺激HGFs:取5 代HGFs 以1×105个/孔的密度均匀铺在12 孔板上,于37℃,5% CO2温箱孵育2 天使细胞贴壁融合至80%时,更换为1%FBS 的DMEM 培养基培育1 天(这一步作为饥饿处理使牙龈成纤维细胞在刺激因素干预后产生足量的细胞因子),1 天后开始刺激实验。根据组别在12 孔板每孔依次加入2μg/mlP.gLPS 2ml(以10%FBS 培养基为溶剂),4μg/mlP.gLPS 1ml+2μg/ml APN 1ml(均以10%FBS 培养基为溶剂),空白对照(10%FBS 培养基)2ml,每组设置3 个复孔,于37℃,5% CO2温箱孵育24h,弃去培养液,在6h,8h,24h 提取HGFs 的总mRNA。
3.real-time PCR 检测各组HGFs 中TNF-α、IL-6、PGE2、MMP-1 的表达:Trizol 提取人牙龈成纤维细胞总RNA,super RTcDNA 逆转录试剂盒合成cDNA,引物序列如下:IL-6(162bp)(5’-CTCAATATTAGAGTCTCAACCCCCA-3’)和(5’- AGAAGGCAACTGGACCGAAG -3’),PGE2(163bp)(5’-AGGAGGGCGCATCTCTTTTC-3’)和(5’-CCAGTGCTATGAGGTTCCCC-3’),TNF-α(163bp)(5’-CTTCTCGAACCCCGAGTGAC-3)和(5’-ATGAGGTACAGGCCCTCTGA-3’),MMP-1(179bp)(5’-ATGCACAGCTTTCCTCCACT-3’)和(5’-ACTGGGCCACTATTTCTCCG-3’),95℃预变性约5min,94℃变性1min,57℃退火1min,72℃延伸1min,35 个循环;72℃终延伸10min,循环阈值代表mRNA 数目,以β-actin 作为内参,2-△△ct法处理数据,与对照组进行比较。
三、统计学分析
用IBM SPSS Statistics 23.0 统计软件进行数据分析,结果均采用均数±标准差表示,组间比较采用单因素ANOVA 方差分析(完全随机设计),以P<0.05 认为具有显著性差异。
结果
1.HGFs 的培养与鉴定:运用组织块培养法培养HGFs,3~4 天后可见组织边缘隐约有成纤维细胞样细胞游出,细胞极性较强,呈漩涡状(图1A)。当细胞汇合至80~90%时,进行首次传代,随培养时间和代数增加,细胞形态呈单一长梭型(图1B)。免疫组化结果显示:细胞抗波形蛋白染色阳性(图2A),抗角蛋白染色阴性(图2B),证实所培养的细胞为中胚层来源,并未混杂任何上皮源性细胞。

图1 人牙龈成纤维细胞的培养
图2 HGFs 组织来源的鉴定(免疫组织化学SP 法)
2.real-time PCR 检测结果:①2μg/ml P.g LPS刺激HGFs 分泌PGE2、IL-6、MMP-1 及TNF-α:如图3A、3B、3D 所示,在2μg/mlP.gLPS 刺激下HGFs 分泌PGE2、IL-6、TNF-α 在8h 时达峰值,以后逐渐减少,因此取8h 为进一步干预实验PGE2、IL-6、TNF-α 的时间观察点。如图3C,MMP-1 分泌量在24h 内随时间递减,因此取6h 为进一步干预实验MMP-1 的时间观察点。②各炎性介质P.gLPS 最佳刺激点APN 对P.gLPS 刺激HGFs 分泌炎性介质的影响:如图4A 所示,在8h,相较于空白对照组,P.g LPS 刺激组的PGE2 表达明显上升(P<0.05),APN 对P.gLPS 诱导的PGE2 表达上调起促进作用,但是无统计学意义(P>0.05),图4B 所示在8h,相较于空白对照组,P.gLPS 刺激组的IL-6 明显上升(P<0.05),APN 明显抑制这一过程,且有统计学意义(P<0.05),图4C 所示,在6h,相较于空白对照组,P.gLPS 刺激组的MMP-1 明显上升(P<0.05),APN 对P.gLPS 刺激的MMP-1 表达上调同样起着抑制作用,且有统计学意义(P<0.05),图4D 所示,在8h,相较于空白对照组,P.gLPS 刺激组的TNF-α 明显上升,APN 对这一过程起促进作用,但无统计学差异(P>0.05)。
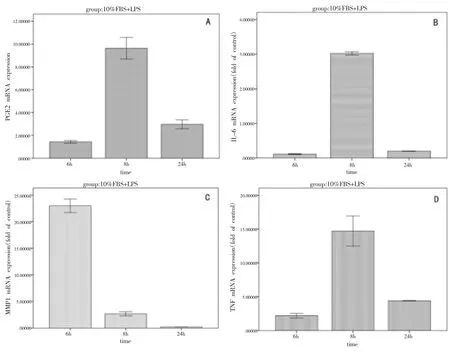
图3 不同时间点2μg/ml P.g LPS 刺激HGFs 分泌炎性介质A:PGE2,B:IL-6,C:MMP-1,D:TNF-α

图4 APN 对P.g LPS 刺激HGFs 分泌炎性介质的影响P.g LPS:2μg/ml;APN:1μg/ml,A:PGE2,8h;B:IL-6,8h;C:MMP-1,6h;D:TNF-α,8h。*代表P.g LPS+10%FBS 组与10%FBS 组组间差异P<0.05,**代表P.g LPS+APN+10%FBS 组与P.g LPS+10%FBS 组组间差异P<0.05
讨论
牙龈成纤维细胞在牙龈炎早期即可接触到P.gLPS,在其上有Toll 样受体4(Toll like receptor-4,TLR4)和Toll 样受体2(Toll like receptor-2,TLR2)的表达,P.gLPS 与牙龈成纤维细胞细胞膜上的CD14 结合之后形成LPS-LBP-CD14 三体复合物,被转运至TLR-MD-2,最终形成白介素受体相关激酶(interleukin receptor associated kinase,IRAK)/肿瘤坏死因子相关因子6(TNF receptor associated factor 6,TRAF6)复合体激活TRAF6,进而激活核因子(nuclear factor-κB,NF-κ B)和核转录因子激活蛋白-1(activated protein kinase-1,AP-1),游离的NF-κ B 被转运至细胞核内,激活下游基因,各炎性介质随之产生[14]。前期实验证实2μg/mlP.gLPS 对HGFs 分泌目标因子作用最强(实验数据尚未展示)。本实验结果表明,在24h 内,2μg/mlP.gLPS 刺激HGFs 分泌PGE2、IL-6、TNF-α 随时间递增,8h 达峰值,以后逐渐减少。IL-6 在0-8h 分泌量随时间递增,8h 达峰值,以后逐渐减少,出现这一现象的可能原因是:HGFs 后期产生大量的抑制因子IL-10 来抑制IL-6 的分泌。有研究表明该作用主要受转录因子NF-κ B 的调控[15]。Malefyt 等[16]发现,在激活细胞后4-8h,单核细胞产生并分泌炎性因子IL-6,在8h 时才开始产生内源性抗炎因子IL-10,到24~48h 达峰值。这合理解释了8h 前IL-6 含量随时间递增,而在8h 达高峰后其表达反而随时间下降。PGE2、TNF-α 和IL-6 的表达呈现了类似的趋势,而MMP-1 的表达则不同,在6h 其表达为峰值,随着时间递减。有研究[17]表明,10ug/ml LPS 刺激HGFs 后,MMP-1 的表达量在受刺激后12h 内逐渐增加,至12h 达峰值,以后逐渐减弱。也有研究[18]表明除中性粒细胞以外,大多数细胞在受刺激后的4-8h 即可合成基质金属蛋白酶,随着时间延长,大部分MMP-1 被释放至胞外,而胞内贮存的较少,这合理解释了本研究中随着时间递增,MMP-1 的表达量反而下降。在对牙周炎致病机理的探索中,不同的细胞因子间相互作用,这一复杂的相互作用形成的网络影响着牙周病的走向,为去除某些内源性细胞因子的干扰及其他相关因素的干扰,更好研究APN 对这四种炎症因子的调控作用,实验对PGE2、IL-6 及TNF-α 选择了8h 这一时间点,对MMP-1选择了6h 这个时间点进行讨论。本实验表明,P.gLPS 作为牙周病的一类强致病物,可以促进牙龈成纤维细胞分泌产生大量的促炎因子和基质降解酶,导致牙周软硬组织的降解和炎症的进一步恶化,这一点充分强调了病原微生物的致病作用在牙周炎症、组织破坏过程中不可忽视。更为重要的是,本研究表明APN 显著抑制P.gLPS 刺激HGFs 分泌炎症因子如IL-6 及MMP-1,这与Dominik K 的研究[13]一致,他的研究以口腔上皮细胞为研究对象。目前有研究[19]表明,APN 发挥这一作用的可能机制是:在正常情况下,未活化的NF-κ B 与它的抑制蛋白IκB 结合以维持在胞质中一定量的NF-κ B,而当IκB 磷酸化以及部分降解后,NF-κ B 被转录至细胞核内,促进各种炎症因子的表达。有研究[20]表明,APN 在与脂联素受体1/脂联素受体2( adiponectin receptor1/ adiponectin receptor 2,AdipoR1/R2)上的COOH 末端结合后,富集大量的APPL1 接头蛋白至脂联素受体的NH2 末端,大量的APPL1 活化了腺苷酸活化蛋白激酶(adenosine 5’-monophosphate(AMP)-activated protein kinase,AMPK)通路,而活化的AMPK 通路又会抑制IKK-NF-κ B 通路,因此,从这个意义上来说,APN 主要是通过减少NF-κ B 向核内转录抑制LPS 诱导的炎症因子表达,也有研究[19]认为APN 也可通过抑制ERK1/2 的活性来发挥这一作用,具体机制尚需进一步研究。本研究表明,在P.gLPS 刺激PGE2 表达的最佳诱导时间点,APN 对这一过程起促进作用,但无统计学差异(P>0.05),而在非最佳诱导时间点,如6h 和24h,APN 抑制其表达(实验数据未展示)。有研究[21]表明在类风湿性关节炎中,APN 通过上调PGE2 表达发挥促炎作用,关于APN 对于PGE2 的表达调控存在争议,仍需更多研究去证实。P.gLPS 刺激组的TNF-α 明显上升,APN 对这一过程起促进作用,但数据并无统计学意义(P>0.05),而且在非最佳刺激时间点,如6h,APN 对其表达起抑制作用(实验数据并未展示)。脂联素形式多样,大多数研究证实其作用大致类似,但仍有不少研究提示不同结果。Hong GP 研究组[22]用来自大肠杆菌和鼠骨髓瘤细胞重组的球状APN 刺激牙周膜细胞和牙龈成纤维细胞,发现来自大肠杆菌的球状APN 可促进炎性因子IL-6、IL-8 的分泌,多粘菌素B(一种LPS 的抑制剂)可以抑制这种作用,而来自小鼠骨髓瘤细胞的重组APN 却没有引起IL-6 和IL-8 的分泌增加,分析可能是前者混入有大肠杆菌脂多糖。本实验选取的是来自于E.coli 提取的球状APN,纯度达99.5%,可排除因纯度问题混入LPS。前期实验证实2μg/mlP.gLPS 可以较强地促进HGFs 炎性因子的分泌,加入脂联素这一干扰因素后,结果不可预测。本实验时间和试剂浓度均基于Dominik K[13]的研究,同时结合预实验来改良,但P.gLPS 刺激各炎性因子表达随浓度、时间变化较大,结果复杂,在此主要讨论P.gLPS 最佳刺激时间点APN 对其影响。P.gLPS作为一种高效的细胞因子诱导剂,可以刺激牙龈成纤维细胞合成分泌PGE2,IL-6,MMP-1 及TNF-α,在各炎性介质最佳刺激时间点,APN 可抑制P.gLPS 刺激HGFs 分泌IL-6 及MMP-1,发挥抗炎、抗骨破坏和基质降解作用,脂联素与这些促炎因子相互作用,使相应的炎症反应减弱,低脂联素血症很可能是联系牙周炎与肥胖相关性的内在因素之一。此结论仍然需要其他方面的研究进一步证实,从而增强结果的可靠性。

