枸杞多糖对离心过程中弱精精子氧化应激的作用研究*
颜 贝,王佳陪,王 娟,王红燕,周 岳,田 稼,马良宏△
(1.宁夏医科大学总医院精子库,银川 750004;2.宁夏回族自治区银川市妇幼保健院 750001;3.宁夏医科大学病理系,银川 750001)
活性氧(ROS)是氧的代谢产物,过高浓度的ROS可以诱导细胞的脂类、蛋白和DNA氧化,从而引起一系列的病理变化。ROS的氧化损伤导致精子活力下降,影响男性生育力。而在辅助生殖技术助孕过程中,处理患者精子时离心会引发ROS过量产生,加之抗氧化物质在处理过程严重丢失,更容易过氧化而损伤精子功能和活力。减少处理精子过程中产生的ROS,对患者助孕的成功率,尤其对弱精症患者有重要意义。药单体枸杞多糖作为中药枸杞子最珍贵的提取物,含有多种氨基酸和微量元素的蛋白质多糖,富含锌、硒、锰等微量元素。大量研究表明,枸杞多糖具有明显的清除氧自由基、抗氧化损伤、抗细胞凋亡、保护生殖系统的作用[1-3]。本研究探讨枸杞多糖在精液体外离心过程中对于精子氧化应激的作用。
1 资料与方法
1.1一般资料 选取2017年3月1日至2017年10月1日在宁夏医科大学总医院生殖中心门诊就诊的弱精症患者32例为研究对象,年龄25~35岁,已婚未育,身体健康,无吸烟、酗酒和长期接触有害物质史,无生殖道感染和精索静脉曲张史、外伤、遗传性疾病史、性功能障碍史等,体检显示一般情况好,全身及男性生殖系统检查未见异常。按照《世界卫生组织人类精液检查与处理实验室手册》(2011年第五版) 标准,精液体积大于或等于1.5 mL,精子总数大于或等于39×106/mL,前向运动精子百分率(PR)<32%,精子(PR+NP)≤40%。排除液化不良、严重少弱精症、白细胞精子症(过氧化物酶阳性白细胞小于1.0×106/mL)。本课题经宁夏医科大学总医院伦理委员会批准(2016049),患者知情同意。
1.2方法
1.2.1分组与处理 标本处理及检测在宁夏医科大学总医院生殖中心门诊实验室及宁夏医科大学生育力保持教育部重点实验室进行。患者精液标本置于37 ℃水浴摇床液化30 min,充分摇匀后每份标本各吸取1 200 μL平均分为3份,每份400 μL,分为空白对照组、离心组和枸杞多糖组。对照组和离心组各加入100 μL Hanks′平衡液,枸杞多糖组加入100 μL含有一定浓度枸杞多糖的Hanks′液。所有标本放入37 ℃水浴摇床20 min;除空白对照组外,另外两组500 g离心10 min后用移液器轻吹混匀待检。
1.2.2精子相关参数检测 相差显微镜下采用marker计数板检测精子活力,计数10个小格;重复检测2次,若不在可接受误差之内重新取样再次评估。精子存活率实验:采用《世界卫生组织人类精液检查与处理实验室手册》(2011年第五版)推荐的伊红-苯胺黑存活率实验检测法检测。每个标本重复评估2次,评估200个精子,以达到可接受的低抽样误差。如果差异太大,重新2次精液取样制备2张新鲜玻片,再次评估。评定:活精子头部呈白色,死精子头部呈红色和或暗粉红色。精子形态学检测:采用Diff-Quik快速染色试剂盒进行染色观察。制备精子涂片,浸入快速染液1中10 s,快速染液2中5 s,流水冲洗,去除多余染液,封片观察,计数200个精子,记录正常精子个数。
1.2.3精子功能检测 采用浙江星博生物科技有限公司DNA 碎片率细胞流式仪检测试剂盒、精子线粒体膜电位细胞流式仪检测试剂盒,严格按照其标准操作流程操作,采用BD Accuri C6 细胞流式仪器检测。
1.2.4丙二醛(MDA)和ROS水平 使用硫代巴比妥酸(TBA) 比色法进行 MDA 检测,选用南京建成生物制剂公司的 MDA 检测试剂盒,按照试剂盒说明书进行操作,用分光光度计读取吸光度值。选用GENMED精子细胞氧化应激活性超氧阴离子细胞流式仪检测试剂盒,严格按照说明书操作,BD Accuri C6 细胞流式仪器检测其荧光强度。
1.2.5观察指标 观察各组精子的PR、存活率、形态、MDA水平、ROS水平、DNA断裂指数(DFI)、高DNA着色性(HDS)及精子线粒体膜电位(MMP)情况。

2 结 果
2.1精子相关参数情况 枸杞多糖组精子PR和存活率明显高于离心组,低于空白对照组,差异有统计学意义(P<0.05)。枸杞多糖组和离心组精子正常形态率明显低于空白对照组(P<0.05),枸杞多糖组与离心组之间无明显变化(P>0.05),见表1、图1。

红色虚线箭头:该精子颈部异常;红色实线箭头:该精子头部异常;黑色实线箭头:该精子尾部异常;D:头部染成红色或暗粉色认为死精子;L:头部染成白色或浅粉色认为活精子;标尺:20 μm
图1各组精子形态变化
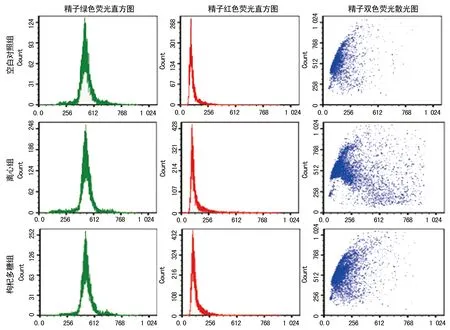
图2 各组细胞流式检测

表1 3组精子PR、存活率和正常形态率比较
2.2DFI、HDS、MMP情况 枸杞多糖组和离心组DFI、HDS均明显高于空白对照组(P<0.05),枸杞多糖组低于离心组(P<0.05),见表2、图2。枸杞多糖组和离心组MMP(49.60±4.28)%、(42.76±3.65)%明显低于空白对照组(57.97±6.23)%(P<0.05),而枸杞多糖组高于离心组(P<0.05)。
2.3MDA、ROS水平 枸杞多糖MDA水平[(8.70±1.38)nmol/mL]与空白对照组[(8.12±1.50)nmol/mL]相近,明显低于离心组[(11.44±1.88) nmol/mL](P<0.05)。枸杞多糖组ROS阳性细胞率[(15.38±4.45)%]明显低于离心组[(29.15±5.20)%],但高于空白对照组[(2.96±1.61)%],差异有统计学意义(P<0.05),见图3。

表2 3组DFI和HDS水平比较

A:空白对照组;B:离心组;C:枸杞多糖组
图3ROS荧光强度直方图
3 讨 论
ROS作为正常有氧代谢的产物,适量ROS在生理状态下能调节精子功能,但过高水平就会对精子产生脂质过氧化和DNA氧化损伤[4]。氧化应激造成的精子膜损伤和 DNA 断裂,可诱发精子功能障碍和形态异常,并最终导致男性不育或子代异常[5]。因此,降低氧化应激导致的精子损伤,可以提升精子活力,提高男性生育力。临床上治疗男性不育,在应用左卡尼汀、谷胱甘肽等具有抗氧化的药物后收到良好的效果[6]。
近几年来,随着人类辅助生殖技术飞速发展,人工授精和体外受精技术已广泛用于治疗少弱精症和无精症,并取得了较好的效果。在辅助生殖技术中,精子离心优选过程打破了精液中的氧化平衡,会造成过量的ROS,对精子造成损伤。有研究表明,精子在体外与 ROS 共同孵育,可明显增加 DNA 断裂片段,甚至加速生殖细胞凋亡,导致精液质量明显下降[7]。因此,在精子的离心处理中,提供抗氧化保护是很有必要的。
枸杞子是宁夏枸杞的干燥成熟果实,具有增强机体免疫、降血脂和抗衰老等作用[8]。枸杞多糖可以保护低密度脂蛋白,防止其氧化,并能有效清除自由基,可以增强体内超氧化物歧化酶和谷胱甘肽-Px的活性[9],使OH-ROS变成低毒性物质,从而有效地阻止脂质过氧化。已有研究证实枸杞多糖在培养小鼠睾丸组织时对生精上皮的热损伤有很好的修复作用,并可降低DNA的氧化损伤[10]。枸杞多糖已被证实具有清除氧自由基、抗氧化的作用[11]。本课题组在前期研究冷冻保护剂的改良实验中,发现枸杞多糖可以降低冷冻过程中的氧化应激,进而改善冷冻后精子的活力和功能,且最佳作用浓度为400 mg/L。在本试验中离心组的MDA水平高于空白对照组,证实了离心过程中产生了过量的ROS;在离心前的精液中加入400 mg/L的枸杞多糖,与离心未干预组比较,MDA水平明显降低,提示枸杞多糖可以降低弱精精子离心过程中的氧化应激;干预组MDA水平和空白对照组之间无明显差异,提示枸杞多糖起到了良好的抗氧化作用,细胞流式检测ROS结果也证实了枸杞多糖抗氧化的结论。枸杞多糖组的ROS阳性细胞率亦明显高于空白对照组,提示枸杞多糖可能降低了外环境过量的ROS,而对于内源性ROS的降低作用不明显,具体机制还需进一步研究。本研究细胞流式检测足够量的精子,比以往免疫荧光显微镜下计数200个精子的方法更具客观性,避免了过多人为主观因素的干预。
氧化应激会破坏线粒体结构的完整性,并通过氧自由基引起精子以 DNA 断裂为主的 DNA 损伤及染色质交联等,造成精子结构损伤,进而影响精子功能,引起少弱精症及精子形态异常[12]。本试验发现离心过程会导致MMP降低,造成弱精精子DNA损伤,枸杞多糖干预可以减弱离心对弱精精子膜电位造成的影响,减少离心对精子的DNA损伤,这可能与枸杞多糖清除氧自由基、保护生殖细胞的作用有关[13-15]。
线粒体是精子运动的能量来源,对ROS极为敏感;ROS可以造成精子线粒体质膜过氧化改变,尤其对线粒体内膜而言,因为内膜上有呼吸链和产生ATP的酶。线粒体受损,会导致MMP降低,精子功能下降[19]。枸杞多糖对精子线粒体的保护作用,改善了精子重要的能源工厂,本试验加入枸杞多糖干预之后,离心后精子的PR和存活率都有明显提高,但和空白对照组间尚有差异,结合前面所述氧化应激的结果,提示枸杞多糖可以抗氧化,从而改善离心过程中精子的质量,但并不能阻止完全过量ROS的生成,其还是会导致MMP的降低及精子DNA损伤。还需要进一步研究精子离心过程中的损伤机制和枸杞多糖的保护机制。
综上所述,提取自天然植物枸杞中的枸杞多糖在弱精精子离心过程中,可以减少弱精精子的过氧化应激,对精子起到了一定的保护作用;下一步会研究其保护作用的具体机制,从而丰富天然抗氧化剂的选择,优选更合适的保护剂,以保护弱精精子洗涤过程中的精子质量和功能。

