水中苯酚和邻苯二酚在磁性氧化石墨烯表面的吸附
吴玉花, 马 倩, 李 昊, 丁玉静, 张云敬, 刘 帅, 王 强
(宁夏大学 省部共建煤炭高效利用与绿色化工国家重点实验室 化学化工学院,宁夏 银川 750021)
苯酚及其衍生物是石油炼制、煤炭焦化、煤气精制、造纸和多种精细化学品合成等诸多化工过程中产生的一类有机污染物。这些酚类化合物具有致癌、致畸、致突变的潜在毒性,且在环境中可积累,对人类健康、水环境生态及农业等都会造成很大危害。因此,不同化工过程产生的大量含酚废水已经被列为有毒的危险环境污染物之一。含酚废水的治理成为学术界和产业界广泛关注的重要研究课题[1]。
由于含酚废水来源广泛,水体中所含酚类化合物的种类和初始浓度相差较大。根据酚质量浓度的差异,一般可将其分为高浓度(大于1000 mg/L)含酚废水、中浓度(5~500 mg/L)含酚废水和低浓度含酚废水进行针对性处置。对于中、高浓度的含酚废水,通常采用萃取、汽提脱酚、化学沉淀等方法进行酚类化合物的回收利用。而低浓度的含酚废水由于酚的浓度低,回收经济性差,且相对量巨大,一般采用催化降解、生物降解、吸附等方法进行排放前处理[2-3]。由于酚类化合物化学结构上较难降解,催化降解、生物降解方法一般需要经过多级处理才能完成,所需处理成本随着处理过程的延长明显增加。吸附法作为最常用污水处理方法之一已被用于含酚废水的处理过程。活性炭、大孔树脂、新型碳材料等被用于废水中酚类化合物的吸附去除[4-6]。
对于吸附法去除污水中的有毒有害成分,吸附材料的选择是其核心所在。近年来氧化石墨烯由于其独特的二维纳米结构、高比表面积、高表面活性和高含氧官能团,在废水处理领域显示出很多优势[7-10],具有潜在的应用前景。需要指出的是,吸附污染物后的氧化石墨烯将会溶解在水中,回收困难且易造成二次污染。而磁性纳米粒子具有大批量可控制备的特点,且具备本征磁性,使其便于回收和再次利用[11-12]。因此,可将磁性纳米粒子与氧化石墨烯复合制备得到磁性氧化石墨烯纳米复合材料,保留两种材料优点,同时便于回收和再次利用,有效降低使用成本。
笔者在分别制备氧化石墨烯和纳米Fe3O4粒子的基础上,通过材料复合处理,合成新型磁性氧化石墨烯(MGO)。以制备的磁性氧化石墨烯纳米材料为吸附剂,研究其对水体中苯酚及邻苯二酚的吸附去除。考察吸附接触时间、pH值、离子强度等因素对磁性氧化石墨烯吸附苯酚和邻苯二酚的影响,分析吸附过程的等温线和动力学机制。
1 实验部分
1.1 试剂与仪器
试剂:石墨粉,天津市褔晨化学试剂厂产品;98%(质量分数)浓H2SO4、36.5%(质量分数)浓HCl、氯化钡(BaCl2)、高锰酸钾(KMnO4),天津市大茂化学试剂厂产品;五氧化二磷(P2O5),北京化学试剂公司产品;过二硫酸钾(K2S2O8),天津市北联精细化学品开发有限公司产品;30%(质量分数)双氧水(H2O2),烟台市双双化工有限公司产品;FeCl2·4H2O,Aladdin Chemistry Co. Ltd产品;FeCl3·6H2O,北京北化精细化学品有限责任公司产品;氢氧化钠(NaOH),天津市光复科技发展有限公司产品;无水乙醇,天津市富宇精细化工有限公司产品;苯酚,国药集团化学试剂有限公司产品;邻苯二酚,阿拉丁试剂公司产品。以上试剂均为分析纯。实验所用水为自制去离子水。
仪器:油浴锅,SHA-C振荡器,GT16-3离心机,DZF-6020真空干燥器,电子天平,KQ5200DE数控超声波清洗器,磁力搅拌器。752型紫外分光光度计,上海光谱仪器有限公司产品;JEOL-1230透射电子显微镜,日本电子株式会社产品;Spectrum Two傅里叶变换红外光谱仪,美国PerkinElmer公司产品。
1.2 磁性氧化石墨烯制备
采用改进的Hummers法制备氧化石墨烯[13]。将石墨粉4 g加入到15 mL 98%浓H2SO4、2.5 g K2S2O8及2.5 g P2O5的混合物中预氧化,静置获得沉淀,于50 ℃烘干得预氧化产品。称取1 g获得的预氧化产品于36 mL 98%浓H2SO4和5 g KMnO4中再氧化,然后将其加入去离子水中,搅拌并逐滴加入质量分数30%的H2O2至反应物呈现亮黄色。静置分层,取下层金黄色液体,加入 200 mL 质量分数10%的HCl溶液洗涤多次,以10000 r/min高速离心,离心后上层清液中加入1 mol/L BaCl2溶液至无白色沉淀产生。再用去离子水洗涤多次,高速离心至上层清液pH值约为7。去除上层清液,得黑色黏稠固体,将其置于50 ℃的烘箱中烘干,即得到氧化石墨烯(GO)。
采用混合共沉淀法制备Fe3O4纳米粒子。分别称取0.5836 g FeCl2·4H2O和1 g FeCl3·6H2O,加入250 mL去离子水,缓慢加入0.5 mol/L NaOH溶液直至溶液变为黑色,静置分层。下层黑色溶液用去离子水和无水乙醇分别洗涤3次,将得到的黑色黏稠固体于40 ℃真空干燥箱中干燥12 h,得到Fe3O4纳米粒子。
采用共混法制备磁性氧化石墨烯[14-15]。称取0.2 g制备的Fe3O4纳米粒子,加入100 mL去离子水;称取0.5 g制备的氧化石墨烯,加入500 mL去离子水。分别将上述混合物在40 kHz下超声溶解,待Fe3O4和氧化石墨烯全部溶解,将2种溶液混合,然后搅拌30 min,再在40 kHz下超声2 h,得到磁性氧化石墨烯胶体溶液。采用高速离心机以 10000 r/min 的速率离心10 min,将离心出来的固体于30 ℃烘干,得到磁性氧化石墨烯(MGO)样品。
1.3 材料表征
采用JEOL-1230透射电镜和Spectrum Two傅里叶红外光谱仪表征合成的磁性氧化石墨烯(MGO)。图1为磁性氧化石墨烯(MGO)透射电镜照片。由图1可见,氧化石墨烯特有的层状结构以及表面褶皱。此外,图1中深色点状团聚颗粒物为Fe3O4纳米粒子,其分布呈现明显分散性。结果表明,磁性纳米粒子成功地负载在氧化石墨烯表面。
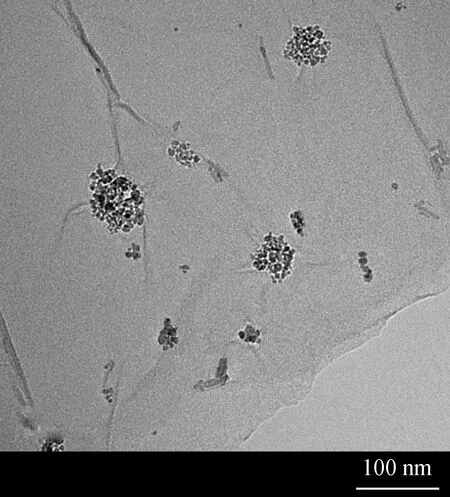
图1 磁性氧化石墨烯(MGO)透射电镜照片Fig.1 Transmission electron microscope image of MGO
图2为磁性氧化石墨烯的傅里叶红外光谱。由图2可知,位于3426和3131 cm-1的宽峰可归因于—OH的伸缩振动,1627 cm-1的强峰来源于 C=O 的伸缩振动,1400和1384 cm-1处的峰分别源于C—OH及C—O—C的伸缩振动。581 cm-1处出现明显的峰,为Fe—O伸缩振动所贡献。结果表明,Fe3O4纳米粒子与氧化石墨烯成功复合,且复合前后氧化石墨烯的骨架结构未受明显影响。
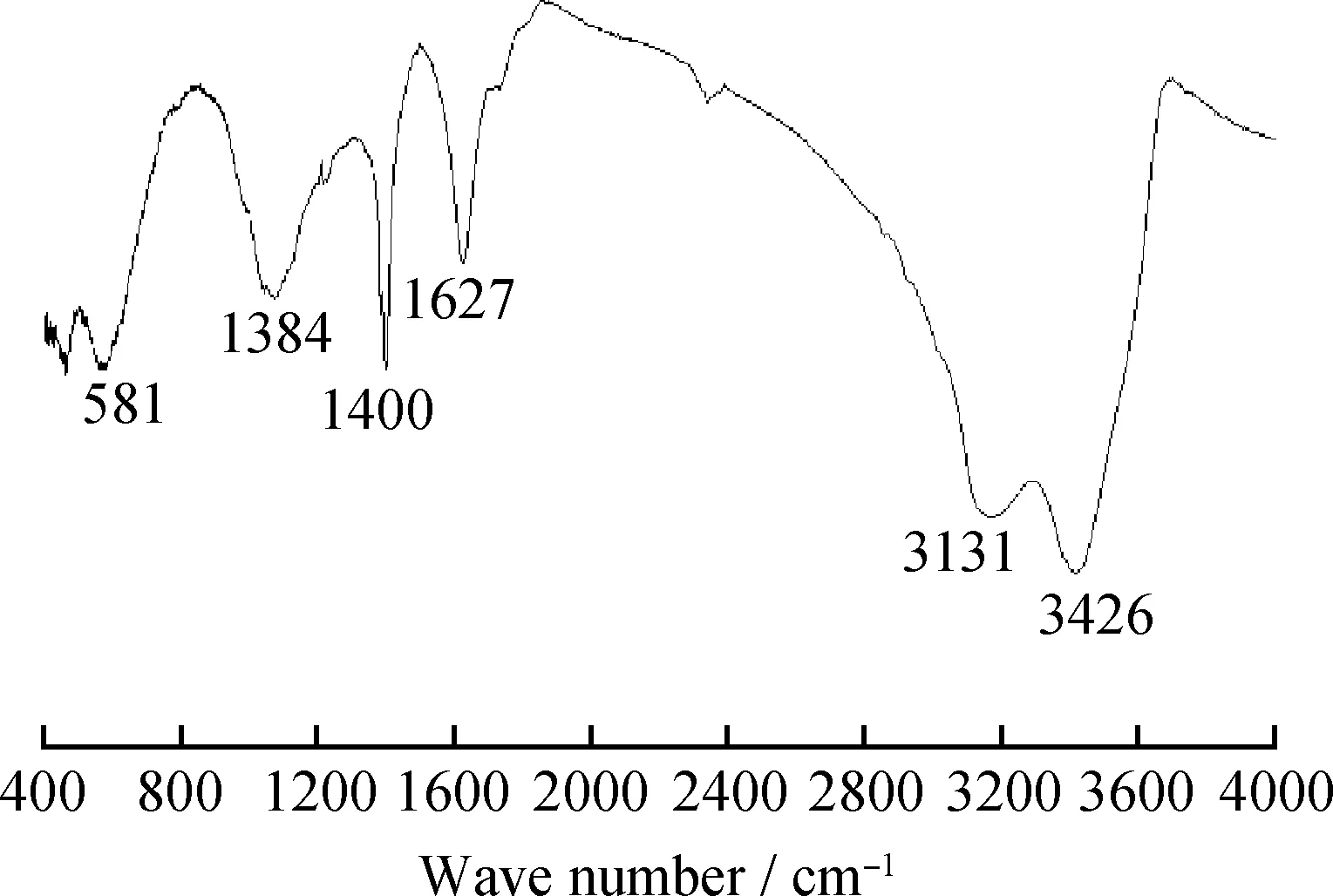
图2 磁性氧化石墨烯(MGO)的傅里叶红外光谱Fig.2 Fourier transform infrared spectrum of MGO
1.4 吸附实验
称取0.0640 g磁性氧化石墨烯加水超声溶解,在250 mL容量瓶定容配制质量浓度为0.256 g/L的磁性氧化石墨烯胶体溶液。分别取2 mL 0.256 g/L磁性氧化石墨烯胶体溶液、2 mL 40 mg/L苯酚或邻苯二酚溶液混合于5 mL密闭离心管中,置于15 ℃恒温水浴振荡器中进行避光振荡吸附。吸附平衡后,上层清液使用0.45 μm水系滤膜过滤。所得溶液采用752型紫外分光光度计在最大波长处(苯酚270 nm,邻苯二酚275 nm)测定吸光度,根据标准曲线计算溶液中苯酚和邻苯二酚的浓度。后续实验均按照类似方法进行。苯酚和邻苯二酚在磁性氧化石墨烯上的平衡吸附量(qe, mg/g)根据式(1)计算:
qe=(C0-C1)/CMGO
(1)
式(1)中,C0为溶液中酚类初始质量浓度,mg/L;C1为溶液中酚类吸附后质量浓度,mg/L;CMGO为磁性氧化石墨烯的质量浓度,g/L。
考虑到酚类挥发可能影响吸附实验室结果,对苯酚和邻苯二酚在25 ℃、35 ℃和45 ℃的挥发性进行了测试。结果表明,苯酚和邻苯二酚的挥发性对吸附实验结果无明显影响。
2 结果与讨论
2.1 接触时间的影响
图3为吸附接触时间对苯酚和邻苯二酚在磁性氧化石墨烯上吸附的影响。由图3可见,吸附接触时间对于磁性氧化石墨烯吸附苯酚和邻苯二酚具有显著影响。在吸附的初始阶段,吸附速率较高,随后吸附速率有所下降。酚类的吸附量随时间变化不断增加,苯酚和邻苯二酚均在60 min达到最大吸附量。60 min后吸附量略有下降,可能是剧烈振荡和时间延长使吸附的酚类脱离磁性氧化石墨烯重新回到溶液所致。因此,本研究中采用60 min为吸附平衡时间研究磁性氧化石墨烯对苯酚和邻苯二酚的吸附行为和机理。这与杨晓霞等[16]采用改性半焦吸附苯酚的实验中使用的吸附平衡时间相同。然而,Yu等[17]和Lee等[9]分别采用还原氧化石墨烯和芳基官能化的还原氧化石墨烯吸附苯酚均需6 h才能达到吸附平衡。因此,磁性氧化石墨烯可以实现更快的吸附平衡。需要指出的是,15 ℃下磁性氧化石墨烯对邻苯二酚的吸附量最高可达104.5 mg/g,而相同情况下对苯酚的吸附量仅为18.4 mg/g,即对邻苯二酚的吸附量约为对苯酚吸附量的6倍。可能是邻苯二酚比苯酚多1个—OH,可增强酚类与磁性氧化石墨烯之间的相互作用。
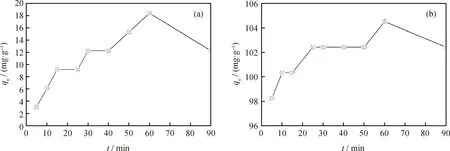
图3 不同吸附接触时间下磁性氧化石墨烯吸附苯酚和邻苯二酚Fig.3 Adsorption of phenol and catechol by MGO with various contact time(a) Phenol; (b) Catechol
2.2 溶液pH值的影响
溶液的pH值改变吸附材料表面官能团的离子状态,同时也会影响吸附质的溶解度、亲水性及离子化程度[18]。笔者使用0.2 mol/L NaOH或0.2 mol/L HCl调节溶液pH值为2~9,考察了溶液pH值对磁性氧化石墨烯吸附酚类的影响,结果如图4所示。由图4可知:当溶液pH值由2升至6时,磁性氧化石墨烯吸附苯酚的平衡吸附量由 3.1 mg/g 升至21.5 mg/g;当溶液pH值大于6时,平衡吸附量逐渐降低;pH值为8和9时,平衡吸附量约为9 mg/g。这表明磁性氧化石墨烯适合在弱酸性条件下对苯酚进行吸附。碱性溶液环境不适合提高苯酚的平衡吸附量。对于邻苯二酚的吸附,当pH值在2~8时,平衡吸附量仅小幅降低(由123.3 mg/g降至100.3 mg/g)。但pH值达到9时,平衡吸附量快速降至41.81 mg/g。因此,与苯酚的吸附相同,碱性溶液环境不利于提高邻苯二酚的平衡吸附量。已有研究[19]表明,氧化石墨烯分散在水中时由于表面充足的含氧官能团而带负电荷。当溶液呈现碱性时,氧化石墨烯和苯酚/邻苯二酚的氧负离子数量增加,负电荷密度变大。此时吸附剂和吸附质间的静电斥力作用将降低分子间的有效吸附,进而导致吸附量显著降低。

图4 不同pH值下磁性氧化石墨烯吸附苯酚和邻苯二酚Fig.4 Adsorption of phenol and catechol by MGO at various pH values(a) Phenol; (b) Catechol
2.3 离子强度的影响
废水中经常存在的无机盐离子会影响磁性氧化石墨烯在水溶液中的分散性,改变吸附剂和吸附质间的相互作用[20]。笔者通过加入不同质量浓度NaCl溶液的方式探讨溶液离子强度对磁性氧化石墨烯吸附苯酚和邻苯二酚的影响,结果如图5所示。由图5可知:当NaCl质量浓度由10 g/L增至 40 g/L 时,平衡吸附量增大;当NaCl质量浓度继续增大时,平衡吸附量呈现下降趋势;NaCl质量浓度在30~40 g/L时,磁性氧化石墨烯对苯酚和邻苯二酚具有最好的吸附性能。其原因可能在于:NaCl质量浓度低时,苯酚和邻苯二酚在磁性氧化石墨烯表面附着;随着NaCl质量浓度逐渐提高,将压缩扩散双电层,导致排斥力减少,因此吸附量增多;若继续提高NaCl质量浓度,静电作用对吸附的影响显著,会削弱酚类化合物与磁性氧化石墨烯间的吸引力,而且此时Na+和Cl-也会进入双电层竞争吸附,从而导致平衡吸附量下降。

图5 不同离子强度下磁性氧化石墨烯吸附苯酚和邻苯二酚Fig.5 Adsorption of phenol and catechol byMGO with various ionic strength
2.4 吸附等温线
笔者考察了不同温度(25、35和45 ℃)以及苯酚和邻苯二酚不同初始质量浓度条件下的吸附行为,获得吸附等温线。采用Langmuir型等温线方
程拟合数据:
Ce/qe=Ce/qm+1/(kLqm)
(2)
RL=I/(1+kLC0)
(3)
其中,qm为吸附剂最大理论吸附量,mg/g;kL为Langmuir等温吸附常数,L/mg;RL为用于表示吸附过程性质的无量纲平衡参数,RL数值在0~1时利于吸附,大于1时不利于吸附,等于1时吸附等温线为线性的,等于零时吸附不可逆[18]。
采用Langmuir型等温线方程拟合获得的苯酚和邻苯二酚在磁性氧化石墨烯上的吸附等温线如 图6 所示,拟合数据见表1。由图6和表1可知,温度对最大平衡吸附量的影响显著:温度从25 ℃升至35 ℃时,磁性氧化石墨烯吸附苯酚和邻苯二酚的最大吸附量有所增长;当温度升至45 ℃时,平衡吸附量显著下降。这是由于随着温度升高,吸附质的活动能力增强,更容易到达磁性氧化石墨烯的表面,但温度高于35 ℃时,吸附过程可能为放热过程,故最大平衡吸附量显著下降。
拟合得到的磁性氧化石墨烯吸附苯酚和邻苯二酚的线性相关系数R2均在0.98以上。因此,Langmuir型等温方程能够很好地描述苯酚和邻苯二酚在磁性氧化石墨烯上的吸附行为。这表明苯酚和邻苯二酚在磁性氧化石墨烯上的吸附主要为单层表面吸附,即所有吸附位均相同且被吸附的酚分子之间相互独立。计算获得苯酚和邻苯二酚体系的RL,其最大数值分别不超过0.56和0.01,均明显小于1,因此吸附作用是易于进行的。

图6 不同温度下磁性氧化石墨烯吸附苯酚和邻苯二酚的吸附等温线Fig.6 Adsorption isotherms of phenol and catechol adsorpted by MGO at various temperatures(a) Phenol; (b) Catechol
2.5 吸附动力学
为探究吸附机理和可能的控速步骤,对于吸附动力学的研究是非常重要的。笔者对苯酚和邻苯二酚在磁性氧化石墨烯上的吸附进行了准一级动力学(式(4))和准二级动力学(式(5))的数学模型分析:
ln(qe-qt)=lnqe-k1t
(4)

表1 磁性氧化石墨烯吸附苯酚和邻苯二酚的Langmuir等温线方程拟合参数Table 1 The correlative parameters of Langmuir model of phenol and catechol on MGO
t/qt=1/(k2qe2)+t/qe
(5)
其中,k1(h-1)和k2(g·mg-1·min-1)分别为准一级动力学和准二级动力学的扩散速率常数;qt为时间t时酚类化合物在磁性氧化石墨烯上的吸附量,mg/g。苯酚和邻苯二酚的吸附动力学拟合结果如图7 所示,计算得到的动力学参数见表2。

图7 磁性氧化石墨烯吸附苯酚和邻苯二酚的准一级动力学和准二级动力学曲线Fig.7 Pseudo-first-order and pseudo-second-order kinetic models of phenol and catechol adsorpted by MGO(a) Pseudo-first-order kinetic model; (b) Pseudo-second-order kinetic model

Kinetic modelPhenolCatecholqe/(mg·g-1)k1/ h-1k2/(g·mg-1 ·min-1)R2qe/(mg·g-1)k1/h-1k2/(g·mg-1·min-1)R2Pseudo-first-order17.20.0310.9225.50.02460.751Pseudo-second-order27.60.0010.863104.20.01920.999
由图7和表2可知,苯酚吸附的准一级动力学模型具有较好的相关性,相关系数R2为0.922,拟合效果与实际相符合。而且,该模型预测的理论平衡吸附量(17.2 mg/g)与实际平衡吸附量(18.4 mg/g)数值接近。因此,准一级动力学模型能够很好地描述苯酚在磁性氧化石墨烯上的吸附动力学行为。这表明苯酚吸附速率很可能受扩散步骤控制。而对于邻苯二酚,准一级动力学模型的拟合效果不理想,相关系数R2仅为0.751,预测的理论平衡吸附量与实际平衡吸附量数值也有较大差距;准二级动力学模型则具有较好的相关性,相关系数R2达到0.999,而且预测的理论平衡吸附量(104.2 mg/g)与实际平衡吸附量(104.5 mg/g)基本一致。因此,准二级动力学模型能够很好地描述邻苯二酚在磁性氧化石墨烯上的吸附动力学行为。这表明邻苯二酚的吸附速率很可能受化学吸附机理控制,其涉及到吸附剂与吸附质之间的电子共用或电子转移[18]。
3 结 论
磁性氧化石墨烯纳米复合材料在磁场作用下可实现固-液分离便于回收和循环利用。笔者考察了诸如吸附剂和吸附质的接触时间、溶液酸碱条件、离子强度等因素对于磁性氧化石墨烯吸附苯酚和邻苯二酚的影响。主要结论如下:
(1)磁性氧化石墨烯对苯酚和邻苯二酚的吸附量随时间延长不断增加,但均在60 min达到最大吸附量。无机盐离子强度会影响磁性氧化石墨烯对苯酚和邻苯二酚的吸附,若为实现较高的吸附量,则溶液的离子强度不能过大。磁性氧化石墨烯适合在酸性条件下对苯酚和邻苯二酚进行吸附。
(2)吸附等温线的测定结果表明,Langmuir型等温方程能够很好地描述苯酚和邻苯二酚在磁性氧化石墨烯上的吸附行为,吸附主要为单层表面吸附。
(3)苯酚在磁性氧化石墨烯上的吸附符合准一级动力学模型,吸附速率很可能受扩散步骤控制。邻苯二酚在磁性氧化石墨烯上的吸附符合准二级动力学模型,吸附速率很可能受化学吸附机理控制。

