大刺鳅致病性维氏气单胞菌分离鉴定及药物敏感性研究
林 煜,樊海平,陈 斌,薛凌展,钟全福,张 坤,吴 斌
(1福建省淡水水产研究所,福州350002;2福建天马科技股份集团有限公司,福州350308;3福建省水产技术推广总站,福州350002)
0 引言
维氏气单胞菌(Aeromonas veronii)普遍存在于淡水、污水、土壤乃至海水中,部分菌株是微生态环境中正常存在的[1],而另一些菌株具有致病性,广泛感染水产养殖动物 ,如中华绒螯蟹[2、3]、黄喉拟水龟[4]、黄颡鱼[5、6]、中华鳖[7]、青海湖裸鲤[8]、鲫[9-12]、鲟[13、14]、南方鲇[15]、乌鳢[16]、胭脂鱼[17]、齐口裂腹鱼[18]、金鱼[19]、鳗鲡[20]、罗非鱼[21、22]、中国大鲵[23]和框镜鲤[24]等诸多淡水养殖动物,是水产养殖重要的致病菌之一。此外,维氏气单胞菌对恒温动物是一种机会致病菌,但有人认为免疫功能健全者也可被感染,患者发生急性腹泻、菌血症、脑膜炎和心内膜炎等。近年来,日益增多的病例表明维氏气单胞菌已成为一种重要的人、鱼共患致病菌,并在食品安全上表现出重要意义,部分国家已经将其规定为食品安全的检疫对象[1、25]。
大刺鳅(Mastacembelus armatus)主要分布在中国长江以南各水系。近年来,滥捕和环境污染加重等因素,造成大刺鳅野生资源锐减,部分省份已将其列入重点保护的野生动物名录[26-28]。福建省淡水水产研究所自2013年开始,持续开展人工繁育、苗种培育、病害防治、饲料营养和养成等技术研究,突破了人工繁育、规模化苗种培育、精养池和土池养殖等关键技术[29-35]。在近年冬季温棚养殖过程中发现,为了维持水温而减少换水量,易引起养殖水体氨氮和亚硝酸盐升高,部分大刺鳅出现活力下降、游动缓慢、食欲减退或丧失的症状;随着病情进一步发展,病鱼体表局部皮肤特别是鳃盖表面发炎后形成溃疡,有时伴随烂尾症状,解剖发现病鳅鳃丝溃烂,肝脏、肾脏和脾脏肿大并充血,部分病鱼呈出血和腹水症状。此病从幼鱼到成鱼均发生,驯养的野生大刺鳅发病率高于人工繁育的子一代和子二代。由于发病后治愈期长,且易反复发病,严重的单口池累计死亡量可达30%。为了明确病原,笔者开展了病原的分离纯化、致病性和致病菌株的药物敏感性试验,以期为该病科学防控提供研究基础。
1 材料与方法
1.1 试验材料
患病大刺鳅(体长8~22 cm,体质量2~54 g)和回归感染用健康大刺鳅(体长18~22 cm,体质量45~54 g),均采自顺昌县兆兴鱼种养殖有限公司。营养琼脂(Nutrient Agar)、脑心浸液培养基(Brain Heart Infusion Medium)、营养肉汤(Nutrient Broth)、水解酪蛋白琼脂、革兰氏染色液(Gram Stain Sets)均购自北京陆桥技术有限责任公司。药敏纸片和细菌微量生化反应管购于杭州微生物试剂有限公司。TaqMix、DNA Marker DL2000 购自天根生化科技(北京)有限公司。细菌基因组 DNA 提取试剂盒、PCR 扩增细菌 16S rDNA 试剂盒、TaqDNA 聚合酶均购自上海生工生物工程技术有限公司。
1.2 病原菌的分离纯化与保存
取病鱼体表局部皮肤和鳃盖表面具有溃疡症状的病鱼,实验室无菌操作分别取肝、肾组织于营养琼脂平板划线分离细菌,28℃培养24 h后挑取形态大小、颜色等特征基本一致的优势菌落重复纯化2 次,获得纯培养后,接种脑心浸出液培养基,28℃培养16 h,加入培养基体积25%无菌甘油混匀后,先放置于-20℃冰箱2 h,后转移到-80℃冰箱备用。
1.3 回归感染试验
取健康大刺鳅暂养于150 L玻璃缸中,连续曝气,温度控制在25~27℃,日投喂2次,正常排污投饵2次,每次30%,暂养7天稳定后,试验前停食24 h后用于回归感染试验。
将-80℃保存菌株接种于营养琼脂平板,28℃培养24 h,无菌生理盐水清洗制成菌悬液,根据预试验,采取无菌生理盐水5 倍稀释,麦氏比浊法测量细菌悬液浓度至 4.70×1010、9.40×109、1.88×109、3.75×108、7.5×107cfu/mL。随机捞取健康大刺鳅,共分6 组,每组7尾,背部肌肉注射,试验组每尾注射细菌悬液0.2 mL,对照组注射0.2 mL 无菌生理盐水,暂养期间连续曝气,不投饵,水温26~28℃,每天换水1 次,每次换水30%。每日观察记录各组发病情况,及时捡除死亡大刺鳅,连续观察14天,对濒临死亡、症状显著的大刺鳅进行细菌的再次分离、纯化和保种。并进行二次回归感染、细菌分离、纯化和保种。
1.4 菌株分类与鉴定
1.4.1 形态特征观察 将分离纯化得到的菌株接种于普通营养琼脂平板上,28℃培养14~16 h,观察菌落形态特征,挑取单菌落,革兰氏染色,在Leica光学显微镜下观察菌体形态特征。
1.4.2 生理生化特性测定 参照细菌微量生化反应管说明书及《伯杰细菌鉴定手册》[36]具体方法对纯化的细菌进行鉴定。
1.4.3 16S rDNA鉴定 将保存菌株接种于营养肉汤中,28℃,200 r/min振荡培养18 h后,取菌液经12000 r/min离心10 min后收集菌体,DNA的提取参考天根细菌基因组DNA 提取试剂盒说明书进行。上游物序列5′-AGAGTTTGATCCTGGCTCAG-3′,下游引物序列 5′-ACGGCTACCTTGTTACGACTT-3′,PCR 反 应 体 系50 µL,其中2×Premix Taq 25 µL(Takara),上下游引物各2µL(10µmol/L),DNA模板4µL,ddH2O 17µL。反应条件:94℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸1 min 20 s,30 个循环;最后72℃延伸7 min。PCR 反应产物在120 V、1.0%的琼脂糖凝胶中电泳25 min后,用凝胶成像系统观察电泳结果后送铂尚生物技术(上海)有限公司测序,通过NCBI 中的nucleotide blast 进行序列同源性分析,并采用ClustalX 1.8 软件进行序列比对,再通过MEGA 5.0 软件构建系统发育树。
1.5 药物敏感性试验
将首次分离保存菌株接种营养肉汤,28℃培养24 h后,调整菌液浓度至108cfu/mL。取100µL 调整后的细菌悬液,均匀涂布于水解酪蛋白琼脂平板,适度干燥后用无菌镊子将药敏纸片贴于培养基表面,28℃培养24 h 后分别测量各种抗生素纸片抑菌圈的直径,根据产品说明书判别结果。
2 结果与分析
2.1 病原菌的分离纯化与培养
从自然发病、一次回归感染和二次回归感染病鱼中共分离纯化到3 株细菌,分别命名为MaG170114NA、MaG170808NA、MaG170827NA。
2.2 回归感染
2次回归感染发病鱼主要症状表现基本一致。24 h,注射针孔周围的组织微凸起且皮肤颜色发白,死亡的大刺鳅肝脏肿大、颜色暗红;48 h,针孔周围皮肤有出血现象,死亡大刺鳅肝脏肿大、颜色变浅呈粉色;3 天后,针孔处皮肤开始溃烂,形成开放性创口,死亡大刺鳅肝脏颜色呈土黄色,失血。个别死亡鱼解剖腹腔积水。
人工归回感染试验结果表明,分离菌株MaG170114NA 的一次回归浓度达1.88×109cfu/mL 3天产生死亡,浓度达9.4×109cfu/mL 1天产生死亡、3天死亡率100%。一次回归感染分离菌株MaG170808NA的二次回归感染浓度达1.85×108cfu/mL,24 h 产生死亡;浓度达9.24×108cfu/mL,24 h死亡率达100%,详细结果见表1~2。
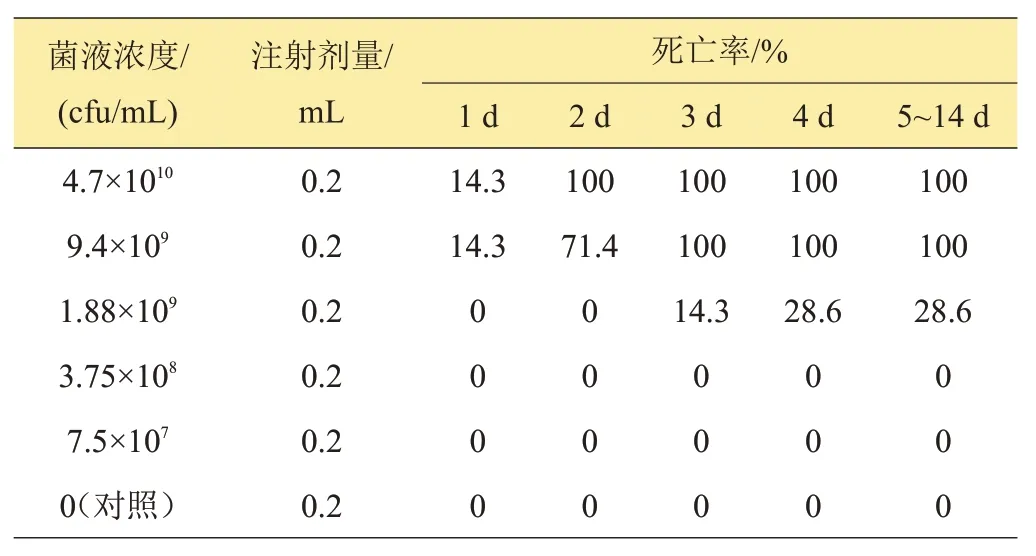
表1 分离菌株MaG170114NA的一次回归感染试验结果
2.3 病原菌的分类与鉴定
2.3.1 细菌的形态学特征 分离菌株在普通营养琼脂平板上生长较快,菌落呈乳白色圆形,呈中央突起,表面光滑湿润,直径为2~3 mm,表面光滑,颜色灰白色。菌体革兰氏染色阴性,两端钝圆,短杆状,菌体大小(0.5~0.6)μm×(0.8~1.0)μm,无芽胞。
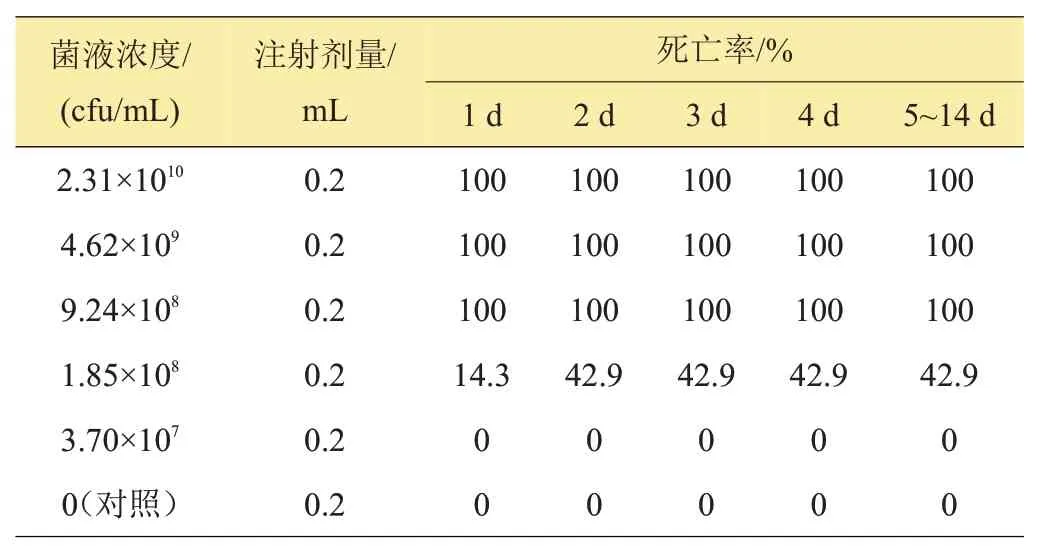
表2 一次回归感染分离菌MaG170808NA的二次回归感染试验结果
2.3.2 生理生化特性 分离菌株具有运动性,能在1%NaCl生长,不能在6%NaCl中生长,氧化酶、V-P反应、甲基红、吲哚试验、赖氨酸脱羧酶、鸟氨酸脱羧酶、苯丙氨酸脱氨酶阳性,精氨酸双水解、硫化氢产生、尿素水解、丙二酸盐利用阴性,可利用葡萄糖、麦芽糖、甘露糖、海藻糖等,不发酵棉子糖、鼠李糖、阿拉伯糖等,详细结果见表3。参照《常见细菌系统鉴定手册》和《伯杰细菌鉴定手册》,分离菌株的主要生化特征与维氏气单胞菌特性基本一致,初步鉴定分离菌株为维氏气单胞菌(Aeromonas veronii)。
2.3.3 16S rDNA 序列分析 PCR 扩增MaG170114NA菌株的16S rDNA 基因,获得约为1500 bp左右的预期片段。PCR 扩增产物经测序及Blastn 在线比对分析,结果表明菌株MaG170114NA的16S rDNA与NCBI数据 库 的Aeromonas veroniiB33(GeneBank 登 录 号KU188295)和Aeromonas veroniiCT17(GeneBank 登录号KM362731)的16S rDNA 基因序列同源性为100%。从构建的致病性菌株MaG170114NA 的系统发育树(图4)可知,该致病性菌株与维氏气单胞菌归属在同一分支中,即与维氏气单胞菌亲缘关系较近,可将其鉴定为维氏气单胞菌。
2.4 药物敏感性
菌株MaG170114NA对所测试的24种抗菌药物中的氨基糖苷类,β-内酰胺类中的头孢噻肟、头孢他啶以及大环内酯类药物中的红霉素高度敏感;对喹诺酮类的氧氟沙星、环丙沙星、依诺沙星及磺胺类的复方新诺明中度敏感;对β-内酰胺类的青霉素类药物,喹诺酮类的诺氟沙星和恩诺沙星,大环内酯类的罗红霉素,四环素类的四环素、多西环素,氯霉素类的氟苯尼考,糖肽类的万古霉素,多粘菌素类的多粘菌素B等12种药物耐药,详细结果见表5。

表3 分离菌株部分生理生化特征
3 结论
本研究对在人工养殖环境下发生的,主要症状表现为腹腔积液、肠道发炎、肛门红肿、体表溃烂、烂尾、烂鳃等症状的大刺鰍进行了跟踪调查。对具典型症状的病鱼的肝、肾等组织分离纯化得到优势菌株MaG170114NA。人工回归感染证实原始分离菌株MaG170114NA 为该患病大刺鳅致病菌。对菌株MaG170114NA进行形态特征、生理生化特性测定,并结合16S rDNA 序列分析和系统发育树构建,鉴定MaG170114NA 菌株为维氏气单胞菌。采用药敏纸片扩散法测定菌株MaG170114NA 的药物敏感性,该菌株对头孢他啶、庆大霉素、红霉素等8 种药物高度敏感;对氧氟沙星、环丙沙星、依诺沙星及复方新诺明4种药物中度敏感;对氟苯尼考、恩诺沙星多粘菌素B等12种表现耐药。

图4 MaG170114Na菌株的系统发育树
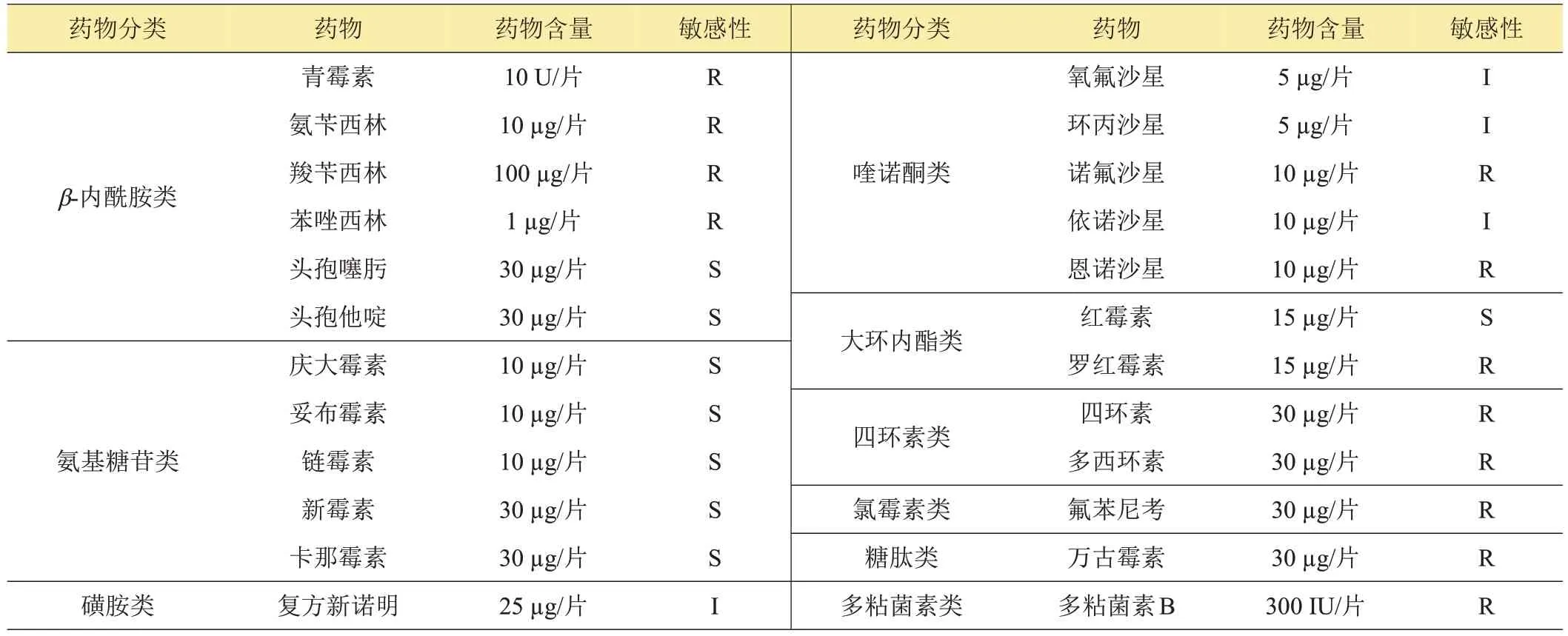
表5 分离菌株MaG170114NA药敏试验结果
4 讨论
维氏气单胞菌是一种人、兽、鱼共患病原菌,广泛存在于水体及土壤之中,是动物肠道和自然生态系统的正常菌群之一[1]。作为条件致病菌,有些菌株具有很强的毒力,对水产经济动物具有很强的致病性,可引起黑鱼、锦鲤、框镜鲤、西伯利亚鲟、异育银鲫、草鱼、鳗鲡、黄颡鱼、斑点叉尾鲴、胭脂鱼、中华鳖、中华绒螯蟹等大多水产动物大量发病死亡[37-40],但维氏气单胞菌引起养殖大刺鳅发病并产生死亡为首次报道。
维氏气单胞菌感染水生动物后的主要症状以鳍基出血、腹腔积液、肛门红肿外凸等为主要特征[2-25],如中华鲟感染维氏气单胞菌的主要症状为鳍基具出血点,鳃丝暗红,腹部膨胀、泄殖孔肿胀,腹腔积血色液体,肠道充血[13];齐口裂腹鱼感染维氏气单胞菌的主要症状为鳍基充血,头部鳃盖等充血,肛门红肿,腹腔积水,肠道发炎[18];中国大鲵体表粘液脱落,皮肤出现白斑,四肢溃烂,露出红色肌肉,胃、肠道内壁有出血点[23];胭脂鱼感染维氏气单胞菌的主要症状为眼球充血,腹部有明显出血点,体表少量鳞片脱落,肛门红肿,并有大量黏液流出[17];乌鳢感染维氏气单胞菌的主要症状为体表有大量出血点,鳍条充血,肛门红肿,肠道充血[16];暗纹东方鲀感染维氏气单胞菌的主要症状为鳍基部充血、肛门红肿、腹部膨胀、腹腔内积血色液体[14];美国鲥鱼感染维氏气单胞菌的主要症状为鳍条充血、鳃部颜色鲜红、肛门红肿、腹腔有血水、肠道内无食物充满黏液[41]。与本研究结果对比显示,维氏气单胞菌感染大刺鳅主要症状与大多水生动物症状相似,主要表现为腹腔积液、肠道发炎、肛门红肿,肝脏、肾脏和脾脏肿大并充血,但大刺鳅还同时表现体表局部发炎后形成溃烂病灶的典型症状,有时伴随烂尾、烂鳃症状,这可能是大刺鳅具有群体栖息习性,体背部棘相互刺伤,导致维氏气单胞菌病原菌在伤口处大量繁殖,最终表现出体表溃烂症状及烂尾症状。这与笔者在回归试验中,试验鱼注射部位表现出来的溃烂等症相似。
不同地域、不同季节、不同宿主甚至同一养殖场随不同养殖季节分离菌株的药物敏感性存在差异。本试验对分离菌株的药敏结果显示,对头孢噻肟、头孢他啶、庆大霉素、妥布霉素、链霉素、卡那霉素、红霉素等敏感,而对罗红霉素、四环素、多西环素、氟苯尼考、诺氟沙星具有较强的耐药性。这与之前报道的中华绒螯蟹、黄颡鱼、鳗鲡、胭脂鱼、中华鳖等水产动物分离的维氏气单胞菌的药敏试验结果有差异。耿昕颖等对52株不同淡水鱼类维氏气单胞菌耐药表型的分析认为,52株维氏气单胞菌存在比较严重的耐药性,且不同地域分离的维氏气单胞菌菌株对常用的抗菌药物的MIC结果存在明显差异[42];汪开毓等[43]的研究认为,不同地区分离的维氏气单胞菌具有地域性差异,而同一地区分离株既存在相同基因型现象,也存在基因型多样性现象。本研究根据药物敏感试验结果,选择合适的药物在大刺鰍维氏气单胞菌病暴发期进行了临床治疗,取得了良好治疗效果。因此,不同地域、宿主、季节细菌性疾病的防治,应对病原进行药物敏感性试验,选择敏感药物,精准、科学用药,及时控制病情。
本研究对大刺鰍维氏气单胞菌病的治疗过程发现该病具有治愈期长且易反复发病的特点。这与维氏气单胞菌作为条件致病菌,广泛存在于水体及土壤之中[1]的特点相关。因此对该病应以预防为主:保持养殖水体的清洁,避免维氏气单胞菌病大量繁殖;做好大刺鰍的健康养殖,避免过密养殖造成体背部棘相互刺伤而感染病源菌等因素的发生。这样才可以尽量避免该病的发生。

