中药联合化疗对晚期胰腺癌的临床疗效及安全性研究
黄霜霜 朱佳敏 赵鹏 沈敏鹤 娄万爽 杨天兴
胰腺癌是一种高度恶性的肿瘤,预后极差,5年生存率低。据最新全球癌症数据统计,预计美国2019年将新发56 770例胰腺癌患者,而死于胰腺癌患者将达45 750例[1]。我国最新癌症数据统计显示,胰腺癌位居我国恶性肿瘤发病率第10位[2]。由于胰腺癌起病隐匿,早期无特异性临床症状及体征,大多数患者诊断时已属晚期。近年来,有越来越多的药物进入胰腺癌的临床试验,但疗效不容乐观。
晚期胰腺癌首选含吉西他滨为主的化疗方案,多数患者因机体免疫功能低下或反复化疗不能耐受不良反应,不能完成相应的西医治疗,甚至丧失治疗机会。相关研究结果表明,中药配合化疗能减轻后者不良反应并增强疗效。因此,本文对中药联合化疗在晚期胰腺癌患者中的安全性和有效性进行了探讨,现报道如下。
1 资料和方法
1.1 一般资料 回顾性分析2015年1月1日至2018年12月31日在浙江大学医学院附属第一医院(56例)、浙江省中医院(32例)住院并接受含吉西他滨方案化疗的晚期胰腺癌患者资料88例。纳入标准:(1)经病理组织学确诊的晚期胰腺癌患者,且影像学有1个及以上可以测量的病灶作为目标病灶;(2)年龄在18~75岁;(3)生存期预计在3个月以上患者;(4)心、肝、肾等功能正常,美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)制定的体力状况评分(performance status,PS)0~2 分。排除标准:(1)存在严重脏器疾病及相应功能受到严重损害者,治疗过程中存在心力衰竭、呼吸衰竭、肾功能衰竭等导致不能继续进行化疗者;(2)有严重精神疾病患者,哺乳期女性及孕妇;(3)对药物曾产生过严重的过敏性反应者或过敏性体质的患者。根据患者是否服用中药分为治疗组(44例)和对照组(44例)。两组间性别、年龄等一般资料比较差异均无统计学意义(均P>0.05),见表 1。

表1 两组患者一般情况比较(例)
1.2 方法 对照组只接受吉西他滨(江苏豪森药业股份有限公司,1.0g/支,国药准字:H20030105,1 000mg/m2,第1天、第8天静脉滴注)联合替吉奥(山东新时代药业有限公司,20mg/粒,国药准字:H20080802。根据体表面积:<1.25m2,80mg/d;1.25~1.5m2,100mg/d;>1.5m2,120mg/d;服用14d,停7d)或卡培他滨[(上海罗氏制药有限公司,0.5g/粒,国药准字:H20073024;1 250mg/(m2·d),服用 14d,停7d)]方案化疗,21d为1个周期。治疗组:在对照组的基础上配合中药治疗,中医根据辨证施治,肾虚阳亢型采用天麻钩藤饮加减,肝胃不和型采用小柴胡汤加减,肝郁脾虚型采用四逆散加减,脾胃虚弱型采用四君子汤加减,并随症加减。若腹痛、呕吐可加枳实、白芍、制半夏、干姜、苏叶、厚朴等;便秘、腹胀可加六神曲、山楂、麦芽、鸡内金、大黄等;发热可加银柴胡、知母、黄连等;黄疸、腹水可加茵陈、山栀、茯苓、泽泻等;1剂/d,水煎,早晚分服,21d为1个周期。两组均治疗4个周期。
1.3 观察指标及疗效评定标准
1.3.1 临床疗效 治疗前及4周期治疗后行CT扫描评估瘤体大小变化。参照RECIST 1.1实体瘤疗效[3]评定标准分为分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)及疾病进展(progressive disease,PD);客观缓解率(objective remission rate,ORR)指肿瘤缩小达到一定量并且保持一定时间的患者的比例,为CR+PR的病例数占可评价例数的百分比;疾病控制率(disease control rate,DCR)指经治疗后获得缓解(PR+CR)和SD的病例数占可评价例数的百分比。对患者进行生存期随访,记录患者的无进展生存期(progression free survival,PFS)及总生存期(overall survival,OS)。
1.3.2 卡氏功能状态(Karnofsky performance status,KPS)评分 采用ECOG制定的KPS评分法,两组患者在治疗前及4周期治疗后各评定1次。得分越高,表明健康状况越好,越能耐受化疗所带来的不良反应。得分越低,则健康状况越差,如<60分,则无法行化疗。好转:和治疗前相比,KPS评分能提高≥10分;稳定:和治疗前相比KPS评分未见明显差异;恶化:和治疗前相比KPS评分下降≥10分。
1.3.3 不良反应 参照世界卫生组织抗癌药物毒性反应分度标准进行判断分级记录,不良反应分为Ⅰ~Ⅳ级,观察两组治疗过程中Ⅲ/Ⅳ级不良反应反生例数,主要包括骨髓抑制、胃肠道反应、肝肾功能损害、皮疹。
1.4 统计学处理 采用SPSS 24.0统计软件。计量资料采用表示,组间比较采用独立样本t检验,组内比较采用配对样本t检验;等级资料采用秩和检验或χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的临床疗效比较 见表2。
由表2可见,两组患者的临床疗效(CR、PR、SD、PD所占比例)比较差异均无统计学意义(Z=0.606,P>0.05),两组ORR和DCR比较,差异亦均无统计学意义(均P>0.05)。
2.2 两组患者的PFS和OS比较 治疗组和对照组的中位 PFS分别为 6.7个月(95%CI:5.5~7.9)和 5.6个月(95%CI:3.3~7.9),两组比较差异有统计学意义(P<0.05)。治疗组和对照组的中位OS分别为10.9个月(95%CI:9.2~12.6)和 10.2 个月(95%CI:9.6~10.8),两组比较差异无统计学意义(P>0.05)。详见图1、2。
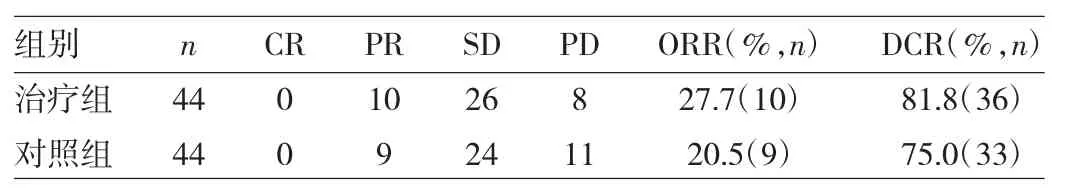
表2 两组患者的临床疗效比较(例)
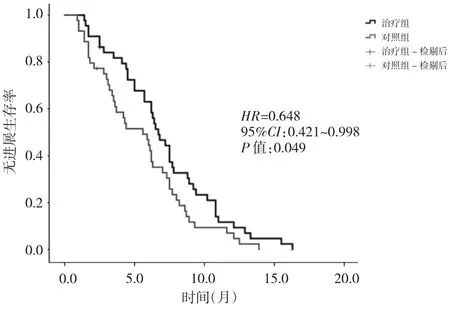
图1 两组患者的P F S比较
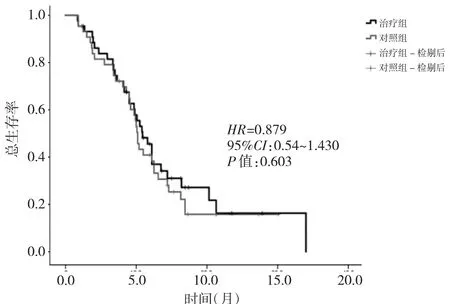
图2 两组患者的O S比较
2.3 两组患者的KPS评分比较 见表3。

表3 两组患者K P S评分比较[例(%)]
由表3可见,治疗组KPS评分好转例数明显多于对照组(P<0.05)。
2.4 两组患者Ⅲ/Ⅳ级不良反应比较 见表4。
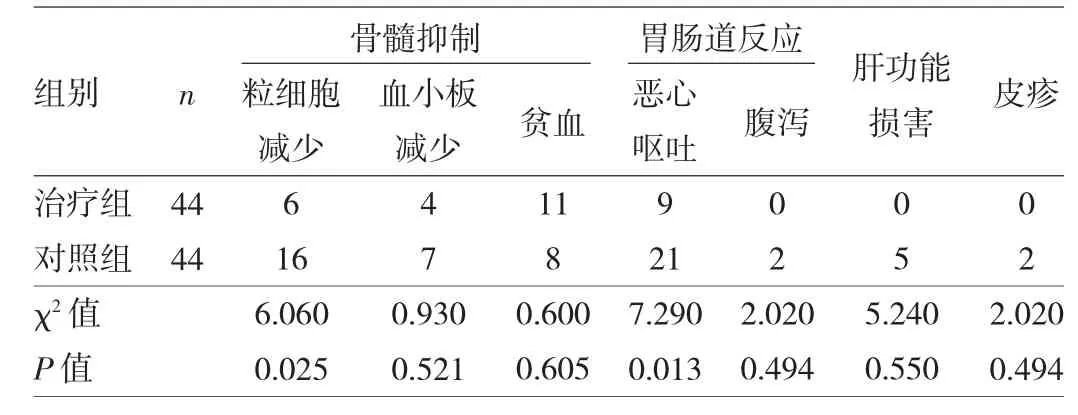
表4 两组之间Ⅲ/Ⅳ级不良反应比较(例)
由表4可见,治疗组粒细胞减少、胃肠道反应、皮疹的发生率均显著低于对照组(均P<0.05)。
3 讨论
当前西医治疗晚期胰腺癌的方法仍不理想,尽管近年来免疫治疗、靶向治疗等成为热门,但尚未取得可观的疗效,因此,化疗仍是晚期胰腺癌的主要选择。晚期胰腺癌的化疗方案以吉西他滨单药,吉西他滨联合替吉奥或白蛋白紫衫、卡培他滨等为主[4]。一项随机对照Ⅲ期临床研究表明,吉西他滨联合替吉奥组的OS为10.1个月,吉西他滨组为 8.8个月[5]。另一项三期临床研究将533例晚期胰腺癌患者随机分为吉西他滨单药组和吉西他滨联合卡培他滨组,联合组显著提高了ORR(19.1%比 12.4%,P<0.05)和 PFS(HR=0.78,P<0.01),OS也有延长趋势[6]。本研究纳入病例选用含吉西他滨的方案联合化疗,对比吉西他滨单药能提高患者PFS和ORR。化疗虽能提高患者的PFS,或延长OS,但同时带来的不良反应也不容小觑。一项研究纳入342例患者,分别采用奥沙利铂、伊立替康加氟尿嘧啶三药方案对比吉西他滨单药方案化疗,三药组的OS为11.1个月、PFS为6.4个月、ORR 31.6%,吉西他滨组OS为6.8个月、PFS为3.3个月、ORR 9.4%(均P<0.01)[7]。但三药组出现更多不良事件,患者的生活质量下降明显。因此临床医生期待出现全面综合的治疗,最大程度地控制肿瘤进展,使晚期胰腺癌患者得到最大的临床获益。值得注意的是,相关的研究结果表明,在胰腺癌患者的治疗中,中医药表现出明显的优势。巩天晓等[8]采用吉西他滨联合白蛋白紫杉醇化疗方案联合“抑癌散结汤”治疗66例胰腺癌患者,结果发现联合组KPS评分改善情况较对照组提高21.21%,且能减少化疗不良反应,降低肿瘤标志物水平(均P<0.05)。韩俊等[9]以“清胰化积汤”联合动脉灌注化疗治疗106例中晚期胰腺癌,证明联合组有效率(81.13%)高于对照组的60.38%,联合组临床获益率(64.15%)高于对照组的41.51%(P<0.05)。这也给本研究提供了一定的基础。
本研究通过回顾性分析88例晚期胰腺癌患者,进一步评估中医辨证治疗晚期胰腺癌的安全性和有效性。本研究显示,中医辨证治疗在改善晚期胰腺癌的临床疗效不明显,可能由于病例数不足、研究周期过短。治疗组中位PFS延长1.1个月,OS延长0.7个月。中医辨证治疗组虽然对晚期胰腺癌的OS改善不明显,但能显著改善患者PFS。两组患者不良反应、严重不良事件发生率相近,并未发现中医辨证组治疗相关的死亡事件。统计分析各项不良反应发生例数,治疗组Ⅲ/Ⅳ级不良反应包括血小板减少、肝功能损害均少于对照组,但P>0.05,考虑可能与纳入病例数不足有关。由此可见,中药能减轻化疗的不良反应,提升患者的耐受性,且疗效安全。两组经治疗后通过分析比较KPS评分,前者明显高于后者(P<0.05),说明治疗组在改善晚期胰腺癌患者KPS评分上明显优于对照组,可见联合中药组能减轻化疗不良反应,提高化疗耐受性,从而改善患者KPS评分。
综上所述,中药联合以吉西他滨为主的化疗方案治疗晚期胰腺癌,能显著改善患者KPS评分,减轻化疗不良反应,延长PFS,且耐受性好,疗效安全,值得临床进一步推广。尽管如此,仍存在一些问题:本课题由于时间较短,仅纳入88例临床观察病例,因此结果极有可能存在一定偏差,在以后的工作中需扩大样本量,完善研究;再者,本课题由于条件和时间的限制,部分患者未随访到研究终点,可能对OS和PFS的分析结果造成一定的差异,且只评估了患者的临床疗效、不良反应等情况,未行合理有效的动物实验,缺乏分子机制研究。故笔者认为应提高中药在肿瘤中的治疗地位,不应仅限于减轻放化疗的不良反应及姑息治疗,同时应加强中药的临床应用及分子机制研究。

