连麦系列及部分澳麦品质性状相关基因的分子检测
张广旭 孙中伟 王康君 郭明明 李强 陈凤 樊继伟

摘要 小麦品质性状是由多个位点控制的数量性状。为明确连云港市农业科学院选育的112份新品系及引进的16份澳大利亚种质资源品质基因分布情况,利用主要HMW-GS(Bx7、By8、By9和Dx5)、抗穗发芽(Vp1B3)、黄色素质量YP7A及1B/1R的特异性标记进行分子检测。结果显示,共检测到56种品质基因组合类型,供试材料基因组合丰富多样。连麦A1731检测到含有6个优异品质基因及非1B/1R易位系;检测到含有Dx5及多个HMW-GS基因且非1B/1R易位系材料29份;利用分子标记检测技术手段可助力连云港市农业科学院优质小麦新品种选育及种质资源筛选,从而提高连云港市农业科学院小麦品质育种新步伐。
关键词 小麦;品质性状;分子标记
中图分类号 S512文献标识码 A
文章编号 0517-6611(2019)20-0037-04
doi:10.3969/j.issn.0517-6611.2019.20.011
开放科学(资源服务)标识码(OSID):
Molecular Detection for Quality Traits Related Genes in Lianmai Series and Australian Wheat Varieties
ZHANG Guang xu,SUN Zhong wei,WANG Kang jun et al(Institute of Lianyungang Agricultural Science of Xuhuai Area/Lianyungang Institute of Agricultural Sciences,Lianyungang,Jiangsu 222000)
Abstract Wheat quality traits are quantitative traits controlled by multiple loci.In order to clarify the 112 new lines selected by the author and the distribution of 16 Australian germplasm quality genes,the main HMW GS (Bx7,By8,By9 and Dx5),anti ear germination (Vp1B3),yellow pigment quality YP7A And 1B/1R specific markers for molecular detection.A total of 56 gene type combinations were detected.Lianmai A1731 detected 6 excellent quality genes and non 1B/1R translocation lines; at least Dx5 and multiple HMW GS genes were detected and did not contain 1B/1R 17 parts of translocation material; functional molecular marker detection can help the author to select high quality wheat varieties,which is expected to improve the new pace of wheat quality breeding in the author.
Key words Wheat; Quality characters; Molecular markers
连麦系列品种的选育为江苏省淮北区域全国麦区及高产稳產、品优及抗逆发挥了重要作用,早熟品种连麦7号被评为“江苏好品种”,同时为稻茬晚播早熟小麦品种提供了保障[1]。前人对已育成的连麦系列品种的选育过程及形态特征等方面进行了较多系统研究[2-7],但整体研究其小麦品质方面的报道较少。小麦的品质形成及加工产品的优质是受多个基因位点控制的数量性状且易受环境影响。高分子量谷蛋白亚基(HMW-GS)对小麦面筋形成及质量具有决定性作用,进而会影响到加工产品的优劣。HMW-GS对小麦的面团特性和面筋强度发挥着重要作用,并且不同类别的HMW-GS组合对小麦品质改良的贡献各异[8-10]。HMW-GS主要受基因Glu-A1、Glu-B1和Glu-D1等不同基因型组合所控制编码,Glu-A1位点上Ax2*亚基优于Null亚基编码;Glu-B1位点主要由Bx7、By8、By9或Bx17、By18的基因组合,这些组合比其他亚基组合优越;Glu-D1位点上的Dx5与Dy10基因组合对加工产品具有较大促进作用,Dx5与Dy10紧密连锁可利用Dx5标记准确快速的检测和判断小麦品种中是否含有Dx5+Dy10[11]。含有1B/1R易位小麦品种的面筋质量下降,因其易位系上含有编码黑麦碱蛋白会导致面粉吸水量增加、面团黏性增大,从而造成加工品质变劣[9,12-13];近年极端天气时有发生,小麦在成熟期常遇阴雨天气便会造成穗发芽。穗发芽使小麦产量降低和品质变差,使小麦籽粒的淀粉水解,进而降低面筋强度,最终使得面条的韧性和弹性变差。Vp-1B3对控制胚成熟和休眠发挥重要作用,是与穗发芽密切相关的主要基因之一[14]。对小麦加工面制品来说,使用亮度好和低黄色素质量分数小麦面粉对成品的良好外观起到关键作用,研究和选育低黄色素质量分数的新品种是改良成品主要途径,在7A染色体的Psy-A基因位点对低黄色素质量分数贡献较大,标记YP7A与其紧密连锁,能有效区分出控制高、低黄色素质量分数的等位基因[15-16]。如今,许多小麦科研工作者已开发出多种基于上述基因内部等位基因差异的功能标记[17-22],这些分子标记能够初步检测品质相关基因组成。国内很多小麦育种单位已选育出较多品质优良品种。根据《2018年度中国小麦质量状况报告》,2018年度生产上品质表现好品种有山农26、济麦229、新麦26、藁优5218、龙麦60、中优578、西农511、伟隆169共8个强筋小麦品种,对国内优质小麦市场发挥重要作用。为进一步加速连云港市农业科学院品质育种进程及了解连云港市农业科学院新育成的品系品质情况,为后续的遗传育种和生产应用方面提供理论支撑,连云港市农业科学院选育了112份小麦新品系及16份澳大利亚品种资源,利用重要HMW-GS(Bx7、By8、By9和Dx5)的基因位点标记、抗穗发芽(Vp1B3)基因位点标记、黄色素质量YP7A及1B/1R的特异性标记进行连麦系列及部分澳麦分子检测,分析了连云港市农业科学院育成品系中所含相关品质基因的种类及分布情况,为连云港市农业科学院小麦品质育种提供有价值的遗传信息,从而加快品质育种选育进程。
1 材料与方法
1.1 供试材料
供试材料为112份连云港市农业科学院自主选育的高世代(F6:7)稳定品系和引进的澳大利亚种质资源16份。2017—2018年,在连云港市农业科学院小麦育种基地种植128份供试材料并建穗行谱繁种,成熟时收获。
1.2 基因组DNA的提取
供试材料在穗行谱收获的种子中选取3粒发芽,7 d后选取每份材料新鲜幼嫩的幼苗,利用SDS法提取小麦总基因组DNA,利用NanoDrop 2000超微量紫外分光光度计检测DNA质量,进而进行相关品质基因位点的检测,并依据检测结果确定供试材料所含有基因型。
1.3 PCR 扩增及电泳检测
根据已发表的小麦与品质特性相关的主要基因(Bx7、By8、By9、Dx5、Vp1B3、YP7A及1B/1R),引物均由擎科生物(南京)合成。以上所列特异分子标记与品质相关基因的相应引物名称、序列及其他相关信息见表1。聚合酶链式反应在 Eppendorf nexus GSX1 PCR仪中进行扩增,目的基因相对的PCR反应相关程序采用表1
参考文献方法进行。用琼脂糖凝胶电泳检测扩增产物,凝胶浓度为1%,电極溶液为1×TAE缓冲溶液,并在120 V恒压下进行电泳30 min。利用国产凝胶成像系统与设备扫描成像并进行结果统计分析。
2 结果与分析
2.1 供试小麦材料中部分HMW-GS的分布
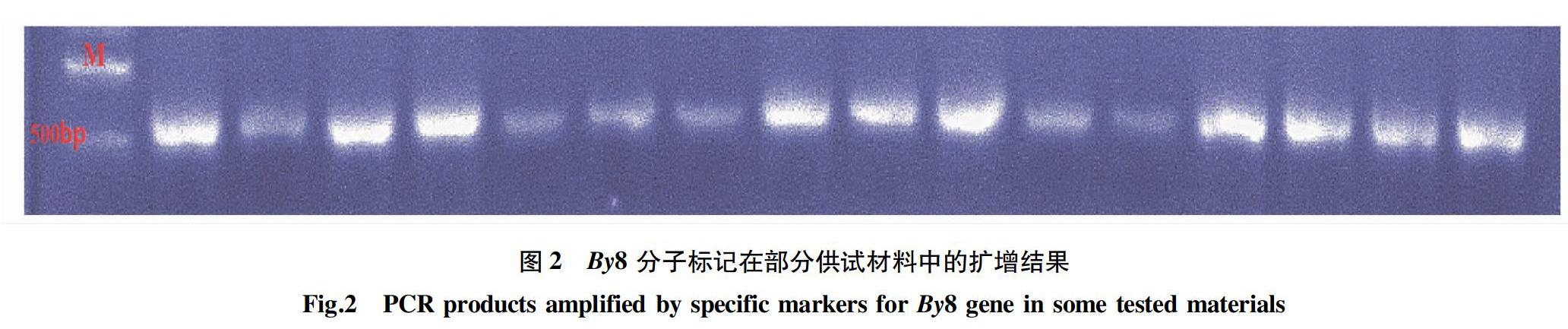
利用HMW-GS部分特异标记检测可以快速推断该材料是否含有该亚基。在Glu-B1位点,标记Bx7可扩增出两种目的条带如图 扩增出669 bp的供试材料含有Bx17,同时可以扩增出来630和766 bp共2条带型的供试材料含有Bx7亚基;By8特异性标记在供试材料中如扩增出527 bp目的条带如图2,则该材料含By8亚基;By9的标记标可以同时扩增出707和662 bp共2条目的类型,但是只有扩增出662 bp的目的条带材料含By9材料(图3);在Glu-D1位点,标记Dx5在含有该目的亚基的品种中可扩增出目的条带为450 bp(图4)。经统计结果分析,128份供试材料中含By9亚基材料数最多为74份,占总检测材料的57.81%,其中包含连麦系列材料59份,澳大利亚材料15份;其次为Dx5亚基,共计53份占总检测材料的41.41%,其中连麦系列46份,澳大利亚材料7份;在供试材料都检测到65份含有Bx7或By8,占总检测品系百分率50.78%;其中含有By7的65份材料均为连云港市农业科学院自主选育的,含有By8的材料包含连麦系列60份,澳大利亚材料5份;含Bx17材料15份,占总检测材料的11.72%,其中包含连麦系列9份材料,澳大利亚材料6份。
2.2 1B/1R易位系的分布
利用1B/1R易位系的特异性标记对128份供试材料进行检测,含1B/1R易位系的材料可扩增出1 500 bp的目的条带,条带类型如图5。含有1B/1R易位系共检测出38份,占所有检测材料的29.69%,均为连云港市农业科学院自主选育新品系;澳大利亚材料未检测到含有1B/1R易位系的材料。
2.3 抗穗发芽基因检测
穗发芽共显性STS功能标记Vp1B3可扩增出849、569或652 bp的3种目的条带类型,其结果分别表示含有Vp1Bb和Vp1Bc抗穗发芽基因型及Vp1Ba易感穗发芽基因型。通过分子检测共有78份材料扩增出目的条带569 bp,含有抗穗发芽基因Vp1Bc,占供试材料的60.94%,其中连云港市农业科学院自主选育62份,澳大利亚16份材料均含有抗穗发芽基因;未检测到Vp1Bb(849 bp)。共有26份材料检测出含有感穗发芽基因型Vp1Ba(652 bp),其中连麦系列24份,占连云港市农业科学院自主选育品系的18.75%。
2.4 黄色素含量
YP7A是判定黄色素水平的主要关键基因位点,主要与八氢番茄红素合成酶(PSY)的PSYA1基因有关,利用该标记可扩增出194和231 bp大小的片段,分别代表高黄色素含量等位基因PSY-A1a和低黄色素含量等位基因PSY-A1b(图6)。通过利用该特异标记对材料检测,在128份材料中共检测到26份低黄色素PSY-A1b材料,占供试材料的20.36%,其中连麦系列21份,澳大利亚材料7份;共检测到102份含高黄色素PSY-A1a材料,占供试材料的79.69%,其中连麦系列93份,澳大利亚材料9份。
2.5 供试材料的品质基因型分析
含HMW-GS基因Bx7、By8、By9、Dx5及抗穗发芽基因Vp-1Bc、低黄色素含量等位基因Psy-A1b和非1B/1R易位系对小麦品质及加工产品具有正向促进作用,有利于提高小麦的面筋强度和改善面条、馒头等面制品的颜色。统计结果分析显示,128份供试材料共有56种基因类型组合。连麦A1731是唯一检测到同时含有6个优异品质基因及非1B/1R易位系的小麦新品系,该品系作为优质特色小麦进行小麦参试同时可作为优质育种的亲本。含有Dx5优质亚基面筋的小麦面筋强度大,其贡献大于其他几个亚基,检测到含有Dx5及多个HMW-GS基因且非1B/1R易位系材料28份(不包含连麦17A31),共计16种基因组合类型;连麦A1779、连麦A17107和AU7共3份材料含抗穗发芽基因Vp1Bc和低黄色素含量等位基因Psy-A1b,比其他24份材料优异;连麦A1728含低黄色素含量等位基因Psy-A1b,但其也含有穗发芽敏感基因Vp1Ba,易发生穗发芽;经主要优异品质基因检测,连麦系列共计检测到22份材料在品质基因方面较为突出,占供试总材料的19.64%,具有多种优异品质基因的材料比例相对较小,这些优异品系可作为品质育种方向材料种质及推荐品系参试;澳大利亚7份材料含优异品质基因较多且整体不含1B/1R易位系。
3 讨论
3.1 功能标记助力品质育种
近年来为适应国内对优质小麦的需求,国内许多育种单位已经在注重产量的基础上更注重品质的改良,连云港市农业科学院也加大加速了品质育种进程。芦静等[23]对高分子量谷蛋白亚基PCR 检测结果与SDS-PAGE 电泳结果进行比较,吻合率都在95%左右,采用基因特异性标记可快速鉴别小麦品质并进行分子标记辅助选;白升升等[24]研究证明,分离胶浓度为8.5%的SDS-PAGE与HMW-GS分子标记方法相结合鉴定的方法更加准确。马红勃等[25]认为基于该基因的功能性PCR技术不受环境和发育期的限制,比SDS-PAGE和化学检测更方便、准确、可靠。根据前人研究结果和结合当下实际情况,笔者认为相对于SDS-PAGE,采用功能性标记作为品质辅助手段更快捷,如需进一步深入挖掘研究品质特性等可以两者结合,并对其加工产品进行更深一步探索。
3.2 品质基因及其组合分布情况
该研究采用的7个特异性标记在供试材料中均检测出,单个基因在材料中检测到除PSY-A1b外比例都较高,但其优异组合类型较少。优质亚基Dx5可增强小麦品种面筋强,改善面筋质量,但1B/1R易位系的引入对小麦品质有极显著的负面影[26],该研究共检测到29份含有Dx5且不含1B/1R易位系材料,占供试材料的25.89%,比例相对较低,原因在于连云港市农业科学院早期更关注丰产性和抗病性,对品质相关方面研究较少,同时对含有1B/1R易位系材料在未来品质育种对该部分材料应慎用。在供试材料中只检测到Vp1Bc未检测到含抗穗发芽Vp1Bb基因材料,需引进新的种质资源提高小麦穗发芽抗性。小麦品质是一个复杂的网络机制,小麦含有优质基因但对其加工产品及用途还需进一步探索。下一步应将筛选出来的几份优异品系进行面包、馒头和面条等产品的加工与评价,为优质专用小麦筛选奠定基础。
4 结论
利用主要HMW-GS(Bx7、By8、By9和Dx5)、抗穗发芽(Vp1B3)、黄色素质量YP7A及1B/1R的特异性标记进行分子检测,共检测到56种基因类型组合,供试材料基因组合丰富多样。连麦A1731检测到含有6个优势品质基因及非1B/1R易位系的優质小麦新品系;检测到至少含有Dx5及多个HMW-GS基因且不含1B/1R易位系材料28份;连麦A1779、连麦A17107和AU7 共3份材料含抗穗发芽基因Vp1Bc和低黄色素含量等位基因Psy-A1b。连麦系列共计检测到25份材料在优异品质基因方面较为突出且对穗发芽具有一定抗性。澳大利亚7份材料在品质优质基因方面较为突出且整体不含1B/1R易位系。连云港市农业科学院在小麦品质育种与品质系统研究方面进度较缓慢,其自主选育主要品系及种质资源的主要品质基因分布、组成尚不明确,通过分子标记辅助可快速、简便、助力选育优质小麦新品种,有望提高小麦品质育种新步伐。
参考文献
[1] 张广旭,孙中伟,李强,等.连麦系列小麦系谱分析及育种启示[J].安徽农学通报,2018,24(8):33-34,86.
[2] 李筠,王龙,秦德荣,等.优质丰产小麦新品种——连麦2号[J].麦类作物学报,2006,26(3):170.
[3] 任立凯,王龙,李筠,等.优质高产小麦新品种——连麦6号[J].麦类作物学报,2013,33(6):1316.
[4] 任立凯,王龙,李筠,等.高产稳产小麦新品种——连麦7号[J].麦类作物学报,2016,36(9):1269.
[5] 李筠,王龙,晁林海,等.国审小麦连麦2号丰产性、稳产性及适应性分析[J].安徽农业科学,2007,35(29):9191-9193.
[6] 孙中伟,张产端,何峰,等.连麦6号特征特性及高产栽培技术[J].农业科技通讯,2015(12):229-230.
[7] 王康君,樊继伟,陈凤,等.优质丰产抗逆小麦新品种连麦7号的选育过程及高产栽培技术[J].现代农业科技,2018(24):23,32.
[8] LIU L,HE Z H,YAN J,et al.Allelic variation at the Glu 1 and Glu 3 loci,presence of the 1B.1R translocation,and their effects on mixographic properties in Chinese bread wheats[J].Euphytica,2005,142(3):197-204.
[9] 刘建军,何中虎,PENA R J,等.1BL/1RS易位对小麦加工品质的影响[J].作物学报,2004,30(2):149-153.
[10] PAYNE P I.Genetics of wheat storage protein and the effect of allelic variation on bread making quality[J].Annu Rev Plant Physiol,1987,38:141-153.
[11] BRANLARD G,DARDEVET M,SACCOMANO R,et al.Genetic diversity of wheat storage proteins and bread wheat quality[J].Euphytica,2001,119(1/2):59-67.
[12] 李式昭,伍玲,郑建敏,等.优质面条商品小麦澳白麦相关品质基因的分子标记鉴定[J].中国农业科学,2012,45(18):3677-3687.
[13] 刘丽,周阳,何中虎,等.Glu-1和Glu-3等位变异对小麦加工品质的影响[J].作物学报,2004,30(10):959-968.
[14] 苗西磊,王德森,夏兰芹,等.白粒小麦品种(系)穗发芽抗性机制分析[J].麥类作物学报,2016,31(4):741-746.
[15] 杨芳萍,何心尧,何中虎,等.中国小麦品种黄色素含量基因等位变异分子检测及其分布规律研究[J].中国农业科学,2008,41(10):2923-2930.
[16] HE X Y,ZHANG Y L,HE Z H,et al.Characterization of phytoene synthase 1 gene (Psy1) located on common wheat chromosome 7A and development of a functional marker[J].Theoretical & applied genetics,2008,116(2):213-221.
[17] MA W,ZHANG W,GALE K R.Multiplex PCR typing of high molecular weight glutenin alleles in wheat[J].Euphytica,2003,134(1):51-60.
[18] LEI Z S,GALE K R,HE Z H,et al.Y type gene specific markers for enhanced discrimination of high-molecular weight glutenin alleles at the Glu B1 locus in hexaploid wheat[J].Journal of cereal science,2006,43(1):94-101.
[19] D′OVIDIO R,ANDERSON O D.PCR analysis to distinguish between alleles of a member of a multigene family correlated with wheat bread making quality[J].Theoretical & applied genetics,1994,88(6/7):759-763.
[20] YANG Y,ZHAO X L,XIA L Q,et al.Development and validation of a Viviparous 1 STS marker for pre harvest sprouting tolerance in Chinese wheats[J].Theoretical & applied genetics,2007,115(7):971-980.
[21] ZHAI S N,LI G Y,SUN Y W,et al.Genetic analysis of phytoene synthase 1 (Psy1) gene function and regulation in common wheat[J].BMC Plant Biology,2016,16(1):1-15.
[22] FRANCIS H A,LEITCH A R,KOEBNER R M.Conversion of a RAPD generated PCR product,containing a novel dispersed repetitive element,into a fast and robust assay for the presence of rye chromatin in wheat[J].Theor Appl Genet,1995,90(5):636-642.
[23] 芦静,何中虎,夏先春,等.新疆小麦品种高分子量谷蛋白亚基及相关品质基因的分子标记检测[J].作物学报,2009,35(4):647-661.
[24] 白升升,马丽,王晓龙,等.SDS-PAGE与分子标记相结合分析宁夏小麦HMW-GS组成与变化特点[J].麦类作物学报,2015,35(12):1658-1663.
[25] 马红勃,刘东涛,冯国华,等.部分小麦品种(系)品质相关基因的分子检测[J].麦类作物学报,2016,35(6):768-776.
[26] 刘丽,周阳,刘建军,等.Glu 1和Glu 3等位变异及 1BL/1RS 易位与面包和面条品质关系的研究[J].中国农业科学,2004,37(9):1265-1273.

