气相色谱-串联质谱法测定塑料儿童玩具中15种N-亚硝胺残留量
刘雅慧,袁文峰,王志娟,张 庆,白 桦,吕 庆
(中国检验检疫科学研究院,工业与消费品安全研究所,北京 100176)
N-亚硝胺是一类具有—N—N=O结构的有机污染物,在人们研究的300多种N-亚硝胺中,90%以上对动物具有致癌作用[1]。国际癌症研究署(IARC)将N-亚硝基二甲胺(NDMA)和N-亚硝基二乙胺(NDEA)列为2A类致癌物,将N-亚硝基二丙胺(NDPA)、N-亚硝基甲基乙基胺(NMEA)、N-亚硝基吗啉(NMOR)、N-亚硝基吡咯(NPYR)、N-亚硝基哌啶(NPIP)和N-亚硝基二丁胺(NDBA)列为2B类致癌物[2]。N-亚硝胺的前体物是指在一定条件下能够生成N-亚硝胺的物质,包括亚硝酸盐、仲胺和氮氧化合物[3],这些前体物可被用作橡胶和塑料的强度和弹性添加剂[4]。欧盟玩具安全标准EN 71—12:2016[5]规定:供36个月以下儿童使用的拟打算或可能放入口中使用的玩具中N-亚硝胺迁移量≤0.01 mg/kg,N-亚硝胺前体物迁移量≤0.1 mg/kg;其余玩具(除指画颜料中N-亚硝胺迁移量≤0.02 mg/kg外)中N-亚硝胺迁移量≤0.05 mg/kg,N-亚硝胺前体物迁移量≤1.0 mg/kg。美国华盛顿州儿童高关注化学品清单(CHCC)中规定了NDMA的限量为1.0 mg/kg[6]。
N-亚硝胺在食品、饮用水、化妆品中的检测报道较多[7-9]。在儿童用品方面,研究者更多关注于奶嘴、气球等弹性体,塑料玩具中N-亚硝胺的检测方法则少有报道,已报道的方法多是研究N-亚硝胺迁移量。例如,Altkofer等[10]采用气相色谱-热能分析仪法(GC-TEA)测定气球中8种N-亚硝胺迁移量;Anna等[4]采用气相色谱-超声分子束电子电离质谱法测定奶嘴中14种N-亚硝胺迁移量;Sung等[11]采用液相色谱-串联质谱法测定奶嘴中8种N-亚硝胺迁移量;黄理纳等[12]采用高效液相色谱-大气压化学电离-串联质谱法测定与口接触玩具及儿童用品中14种可迁移N-亚硝胺及其前体物。目前尚未见玩具中N-亚硝胺残留量测定方法的报道。
塑料是儿童玩具使用最广泛的材料,其中以丙烯腈-丁二烯-苯乙烯(ABS)和聚氯乙烯(PVC)材质最为常见。对于塑料样品来说,采用常规的顶空、热解吸等方法通常仅能测定物质的挥发量;针对残留量测定常见的方法有超声提取、微波萃取、索式提取、加速溶剂萃取等,其中,超声提取和微波萃取难以保证提取率,索氏提取耗时较长且消耗大量有机溶剂,加速溶剂萃取在优化条件下的溶剂消耗少且能够实现较高的提取率,然而在高温高压下,塑料样品可能会发生溶解或膨胀,导致管道堵塞等问题。Garrigós等[13]、Al-Natsheh等[14]、吴莉莉等[15]对比了多种提取方法对塑料样品中目标物的提取效果,结果表明,溶解-沉淀法的提取率最优,且操作简便、污染小、成本低。塑料样品经溶解-沉淀后,基质提取液的色素等杂质较多,需经固相萃取净化以减少基质干扰,同时保护仪器。气相色谱-串联质谱(GC-MS/MS)的选择性及灵敏度较高,抗基质干扰能力强,与溶解-沉淀法结合可以省去净化过程,实现快速准确地检测。
本研究拟采用溶解-沉淀法结合GC-MS/MS测定塑料儿童玩具中15种N-亚硝胺的残留量。考察方法的选择性、溶剂效应和基质效应,以及自制阳性样品溶解-沉淀法的提取率,并将该方法应用于实际玩具样品的检测。
1 实验部分
1.1 仪器与试剂
TSQ 8000 Evo气相色谱-串联质谱仪:美国Thermo Fisher公司产品;SPEX 6875液氮冷冻研磨机:美国SPEX Sample Prep公司产品;P300H超声清洗机:德国Elma公司产品;CR 21N型高速冷冻离心机:日本Hitachi公司产品。
15种N-亚硝胺标准品:纯度均大于95%,分别购自日本TCI公司、德国Dr. Ehrenstorfer公司和美国Sigma公司;甲醇、丙酮:均为色谱纯,美国Fisher公司产品;四氢呋喃:色谱纯,韩国Duksan公司产品;尼龙66滤膜(0.22 μm):天津津腾公司产品。
1.2 标准溶液的配制
标准溶液:称取各50 mg物质标准品,用甲醇溶解并定容于50 mL容量瓶,配制成1 000 mg/L的单标储备液。移取适量的单标储备液,分别以甲醇、甲醇-丙酮(7∶3,V/V)和甲醇-四氢呋喃(7∶3,V/V)为溶剂,配制成3种10 mg/L混标储备液,4 ℃避光保存。使用时根据需要稀释至相应浓度的混合工作溶液。
空白基质标准溶液:空白塑料样品按1.3节步骤处理后,得到空白基质提取液,根据需要将混标储备液稀释成空白基质标准工作溶液,现用现配。
此外,分别以丙酮、四氢呋喃为溶剂配制50 mg/L的N-亚硝胺混合标准溶液,用于ABS和PVC塑料阳性样品的制备。
1.3 样品前处理
将玩具样品液氮冷冻粉碎至粒径小于1 mm,称取0.1 g样品于10 mL具塞玻璃瓶中,加入3 mL溶剂(向ABS样品中加入丙酮,向PVC样品中加入四氢呋喃)后,超声2 min,使样品充分溶解,然后缓慢加入7 mL甲醇,使塑料基质完全沉淀,在4 ℃下,以13 000 r/min离心5 min,取上层清液,经0.22 μm滤膜过滤,上机测定。
1.4 阳性样品制备
ABS阳性样品:称取5 g空白样品至三角瓶中,先加入15 mL丙酮,再加入2 mL 50 mg/L的15种N-亚硝胺的丙酮混合标准溶液,不断搅拌,然后加入3 mL丙酮,继续搅拌至塑料样品恰好完全溶解,混合均匀,将溶液平铺在大表面皿中,置于通风橱内自然风干,得到N-亚硝胺含量为20 mg/kg的ABS阳性样品。
PVC阳性样品:以四氢呋喃代替丙酮,以四氢呋喃混合标准溶液代替丙酮混合标准溶液,其余同ABS阳性样品。
1.5 实验条件
1.5.1色谱条件 DB-17MS色谱柱(30 m×0.25 mm×0.25 μm);载气为高纯氦气(≥99.999%),载气流速1.0 mL/min;脉冲不分流进样,脉冲压力200 kPa,脉冲时间1 min;进样体积1 μL;进样口温度270 ℃;程序升温:初始温度50 ℃,保持1 min,以8 ℃/min升至150 ℃,然后以20 ℃/min升至280 ℃,保持5 min。
1.5.2质谱条件 EI电离源;电离能量70 eV;离子源温度300 ℃,传输线温度280 ℃;溶剂延迟3 min;扫描模式为多反应监测模式(SRM)。
2 结果与讨论
2.1 色谱、质谱条件的优化
已报道的用于N-亚硝胺分离的色谱柱主要有弱极性的HP-5MS[16],中等极性的DB-35MS[17]、DB-624[1]、DB-1701[18],以及强极性的DB-WAX[19]。本研究考察了中等极性且具有较高热稳定性的DB-17MS色谱柱,结果表明,15种N-亚硝胺色谱峰的峰型尖锐对称,且大多基线分离,对于个别共流出色谱峰(如9/10)能够通过提取特征离子对对其进行有效分离,且不影响定性和定量分析。
对15种N-亚硝胺进行质谱全扫描,选取2~3个特征离子作为母离子,分别在10、20、30 eV的碰撞能量下进行子离子扫描,选择碎片强度较大的二级碎片离子研究最佳碰撞能量,利用仪器的自动优化SRM离子对(Auto SRM)辅助功能最终确定了定量和定性离子对以及最优碰撞能量。15种N-亚硝胺的色谱、质谱参数列于表1,典型的SRM色谱图示于图1。
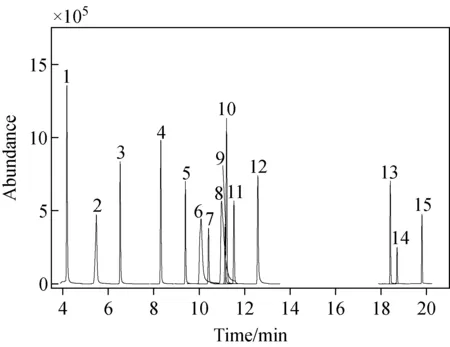
注:各物质编号与表1中一致图1 15种N-亚硝胺的典型色谱图Fig.1 Typical chromatogramof 15 kinds of N-nitrosamines
2.2 方法的选择性考察
塑料样品基质较为复杂,经过溶解-沉淀提取后,采用C18[20]、石墨化碳[11]等SPE柱进行净化,增加了前处理步骤以及检测成本;也有不 经净化直接进样的报道[14,21],本研究将对此进行考察。在全扫描模式下,ABS塑料样品提取液的色谱图有较多杂峰且响应强度较大,示于图2a;同一提取液在串联质谱的SRM模式下,背景较为干净,杂质峰并未对N-亚硝胺的检测产生干扰,示于图2b。此外,在经过200次以上进样后发现,仅有极少量的色素等杂质残留在衬管中,可能是由于该类色素沸点较高,滞留于衬管且未发生分解,但未对检测产生明显影响。在SRM扫描模式下,所有待测物质均在20 min以内出峰,20.2 min以后质谱灯丝关闭,故在20.2 min之后出现的杂质峰不会影响灯丝的使用寿命。GC-MS/MS具有较强的抗基质背景干扰能力,省去了基质净化过程,从而使该方法更加简便、快速、节约成本。
2.3 溶剂效应和基质效应
本实验进一步考察了溶剂效应和基质效应对N-亚硝胺检测结果的影响。分别对甲醇、甲醇-丙酮(7∶3,V/V)混合溶剂、甲醇-四氢呋喃(7∶3,V/V)混合溶剂、3种ABS空白基质提取液和3种PVC空白基质提取液配制的浓度均为50 μg/L的15种N-亚硝胺混标在同一条件下进行测定,重复6次,对比目标物质在相同浓度下的响应值,选取具有代表性的7种物质进行绘图,结果示于图3。可见,采用甲醇-丙酮混合溶剂与纯甲醇溶剂的响应较为接近,少数物质(如NMPhA、NDBA)略低于甲醇溶剂。采用 甲醇-四氢呋喃混合溶剂对NMPhA、NEPhA具有明显的抑制效应,而对于NMEA、NMOR和NDBA具有明显的增强效应,表明四氢呋喃溶剂对N-亚硝胺检测的影响较为显著。
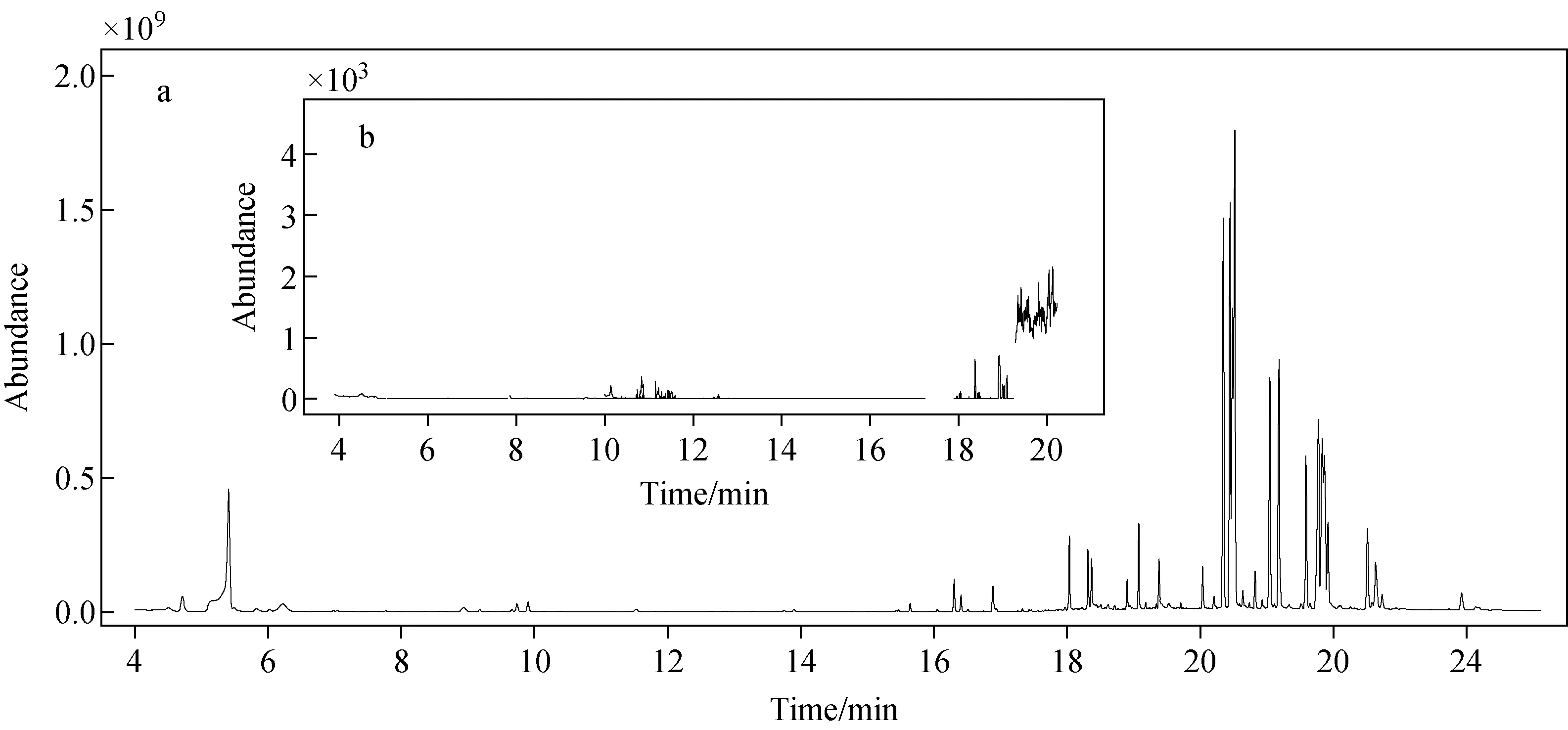
图2 在全扫描模式下,ABS玩具样品的色谱图(a)和SRM模式下同一样品的色谱图(b)Fig.2 Chromatograms of an ABS sample under the full scan mode (a) and the same sample under the SRM mode (b)
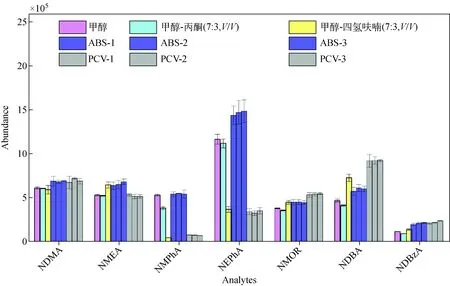
图3 溶剂效应和基质效应对N-亚硝胺响应值的影响(n=6)Fig.3 Effect of solvent effect and matrix effect on the peak area of N-nitrosamines (n=6)
采用空白基质提取液配制的混标对N-亚硝胺具有不同程度的基质增强或抑制作用,如NDMA、NMOR和NDBA等物质,两种塑料基质对其均具有一定的增强作用;对于NEPhA,PVC基质配制的混标对其影响不大,但ABS基质配制的混标对其产生增强作用。从3个相同材质样品的结果来看,尽管存在基质效应,但相同的ABS基质之间,或者PVC基质之间差别不大。因此在实际样品检测中,采用空白基质匹配的标准曲线进行定量分析能够保证检测结果的准确性。
2.4 方法提取率的考察
采用溶解-沉淀法对塑料样品中的N-亚硝胺进行提取,并考察该方法的提取率。由于无法买到具有特定含量的N-亚硝胺标准样品,本实验室自制了20 mg/kg阳性样品,按1.3节方法处理,然后进行回收率测定。经溶解-沉淀法提取ABS阳性样品的回收率在66.8%~106.4%之间,示于图4。关于沸点较低的物质(如NDMA、NMEA等)回收率较低,可能是这两种物质在室温下的挥发性较强,在阳性样品制备过程中损失较多,导致回收率偏低,而溶解-沉淀法本身具有较高的绝对提取率。对于PVC阳性样品,多数物质的回收率在90.0%~110.0%之间,而NDMA、NMEA和NDEA的回收率低于65.0%,可能是由于四氢呋喃的挥发性较丙酮差,在制作PVC阳性样品时,自然风干时间更长,造成这3种物质在制作过程中的损失增多。
2.5 方法学考察
2.5.1线性范围、相关系数及定量限 分别以ABS和PVC的空白基质提取液配制一系列浓度为0.02~20 mg/kg的15种N-亚硝胺标准溶液,按浓度从低到高依次测定,以10倍信噪比计算得到各物质的定量限分别为0.02~0.1 mg/kg(ABS)和0.02~0.2 mg/kg(PVC)。以定量离子对的峰面积为纵坐标,各物质的质量浓度为横坐标进行线性回归,结果表明,在0.02~20 mg/kg线性范围内具有良好的线性关系,相关系数(R2)均大于0.996 3,结果列于表1。
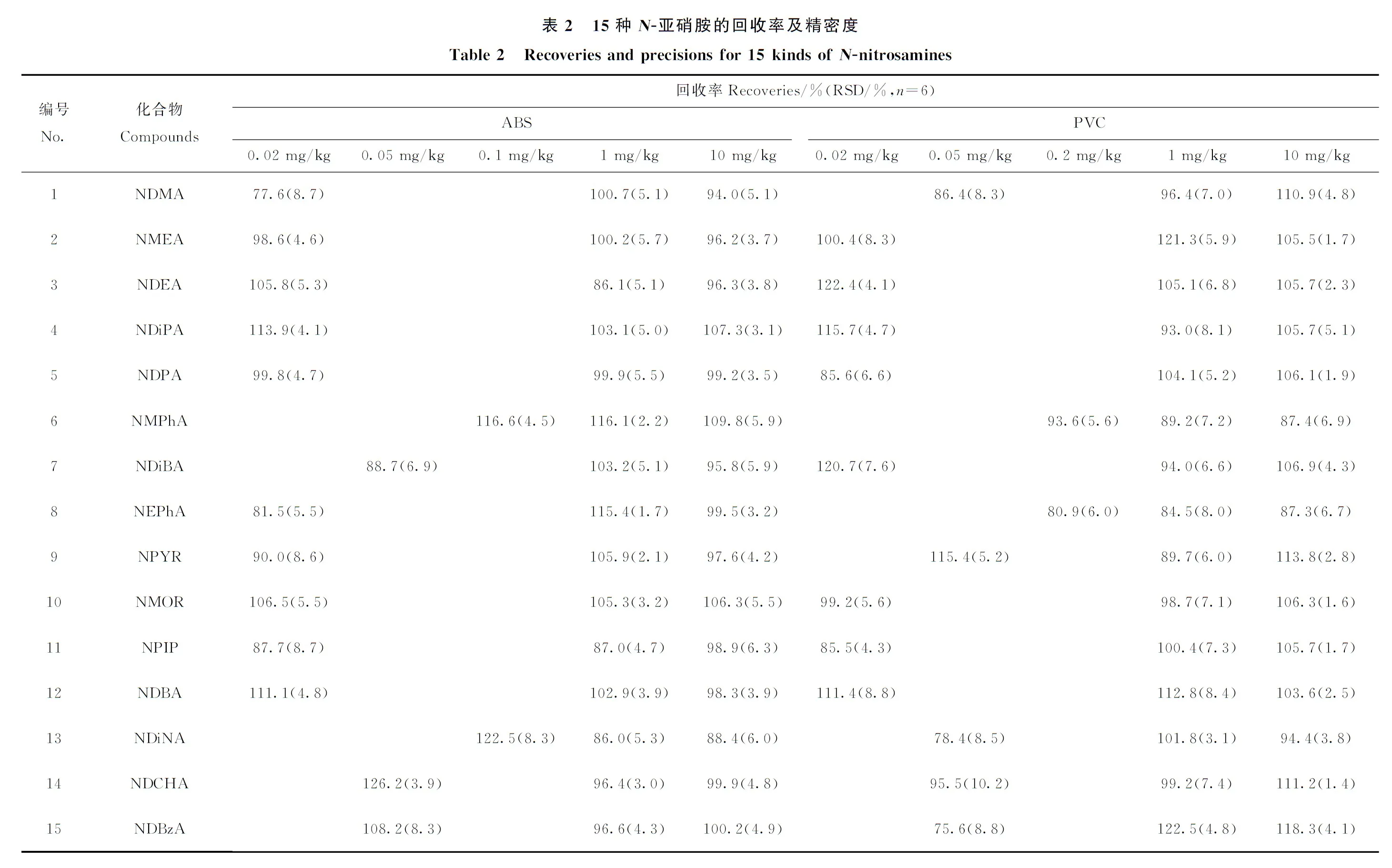
2.5.2回收率与精密度 在ABS和PVC空白玩具提取液中对每种N-亚硝胺设定3个不同添加水平,分别为10 mg/kg、1 mg/kg和定量限附近。对每个添加水平重复6次实验,结果列于表2。可知,15种物质在ABS样品中的回收率为77.6%~126.2%,相对标准偏差(RSD)为1.7%~8.7%;在PVC样品中的回收率为75.6%~122.4%,RSD为1.4%~10.2%。
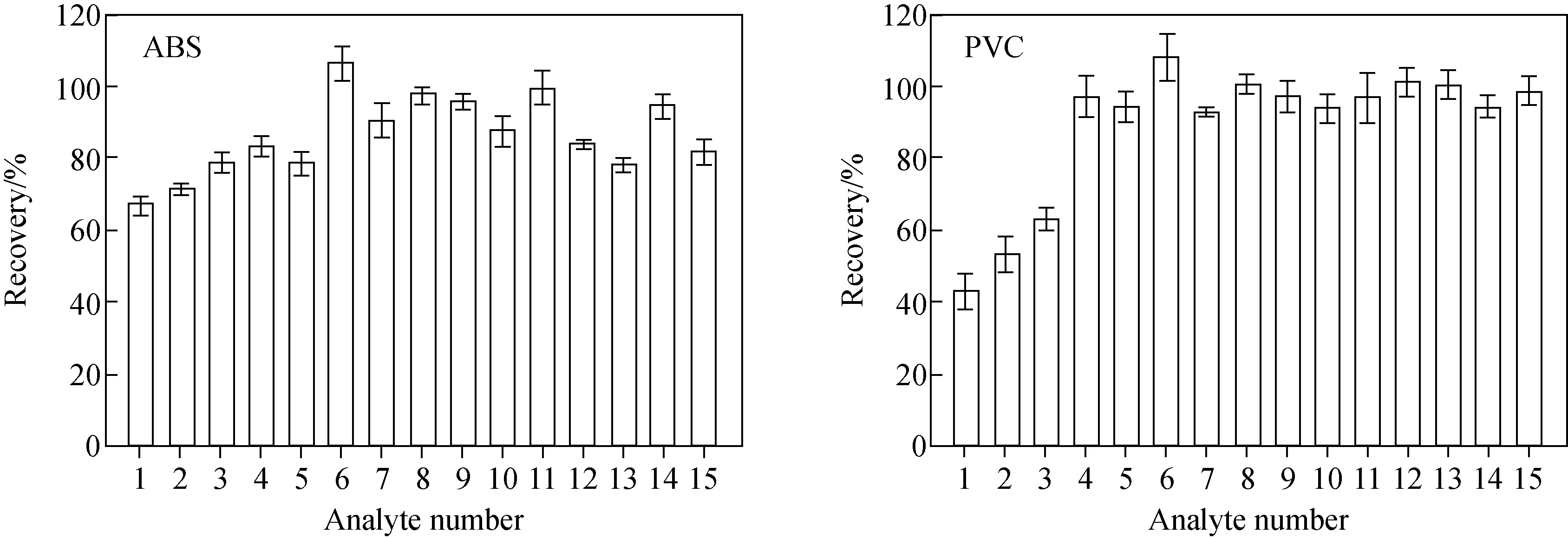
注:横坐标物质编号与表1中一致图4 溶解-沉淀法提取阳性样品中15种亚硝胺的回收率Fig.4 Recoveries of 15 N-nitrosamines in positive samples using dissolution-precipitation method
2.6 实际样品分析
从商场和电商平台上随机采购了35个ABS和30个PVC塑料玩具,应用本方法进行检测,均未检出15种N-亚硝胺。由此可初步判断目前我国市场上的塑料玩具中N-亚硝胺的存在情况较为安全。
3 结论
基于溶解沉淀-气相色谱-串联质谱建立了塑料玩具中15种N-亚硝胺残留量的测定方法。该方法具有较强的选择性,且对于塑料样品中的目标物质具有较高的提取率。由于存在溶剂效应和基质效应,需要采用空白基质匹配的标准曲线进行定量以保证检测结果的准确性。该方法简便、快速、准确、灵敏且成本较低,适用于塑料玩具中N-亚硝胺残留量的测定,也可为塑料样品中其它物质的残留量测定提供借鉴。

