哈茨木霉SKD-ZX-1的鉴定、发酵及其生防效果
陆洪省 张雪 高宇婷 孙珮铭 邱萌萌
(山东科技大学化学与环境工程学院,青岛 266590)
土传病害是一类重要的植物病害,主要以土壤为传播媒介,从植物的根部侵染植株,最后引起植株整株死亡,给农业生产造成巨大的损失[1]。在治理土壤病虫害的过程中,长期大量使用高毒、高残留的化学农药对蔬菜、粮食作物等种植土壤造成了非常严重的污染。由于化学药剂对环境污染问题日益突出,生物防治越来越引起人们的关注[2]。
木霉属(Trichoderma)作为一类重要的生防真菌,广泛存在于自然界中,具有适应性强、存在范围广和高效等优点[3]。木霉属包括多个菌种,如绿色木霉(Trichoderma viride)、康宁木霉(Trichoderma koningii)、棘孢木霉(Trichoderma asperellum)、深绿 木 霉(Trichoderma atroviride)、 哈 茨 木 霉(T.harzianum)、长枝木霉(Trichoderma longibrachiatum)等,其中哈茨木霉菌是木霉菌属中应用最广的一个菌种。哈茨木霉能够有效的防治镰刀菌(Fusarium)、腐 霉 菌(Pythium)、 立 枯 丝 核 菌(Rhizoctonia solani)、人参锈腐病菌(Cylindrocarpon destructans)、禾谷丝核菌(Rhizoctonia ce-realis)、灰葡萄孢菌(Botrytis cinerea)等引起的植物白绢病、幼苗枯病、疫霉病、人参锈腐病、小麦纹枯病、番茄灰霉病等,是多种植物病原菌的拮抗菌和寄生菌,已作为生防制剂广泛用于农业领域[4-8],而且哈茨木霉可以产生多种能够促进植物的生长和提高植物的抗病性的活性次级代谢产物[9-10]。链格孢是经济上重要的真菌属之一。大多数种类兼性寄生于植物上,引起多种经济植物病害,造成田间和产后损失。萎缩芽孢杆菌(Bacillus atrophaeus)对链格孢有明显的拮抗作用[11];解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、枯草芽孢杆菌(Bacillus subtilis)、胶冻样芽孢杆菌(Bacillus mucilaginosus)、地衣芽孢杆菌(Bacillus licheniformis)、放线菌(Actinomycesbovis)、嗜麦芽寡养单胞菌(Stenotrophomonasmaltophilia)和哈茨木霉(T. harzianum)突变菌株对茄链格孢菌均有明显的抑制效果[12-16]。
本研究从番茄根腐烂病发病严重的土壤中分离到一株哈茨木霉菌株,并用该哈茨木霉分别对链格孢菌和茄链格孢菌进行拮抗实验,此外,本实验还对哈茨木霉发酵液中的抑菌成分进行测定,并分析哈茨木霉发酵液对土壤中细菌菌群的影响。
1 材料与方法
1.1 材料
实验中供试病原菌为链格孢菌(Alternaria spp.)和茄链格孢菌(Alternaria solani),由中国农业科学院提供,保存于PDA培养基上以备使用;所用土壤为番茄根部腐烂严重的土壤,取自山东枣庄某蔬菜大棚。
1.2 方法
1.2.1 哈茨木霉的分离与培养 分离过程:用PDA固体平板培养基对哈茨木霉进行分离,培养基组成:去皮马铃薯 200 g、葡萄糖 20 g、琼脂 15-20 g、蒸馏水 1 L、pH值自然。分离方法:称取1 g番茄根部腐烂严重的土壤加到盛有100 mL无菌水的烧杯中,搅拌均匀后静置6 h,取上层土壤浸出液20 μL涂布到PDA固体平板培养基上,28℃恒温培养箱中培养 5 d,长出肉眼可识别的菌落后,挑取与哈茨木霉形态、颜色、透明度一致的单个菌落重复划线,直至确认为纯菌。
1.2.2 哈茨木霉的系统分类学鉴定 对分离到的菌株进行ITS-PCR扩增,所用引物为通用引物 ITS1(TCCGTAGGTGAACCTGCCG) 和 ITS4(TCCTCCGCTTATTGATATGC)。扩增体系为:DNA模板 1 μL、2×PCR Master Mix 25 μL、引物 ITS1 和ITS4 各 1 μL、ddH2O 22 μL。扩增条件为 :94℃预变性5 min;94℃变性30 s,52℃退火30 s,72℃延伸1 min,35个循环;72℃复性10 min,扩增产物在4℃条件下保存。取5 μL扩增产物与1 μL loading buffer混匀,加入1%琼脂糖凝胶孔中,用DNA Marker作对照,在1×TAE电泳缓冲液中电泳,以凝胶成像系统检测PCR扩增产物,委托睿博兴科生物技术有限公司测序,测得序列在GenBank中用Blast程序进行相似性分析[17]。用MEGA 5.1进行聚类分析,采用邻近法(Neighbor-Joining,NJ)构建系统进化树[18]。
1.2.3 哈茨木霉发酵液制备 将分离纯化出的哈茨木霉菌株接种到PDA固体平板培养基,28℃条件下培养7 d,用无菌水冲洗上述PDA平板,得到孢子悬浮液,将孢子悬浮液加入到发酵培养基中,使其在发酵培养基中浓度为1×107个/mL[19]。发酵培养基组成:葡萄糖 20 g、KH2PO41.2 g、MgSO4·H2O 0.6g、维生素 B10.008 g、蒸馏水 1 L[20],28℃、120 r/min振荡培养7 d,得到发酵液。发酵液离心(8000 r/min)10 min取上清液,用0.22 μm的滤头过滤,得到无菌发酵液,待用。
1.2.4 哈茨木霉发酵液成分的GC-MS分析 发酵液成分的提取步骤:取上述制备好的哈茨木霉发酵液,按发酵液∶乙醇=1∶3(V/V)比例浸提,50℃水浴、搅拌使之溶解,溶解后按溶液∶石油醚=1∶3(V/V)比例浸提,留取水层并分别用乙醚、乙酸乙酯、正丁醇进一步萃取,对萃取得到的有机层浓缩,再用吐温-80溶解并分别标志为A、B、C[21]。对A、B、C三种萃取物分别用无水硫酸钠脱水后用气质联用仪(Agilent 5977B)测定。色谱条件:毛细管色谱 柱 HP-5MS(5% Phenyl Methyl Silox,325℃,30 m × 250 μm × 0.25 μm),汽化室温度 270℃,载气为氦气,柱流量1 mL/min,不分流进样,进样量为1 μL。60℃柱温维持 4 min,然后 10℃/min升高到150℃维持2 min,然后以5℃/min升高到260℃维持15 min。进样口温度260℃,检测器温度280℃。质谱条件:电离源EI,电子能量70 ev,离子源温度230℃,四级杆温度150℃,扫描范围全扫描。
1.2.5 哈茨木霉发酵液对土壤中细菌菌群的影响 将10 mL上述1.2.3中制备的哈茨木霉发酵液和10 mL番茄根腐烂病发病严重的土壤浸出液(1 g土壤加入到100 mL无菌水,搅拌、静置而来)接种到200 mL哈茨木霉发酵培养基中,作为实验组;未接种哈茨木霉发酵液只接种发病土壤浸出液的为对照组,两种处理均在28℃条件下培养10 d,然后委托上海生工生物工程股份有限公司对两种处理液进行高通量宏基因组测序。
1.2.6 哈次木霉菌株对两种供试病原菌的拮抗实验 采用平板对峙培养法分别对链格孢菌、茄链格孢菌和上述分离纯化到的菌株进行平板对峙实验,方法:分别挑取直径7 mm的链格孢菌菌块和茄链格孢菌菌块放置到新的PDA平板一侧,距平板边缘2cm左右的位置上,再将分离纯化后的菌块分别放置到链格孢菌菌块和茄链格孢菌菌块的相对侧的PDA平板上,距平板边缘同样为2 cm左右的位置,作为实验组;单独接种两种病原菌菌块的平板作为对照组,培养温度28℃,培养5 d,每组做3次平行处理,每天记录病原菌及哈茨木霉的生长状况,测量菌落半径。平板培养第5 d时分别计算哈茨木霉对两种病原菌的抑制率[8,22]。
拮抗系数的分级标准(5级)Ⅰ级:哈茨木霉菌丝长满平皿;Ⅱ级:2/3平皿面积 ≤ 哈茨木霉菌丝面积 < 100%平皿面积;Ⅲ级:1/3平皿面积 ≤ 哈茨木霉菌丝面积 < 2/3平皿面积;Ⅳ级:0 < 哈茨木霉菌丝面积 < 1/3 平皿面积;Ⅴ级:病原菌菌丝长满平皿。
抑制率(%)=(病原菌对照菌落半径-病原菌对峙菌落半径/病原菌对照菌落半径)×100%
2 结果
2.1 菌株的菌落形态
菌株在PDA培养基生长迅速,培养3 d时出现白色絮状菌丝且铺满整个平板,之后菌丝逐渐变为绿色,培养6 d时菌丝变为暗绿色,无明显气味,菌落形态特征与哈茨木霉菌株基本一致(图1)。

图1 菌落的形态观察
2.2 菌株的系统分类学鉴定
PCR扩增后的DNA序列通过凝胶电泳确认后(长度625 bp)进行测序,将测得的序列在NCBI数据库中进行BLAST同源性比对,与数据库中各菌株序列进行相似性分析,与T. harzianumCGAJ1T-1菌株的一致性达100%。用MEGA5.1软件对同源性较高的序列进行序列分析并构建系统发育树,系统发育树如图2所示,该序列和T. harzianumCGAJ1T-1菌株在同一分支,结合其生物学特性及形态学特征,确定该菌株为哈茨木霉,并命名为Trichoderma harzianumSKD-ZX-1(序列号 :LC485252)。
2.3 哈茨木霉发酵液抑菌组分分析
用气相色谱质谱连用仪对提取物A、B、C进行分析[21],色谱图如图3-5所示。得到的质谱图经NIST02质谱数据库检索并与标准图谱核对,确定其组分。哈茨木霉发酵液提取物的主要化学组分包括醇类、酯类、烷类、烯酸类等,其中化合物名称及相对含量见表1-3。
由相关研究发现[23],邻苯二甲酸酯类具有较好的抑菌效果,而在A和C两种提取物中均含有邻苯二甲酸酯类(表1和表3),其中提取物A中邻苯二甲酸二异丁酯(图3,7号峰)占出峰总量的5.57%,邻苯二甲酸二丁酯(图3,8号峰)占出峰总量的27.33%,邻苯二甲酸二(2-乙基己基)酯(图3,16号峰)占出峰总量的1.6%。提取物C中邻苯二甲酸二异丁酯(图5,7号峰)占出峰总量的2.194%,邻苯二甲酸二丁酯(图5,9号峰)占出峰总量的1.33%。其他物质是否有抑菌作用还有待研究。

图2 基于ITS1+ITS4基因序列构建的菌株T. harzianum SKD-ZX-1系统发育树
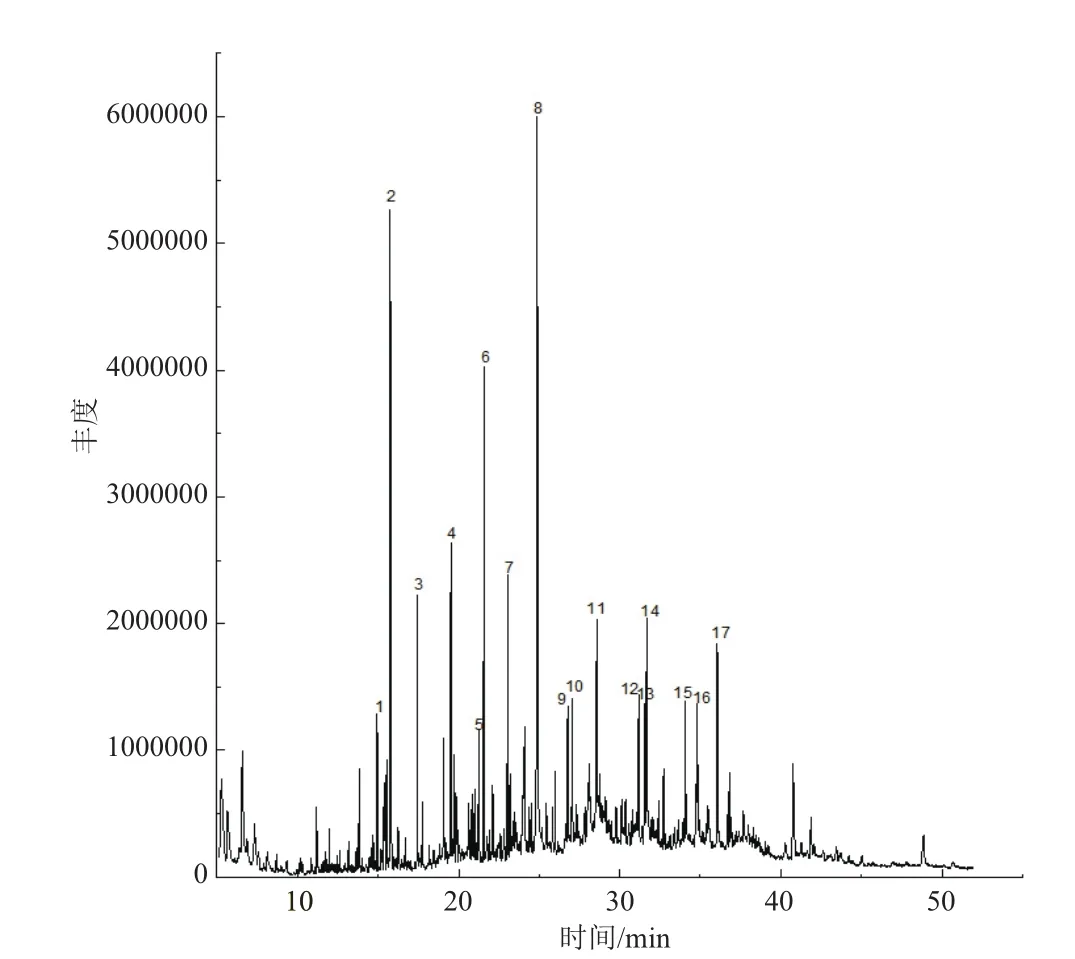
图3 分步提取法提取物A的气相色谱图

图4 分步提取法提取物B的气相色谱图

图5 分步提取法提取物C的气相色谱图
2.4 哈茨木霉发酵液对土壤中细菌群落的影响
2.4.1 哈茨木霉发酵液对土壤中细菌菌群多样性的影响 由表4可知,加入哈茨木霉发酵液的实验组样品中含有1505个OTUs,而未加入哈茨木霉发酵液的对照组含有805个OTUs,说明哈茨木霉发酵液可增加土壤中细菌菌群的种类;加入哈茨木霉发酵液的实验组样品中Ace和Chao指数均高于对照组,
说明实验组中细菌物种总数高于对照组;实验组样品Shannon指数小于对照组,而Simpson指数大于对照组,说明实验组样品中细菌的多样性低于对照组;实验组覆盖度指数微高于对照组,且均在0.90以上,说明采集的样品足以反应土壤中细菌情况。

表1 分步提取法提取物A的化学成分分析

表2 分步提取法提取物B的化学成分分析

表3 分步提取法提取物C的化学成分分析
2.4.2 哈茨木霉发酵液对土壤细菌菌群结构的影响 通过宏基因组16S rDNA的物种分类分析,得到以下结果(表5、表6)。由表5可知,在门分类水平上,加入哈茨木霉发酵液的实验组中变形菌门的相对丰度变化较明显,有明显的提高,优势菌群厚壁菌门在实验组中丰度大大的降低,拟杆菌门和放线菌门变化较小。
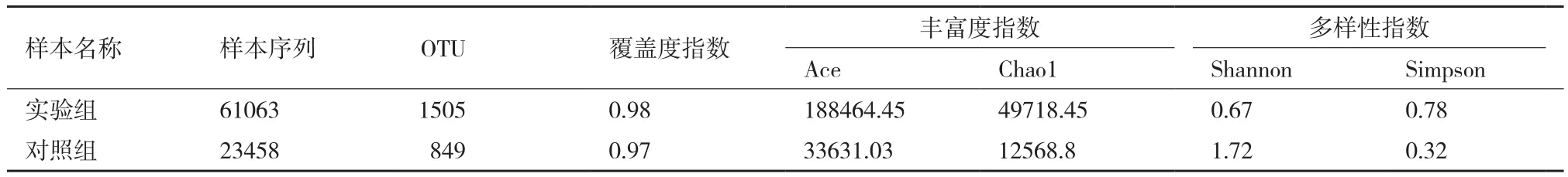
表4 各组样品多样性指数
由表6可知,在属分类水平上,肠杆菌属、假单胞菌属和梭菌属3个菌属的丰度占整体的90%以上。与对照组相比,加入哈茨木霉发酵液组肠杆菌属提高46%,而假单胞菌属和梭菌属分别降低5.28%和36.1%,肠杆菌属显著增加,而梭菌属显著降低。
2.5 哈茨木霉对两种供试病原菌的拮抗结果分析
从哈茨木霉和两种病原菌的对峙实验中观察到,哈茨木霉对两种病原菌均有很好的抑制效果,对峙培养3 d时哈茨木霉和两种病原菌开始接触,哈茨木霉在PDA平板上生长迅速,病原菌的生长均明显受到抑制;5 d时,哈茨木霉已占据整个PDA平板,分别将两种病原菌包围,两种病原菌边缘塌陷,长势被削弱,几乎不再生长(图6)。根据抑制率公式(1.2.6),分别测量培养5 d时菌落直径计算出哈茨木霉对链格孢菌和茄链格孢菌的抑制率均达到100%,拮抗系数为Ⅰ级(表7)。

表5 哈茨木霉发酵液对土壤中细菌在门水平上的丰度影响
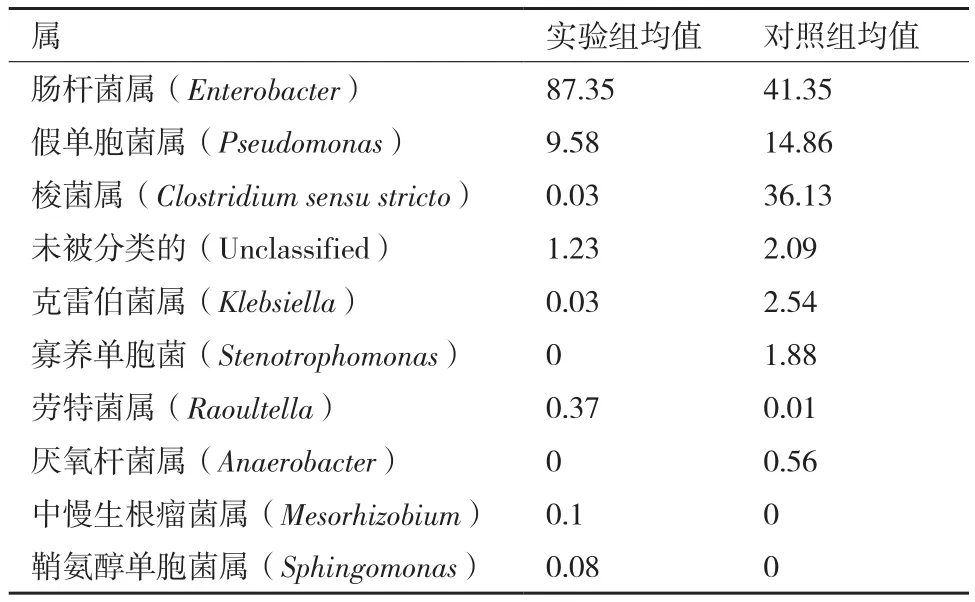
表6 哈茨木霉发酵液对土壤中细菌在属水平上的丰度影响(前10种)
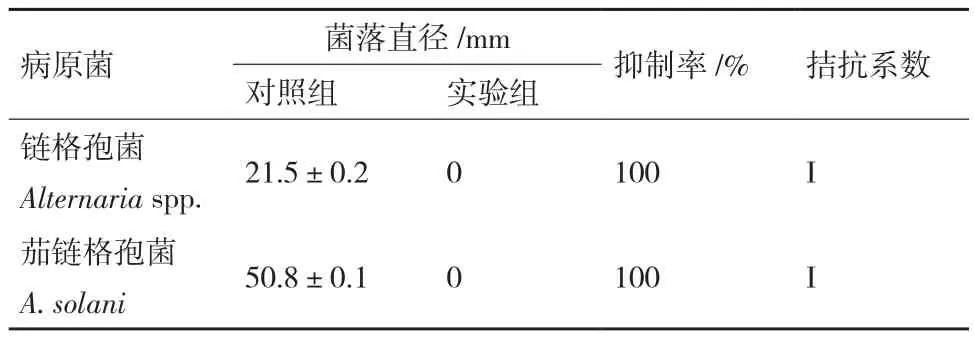
表7 哈茨木霉对链格孢菌和茄链格孢菌的抑制作用
3 讨论
研究表明,哈茨木霉对多种病原菌均有一定的抑制作用。哈茨木霉T28菌株对苗木立枯病3种病原菌,包括立枯丝核菌、尖孢镰刀菌、德巴利腐霉均有一定的拮抗作用[24];哈茨木霉TH-1菌株对小麦纹枯病有一定的防治效果,对小麦纹枯病菌菌丝生长有较强的抑制作用[7];哈茨木霉对番茄灰霉病、枯萎病、叶霉病和褐斑病进行了重寄生[25]。本实验通过对峙培养,研究了哈茨木霉对链格孢菌和茄链格孢菌的拮抗作用,其抑制率都相对较高,拮抗系数都达到Ⅰ级,有较好的抑制效果。

图6 哈茨木霉与两种致病菌的对峙培养
本研究通过高通量宏基因组测序分析了哈茨木霉发酵液对土壤中细菌菌落的影响,其中肠杆菌属在加入哈茨木霉发酵液后丰度有大幅度提高,而假单胞菌属和梭菌属降低。可见,哈茨木霉发酵液改变了土壤中细菌的菌群结构,并且有相关文献表明哈茨木霉可以改变土壤中细菌的菌落结构。生防菌哈茨木霉T4促进了假单胞菌、芽孢杆菌、苍白杆菌和中慢生根瘤菌的生长,对西瓜根围土壤的细菌群落有了明显的影响[26];哈茨木霉T23和土壤有益细菌放线菌、光合细菌和乳酸杆菌分别混合处理后,3种土壤有益细菌的数量均比单独使用3种供试细菌的数量明显增加,说明哈茨木霉T23对3种供试细菌有一定的促进生长的作用[27]。对哈茨木霉发酵液进行GC-MS分析后,其中得到醇类、酯类、烷类、烯酸类,有相关的研究表明,邻苯二甲酸酯类有抑菌、抑藻和他感作用。邻苯二甲酸二丁酯是一种对藻类具有较强的抑制能力的化感物质,其对短裸甲藻的半效应浓度为1.1 mg/L[28];辣椒根系分泌物的主要化感物质中有邻苯二甲酸酯类,其中,邻苯二甲酸二丁酯的含量最高[29];广玉兰叶片浸提液对铜绿微囊藻有很好的抑制效果,提取物中有大量的抑藻活性物质,其活性成分中有31.69%的邻苯二甲酸单(2-乙基)己酯;紫茎泽兰根系分泌化感物质邻苯二甲酸二丁酯在高浓度下(500,1000 mg/L)对有机磷细菌的生长有抑制作用[30]。以上结果表明,本研究中分离到的哈茨木霉SKD-ZX-1对植物病害土壤中微生物的群体构造具有明显的影响,但该结果是在实验室土壤环境条件获得,与作物实际生长的土壤环境还有一定的差别,包括土壤中温度、水分、光照等条件都会对哈茨木霉的作用产生一定的影响。因此,田间土壤实验将是下一步的研究工作。
4 结论
本研究从番茄根腐烂病严重的土壤中分离到一株哈茨木霉,并对其生防作用进行研究表明,哈茨木霉SKD-ZX-1对链格孢菌和茄链格孢菌均有一定的抑制作用;其发酵液含有一定的抑菌成分并且可以改变土壤中细菌的菌落结构。以上结果表明,本研究中分离到的哈茨木霉SKD-ZX-1对植物病害土壤中微生物的群体构造具有明显的影响,但该结果是在实验室土壤环境条件获得,与作物实际生长的土壤环境还有一定的差别,包括土壤中温度、水分、光照等条件都会对哈茨木霉的作用产生一定的影响。因此,田间土壤实验将是下一步的研究工作。

