芪茵荷叶饮对糖耐量异常大鼠糖代谢及骨骼肌NF-κB信号通路的影响*
黄海超,窦昊颖,梁芳芳,王泓午
(1.天津中医药大学,天津 301617;2.天津市口腔医院,天津 300041)
糖尿病发生的一个必经阶段,称为“糖尿病前期”,包括糖耐量受损(IGT)和/或空腹血糖受损(IFG)[1]。其中,IGT患者存在明显的胰岛素抵抗及分泌障碍,是糖尿病的危险人群[2]。研究发现,糖尿病前期可增加肾脏、神经、视网膜及大血管病变的风险[3-6]。因此,对IGT患者进行有效的干预可阻止糖尿病进展,对糖尿病防治将起到重大作用。肥甘厚腻饮食是引发IGT甚至2型糖尿病(T2DM)的重要原因之一[7],以阴虚热盛和湿热困脾为主[8-9]。前期研究已证实[10-11],气虚和痰浊是T2DM主要的证候,气虚贯穿于糖尿病前期和T2DM病程的始终。T2DM以气阴两虚型和湿热困脾型为主,而糖尿病前期则以阴虚内热、湿热困脾为主。脾主运化、统血,输布水谷精微,喜燥恶湿,脾虚则气不足,堆积不能运化,淤积于体内助湿生痰。因此,按照益气补阴,补气益脾,清热除湿的治则可预防高脂高糖饮食引起的IGT向T2DM演变。本研究选取黄芪、茵陈蒿和荷叶三药配伍组成芪茵荷叶饮,并采用正交实验研究其能否预防IGT向T2DM演变,并从NF-κB信号通路入手,探明芪茵荷叶饮预防IGT向T2DM演变的作用机制。
1 材料
1.1 动物 4~5周龄清洁级SD雄性大鼠,体质量150~180 g,共110只。由北京维通利华实验动物技术有限公司提供。
1.2 主要试剂与仪器 罗氏活力型血糖检测仪和血糖试纸,大鼠胰岛素ELISA试剂盒(上海宝曼生物科技有限公司)。HWY-100C恒温培养箱,Bio-Rad iMark酶标仪,EnSpire酶标仪。
1.3 药物制备 芪茵荷叶饮由黄芪、茵陈蒿和荷叶按比例配制,在天津中医药大学实验中心煎煮。每克中药加水6 mL浸泡30 min,武火煮沸后转文火煎煮30 min,过滤后收集煎液,原渣每克加水4 mL煎煮40 min,合并两次煎液,于60℃水浴浓缩成每毫升制剂相当于生药1 g,置4℃冰箱备用。给药前复温至25~30℃。
2 方法
2.1 造模方法[12]150~180 g清洁级雄性SD大鼠180只适应性喂养1周,随机抽取10只作为对照组(N)给予基础饲料喂养(碳水化合物65.42%,蛋白质占22.47%,脂肪占12.11%),其余为IGT造模组,给予45%的高脂高糖饲料(碳水化合物占35%,蛋白质占20%,脂肪占45%)。所有饲料由北京华阜康生物科技股份有限公司提供。实验期间各组大鼠自由饮水,每日投食1次。喂养12周时,IGT造模组禁食12 h后,经鼠尾采血测空腹血糖(FBG),以50%葡萄糖注射液2 g/kg体质量灌胃,2 h后再次鼠尾采血测OGTT 2 h血糖(2 h PG),以 3.9 mmol/L≤FBG<6.1 mmol/L,7.8 mmol/L≤2 h PG<11.1 mmol/L 并持续1周以上为造模成功,成模率60%。
2.2 分组及给药方法 将100只建模成功的大鼠随机分为模型组 1组和实验组 9组(A,B,C,D,E,F,G,H,I),设对照组 1 组,共 11 组,每组10只。按照《中国药典》给药剂量,进行大鼠与人体等效剂量换算后的剂量为中剂量,低剂量为中剂量一半,高剂量为中剂量的两倍。9组实验组用药剂量配伍按正交表L9(34)设计,见表1。水煎混合悬液灌胃,模型组和对照组生理盐水灌胃,各组灌胃体积相同,每日1次,持续12周。灌胃期间各组大鼠均普通饲料喂养。

表1 正交实验设计表Tab.1Qiyin Heye Decoction L9(34)orthogonal experimental factor level
2.3 指标检测方法
2.3.1 血清指标检测 分别在给药前、给药6周和给药12周,大鼠禁食12 h后采用葡萄糖氧化酶法测FBG、采用酶联免疫分析法空腹胰岛素(FINS)水平。计算HOMA胰岛素抵抗指数(HOMA-IR)=FBG×FINS/22.5。
2.3.2 骨骼肌取材 给药12周后取大鼠后肢骨骼肌样本,冻存于-80℃冰箱,待指标检测。
2.3.3 苏木精-伊红(HE)染色 将肌肉组织切片经苏木素浸染5 min左右,水洗l min,75%的盐酸乙醇分化30 s,水洗,氨水处理30 s,水洗1 min,酸化伊红乙醇液染12 min,流水快速冲洗、脱水、透明、封片固定。
2.3.4 实时荧光定量PCR检测方法 应用实时荧光反转录-多聚酶链反应(RT-PCR)检测NF-κB信号通路节点基因相关mRNA含量。采用Trizol法提取骨骼肌总RNA,反转录为cDNA,反转录条件为37℃15 min,85℃5 s。荧光定量PCR仪进行基因表达量的检测,2-ΔΔCt法对 Real-time PCR 结果进行定量分析。扩增条件为预变性95℃30 s,扩增反应为95℃5 s,60℃34 s,反复40个循环。由生工生物工程(上海)股份有限公司合成引物,GAPDH作为内参照,GAPDH上游引物为:5’-GACATGCCGCCTGGAGAAAC-3’;下游引物为:5’-AGCCCAGGATGCCCTTTAGT-3’;NF-κBp65 上 游 引物为:5’-GACCTGGAGCAAGCCATTAG-3’,下游引物为:5’-CACTGTCACCTGGAAGCAGA-3’;IκB-α 上游引物为:5’-TTGGTCAGGTGAAGGGAGAC-3’,下游引物为:5’-GCTTTCAGAAGTGCCTCAGC-3’。
2.4 统计学方法 采用SPSS 20.0进行统计学处理。符合正态分布的计量资料用均数±标准差()表示,多组间比较采用单因素方差分析,正交实验采用直观分析和正交设计方差分析,重复测量资料采用重复测量方差分析,P<0.05为差异有统计学意义。
3 结果
3.1 对大鼠空腹葡萄糖的影响 给药期各组大鼠空腹葡萄糖重复测量方差分析主效应结果显示:Mauchly球形检验P=0.326,满足“球对称”。不考虑时间因素,实验各组大鼠空腹葡萄糖有统计学意义(F组间=4.269,P=0.000)。不考虑干预因素,各组大鼠空腹葡萄糖随时间变化而变化(F时间=110.670,P=0.000)。时间与组别交互效应结果显示,实验各组大鼠空腹葡萄糖随时间的变化趋势差异有统计学意义(F交互=3.240,P=0.000)。各组大鼠空腹葡萄糖变化情况:给药6周时除实验I组外其余各组血糖值均较给药前降低,其中实验E组下降最明显,与模型组相比具有统计学差异(P<0.05)。给药12周时,各实验组FBG值均反弹,其中实验B组和E组均较模型组升高,差异有统计学意义(P<0.05)。见表2。
表2 芪茵荷叶饮对大鼠空腹葡萄糖的影响()Tab.2 Effect of QYHYD on FBG among eleven rats()
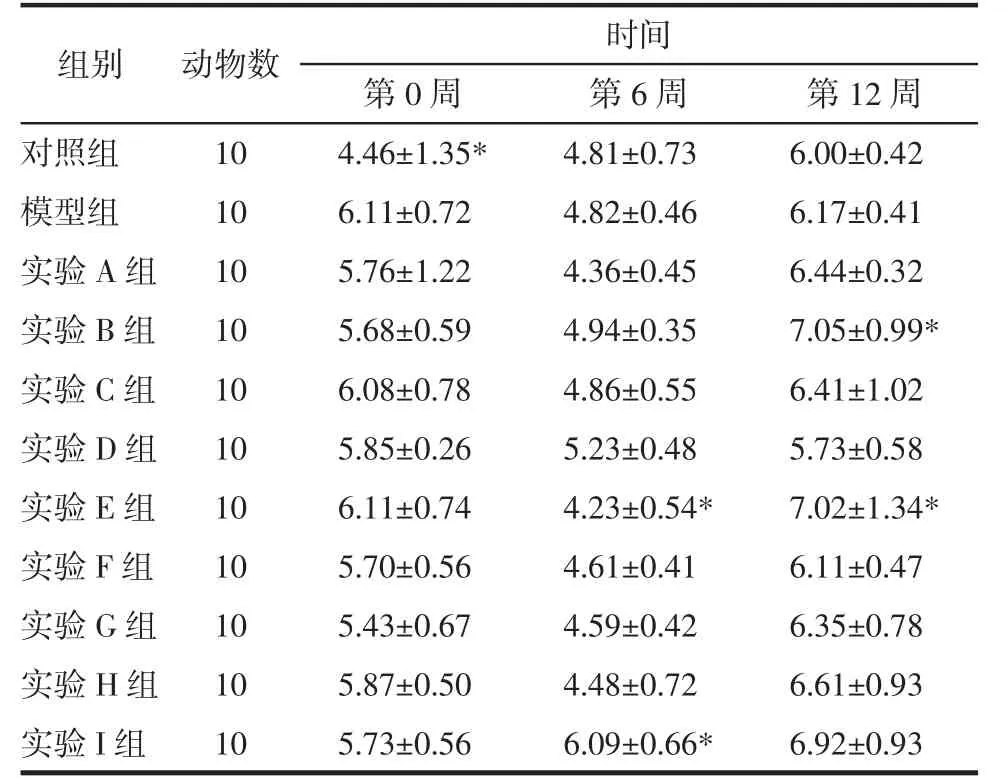
表2 芪茵荷叶饮对大鼠空腹葡萄糖的影响()Tab.2 Effect of QYHYD on FBG among eleven rats()
注:与模型组比较,*P<0.05。
组别对照组模型组实验A组实验B组实验C组实验D组实验E组实验F组实验G组实验H组实验I组动物数10 10 10 10 10 10 10 10 10 10 10时间第0周 第6周 第12周4.46±1.35* 4.81±0.73 6.00±0.42 6.11±0.72 4.82±0.46 6.17±0.41 5.76±1.22 4.36±0.45 6.44±0.32 5.68±0.59 4.94±0.35 7.05±0.99*6.08±0.78 4.86±0.55 6.41±1.02 5.85±0.26 5.23±0.48 5.73±0.58 6.11±0.74 4.23±0.54* 7.02±1.34*5.70±0.56 4.61±0.41 6.11±0.47 5.43±0.67 4.59±0.42 6.35±0.78 5.87±0.50 4.48±0.72 6.61±0.93 5.73±0.56 6.09±0.66* 6.92±0.93
3.2 芪茵荷叶饮对大鼠血清胰岛素的影响 给药期各组大鼠FINS重复测量方差分析主效应结果显示:Mauchly球形检验P=0.037,不满足“球对称”,采用校正法。不考虑时间因素,实验各组大鼠FINS有统计学意义(F组间=13.922,P=0.000)。不考虑干预因素,各组大鼠FINS随时间变化而变化(F时间=286.082,P=0.000)。时间与组别交互效应结果显示,实验各组大鼠FINS随时间的变化趋势差异有显著性(F交互=5.118,P=0.000),各组FINS随时间变化的趋势不一致。各组大鼠FINS变化:给药6周时各组FINS均较模型组降低,且有统计学差异(P<0.05)。给药12周时各组FINS水平均较给药6周时升高,但各实验组(除A和B组)较模型组降低差异有统计学意义(P<0.05)。见表3。
3.3 芪茵荷叶饮对大鼠HOMA-IR的影响 给药期各组大鼠HOMA-IR重复测量方差分析主效应结果显示:Mauchly球形检验P=0.335,满足“球对称”。不考虑时间因素,各组大鼠HOMA-IR有统计学意义(F组间=8.784,P=0.000)。不考虑干预因素,各组大鼠HOMA-IR随时间变化而变化(F时间=247.592,P=0.000)。时间与组别交互效应结果显示,实验各组大鼠HOMA-IR随时间的变化趋势差异有统计学意义(F交互=2.631,P=0.001),各组 HOMA-IR 随时间变化的趋势不一致。各组大鼠HOMA-IR变化情况:给药6周时除实验B组、C组及I组外,其余各组HOMA-IR均较模型组降低,差异有统计学意义(P<0.05)。给药12周,实验D组、F组、G组、H组和I组HOMA-IR均较模型组降低,差异有统计学意义(P<0.05)。见表 4。
表3 芪茵荷叶饮对大鼠血清胰岛素的影响()Tab.3 Effect of QYHYD on FBG among eleven rats()
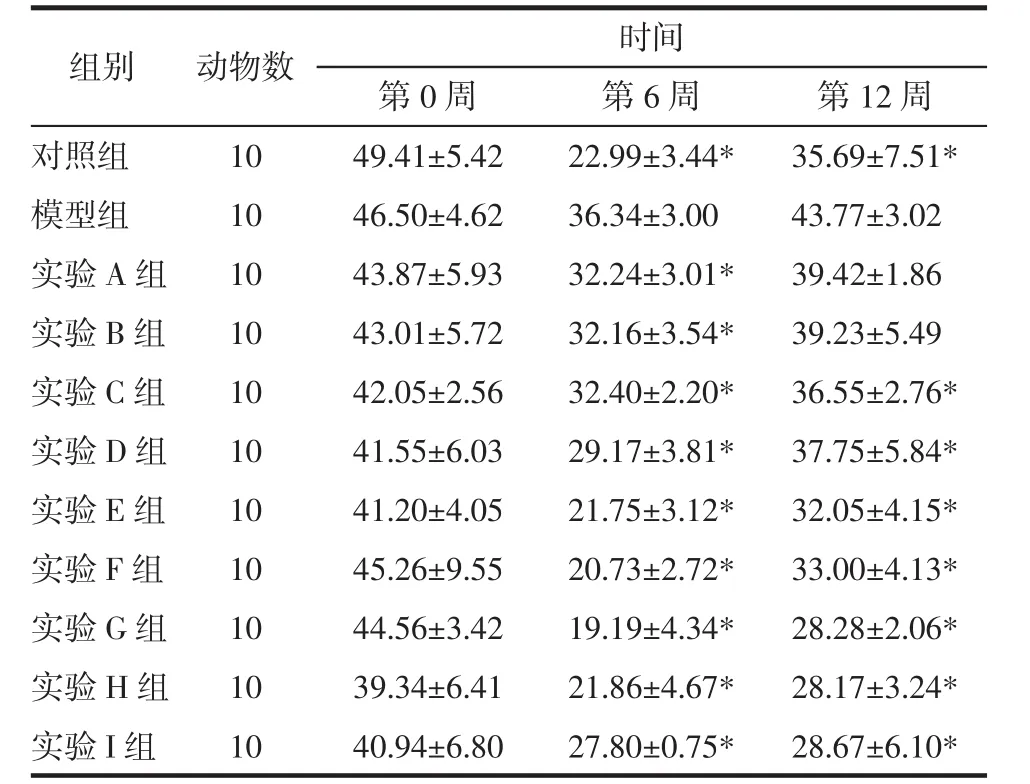
表3 芪茵荷叶饮对大鼠血清胰岛素的影响()Tab.3 Effect of QYHYD on FBG among eleven rats()
注:与模型组比较,*P<0.05。
组别对照组模型组实验A组实验B组实验C组实验D组实验E组实验F组实验G组实验H组实验I组动物数10 10 10 10 10 10 10 10 10 10 10时间第0周 第6周 第12周49.41±5.42 22.99±3.44* 35.69±7.51*46.50±4.62 36.34±3.00 43.77±3.02 43.87±5.93 32.24±3.01* 39.42±1.86 43.01±5.72 32.16±3.54* 39.23±5.49 42.05±2.56 32.40±2.20* 36.55±2.76*41.55±6.03 29.17±3.81* 37.75±5.84*41.20±4.05 21.75±3.12* 32.05±4.15*45.26±9.55 20.73±2.72* 33.00±4.13*44.56±3.42 19.19±4.34* 28.28±2.06*39.34±6.41 21.86±4.67* 28.17±3.24*40.94±6.80 27.80±0.75* 28.67±6.10*
表4 芪茵荷叶饮对大鼠HOMA-IR的影响()Tab.4 Effect of QYHYD on HOMA-IR among eleven rats()

表4 芪茵荷叶饮对大鼠HOMA-IR的影响()Tab.4 Effect of QYHYD on HOMA-IR among eleven rats()
注:与模型组比较,*P<0.05。
组别对照组模型组实验A组实验B组实验C组实验D组实验E组实验F组实验G组实验H组实验I组动物数10 10 10 10 10 10 10 10 10 10 10时间第0周 第6周 第12周9.73±2.91* 4.90±1.02* 9.57±2.35*12.56±1.37 7.83±1.29 12.00±1.14 11.00±1.21 6.27±0.88* 11.29±0.87 10.75±0.96 7.06±0.98 12.28±2.27 11.37±1.73 6.96±0.40 10.50±2.41 10.85±1.96 6.75±0.96* 9.63±1.97*11.17±1.65 4.08±0.92* 10.09±2.64 11.55±2.86 4.17±0.50* 8.99±1.53*10.65±0.60 3.95±1.22* 7.93±0.77*10.26±1.88 4.37±1.32* 8.25±1.30*10.38±1.84 7.43±0.92 8.82±2.08*
3.4 芪茵荷叶饮正交实验结果 给药12周时正交结果极差分析和方差分析显示,对FBG影响的主次因素为茵陈蒿>黄芪>荷叶,最佳配伍方案为中剂量黄芪+高剂量茵陈蒿+高剂量荷叶;对FINS影响的主次因素为黄芪>荷叶>茵陈蒿,最佳配伍方案为高剂量黄芪+高剂量茵陈蒿+中剂量荷叶;对HOMAIR影响的主次因素为茵陈蒿>黄芪>荷叶,最佳配伍方案为低剂量黄芪+低剂量茵陈蒿+低剂量荷叶。方差结果分析显示,不同剂量的茵陈蒿对FBG影响存在统计学差异,不同剂量黄芪对FINS和HOMA-IR存在统计学差异。见表5、表6。
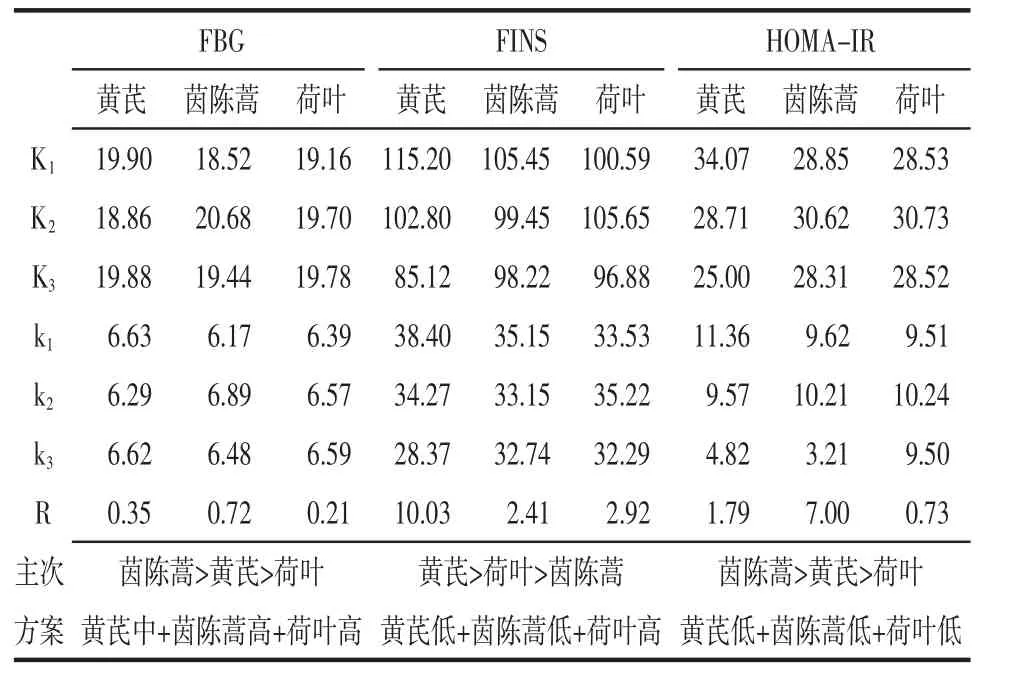
表5 第12周正交实验结果极差分析Tab.5 Range analysis of orthogonal experimental results at week 12
表6 第12周正交实验结果方差分析()Tab.6 ANOVA of orthogonal experimental results at week 12()
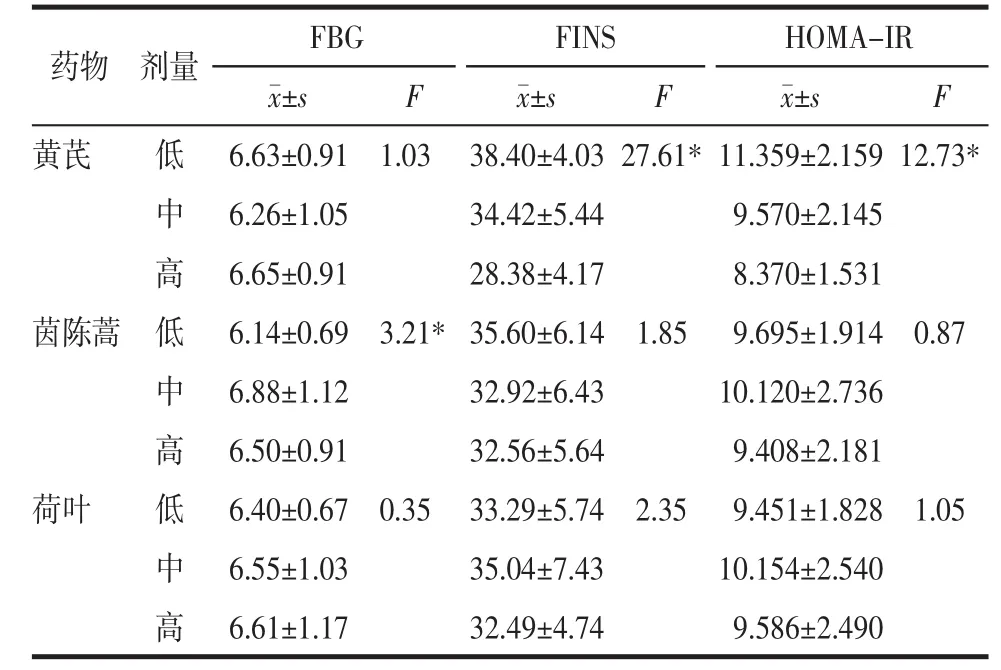
表6 第12周正交实验结果方差分析()Tab.6 ANOVA of orthogonal experimental results at week 12()
注:*P<0.05。
药物 剂量 FBG FINS HOMA-IR images/BZ_28_1041_804_1099_841.png F images/BZ_28_1041_804_1099_841.png F images/BZ_28_1041_804_1099_841.png F黄芪 低 6.63±0.91 1.03 38.40±4.03 27.61*11.359±2.159 12.73*中 6.26±1.05 34.42±5.44 9.570±2.145高 6.65±0.91 28.38±4.17 8.370±1.531茵陈蒿 低 6.14±0.69 3.21*35.60±6.14 1.85 9.695±1.914 0.87中 6.88±1.12 32.92±6.43 10.120±2.736高 6.50±0.91 32.56±5.64 9.408±2.181荷叶 低 6.40±0.67 0.35 33.29±5.74 2.35 9.451±1.828 1.05中 6.55±1.03 35.04±7.43 10.154±2.540高 6.61±1.17 32.49±4.74 9.586±2.490
3.5 骨骼肌组织病理学变化 给药12周末,大鼠肌肉组织HE染色结果显示:对照组大鼠骨骼肌形态完整、肌纤维排列整齐;模型组及9组实验组大鼠骨骼肌肌纤维排列紊乱、均有水肿,模型组水肿较为明显、可见炎症细胞浸润,见图1。
3.6 芪茵荷叶饮对大鼠骨骼肌 IκB-α及NF-κBp65mRNA的影响 给药期间各实验组大鼠骨骼肌IκB-α表达经方差分析具有统计学差异(F=51.819,P<0.01),其中实验H组IκB-α明显高于模型组,差异有统计学意义。各组大鼠NF-κBp65mRNA方差分析结果显示具有统计学差异(F=51.819,P<0.01)。与实验 M 组相比,A、C、G 3 组 NF-κBp65 下降,其中G组差异有统计学意义(P<0.05),见表7。
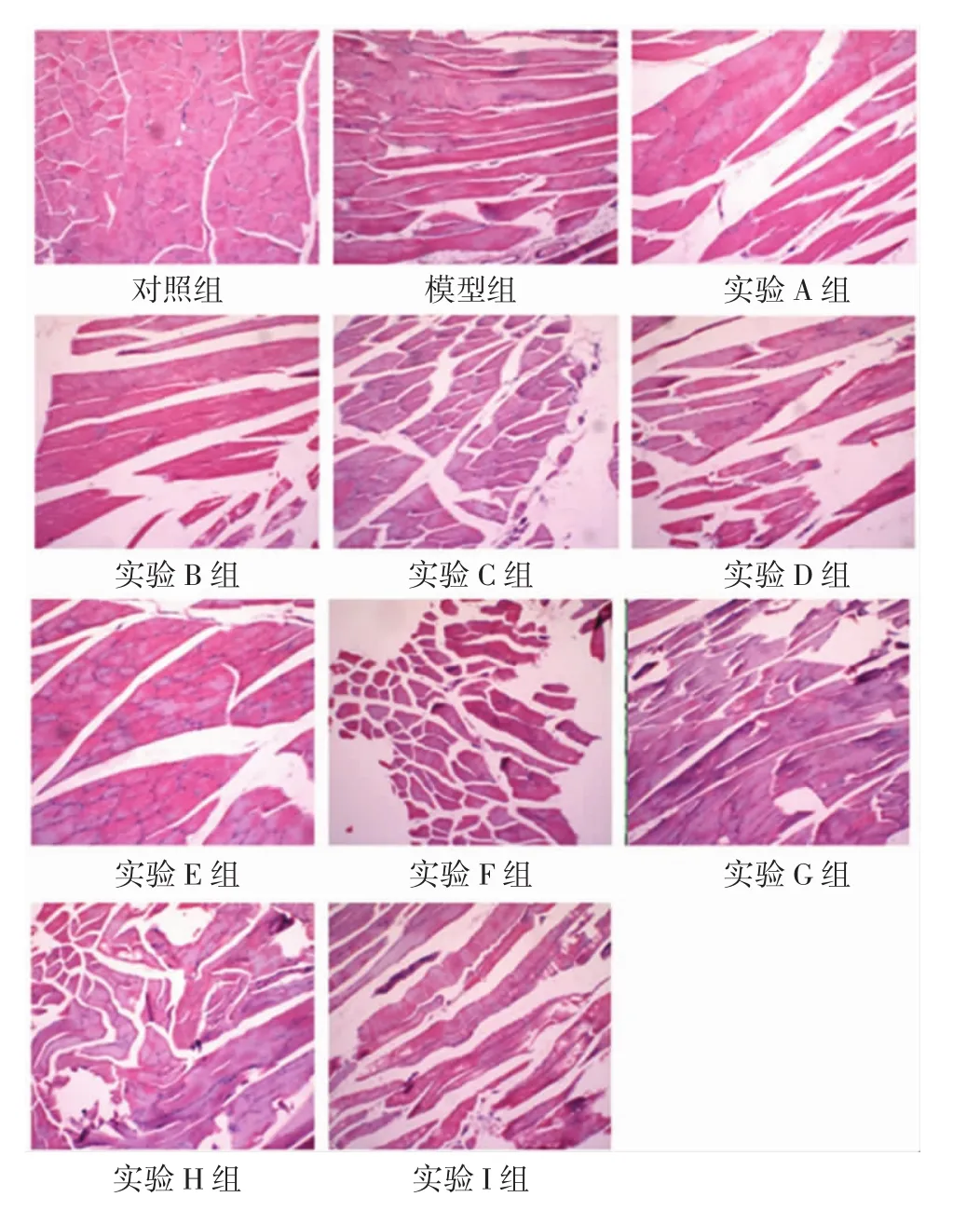
图1 大鼠骨骼肌病理组织学变化Fig.1 Histopathological changes of skeletal muscle among groups of rats
表7 芪茵荷叶饮对大鼠IκB-α和NF-κBp65 mRNA表达的影响()Tab.7 Effect of QYHYY on the expression of IκB-α and NF-κBp65 mRNA among eleven rats()

表7 芪茵荷叶饮对大鼠IκB-α和NF-κBp65 mRNA表达的影响()Tab.7 Effect of QYHYY on the expression of IκB-α and NF-κBp65 mRNA among eleven rats()
注:与模型组比较,*P<0.01。
组别对照组模型组实验A组实验B组实验C组实验D组实验E组实验F组实验G组实验H组实验I组F值动物数10 10 10 10 10 10 10 10 10 10 10 IκB-α NF-κBp65 3.39±4.42 2.12±2.73*0.29±0.45 0.14±0.29 0.14±0.08 0.04±0.03 0.72±2.07 0.81±2.31 0.26±0.24 0.09±0.12 0.77±0.90 0.21±0.29 0.86±1.22 0.36±0.56 4.97±7.18 1.83±2.62 0.02±0.02* 0.01±0.01*5.77±4.79* 2.70±3.45 5.76±6.91 1.74±2.19 51.819* 54.215*
4 讨论
IGT是消渴症的前驱状态,中医称之为脾瘅。《圣济总录·消渴》中记有:“消瘅者,膏粱之疾也,肥美之过,积为脾瘅,瘅病既成。”饮食失节、劳逸失调,则脾运不健,水谷运化失司,痰湿凝聚,燥热内生。因此,按照补气益脾,清热除湿的治疗原则对高脂高糖饮食引起的IGT患者进行干预,可有效预防IGT向T2DM演变。据此自拟芪茵荷叶饮,本方中黄芪性味甘温、归肺、脾经,具有益气补虚功效,现代药理学研究也表明黄芪具有降血糖、降血脂之功效[13],是中医临床常用的降糖组方用药。茵陈蒿,性微寒味苦,归脾、胃、肝和胆经,具有清利湿热之效,研究表明茵陈蒿中的有效化合物β-谷甾醇、槲皮素等可通过多条信号通路作用于靶标蛋白发挥其抗炎、降脂作用[14-15]。荷叶,性微温平味辛,归肝、脾经,清热除湿、利水通便,适用痰湿体质,荷叶具有降脂抗氧化之功效[16]。
本研究通过高糖高脂饮食诱导的方法,成功构建了IGT大鼠模型,造模成功的大鼠出现了血糖升高、糖耐量受损等症状。给予芪茵荷叶饮干预6周后,除实验I组外其余各干预组FPG均有所下降,其中实验 E 组具有统计学差异(P<0.05);干预12周时FPG较干预6周时回升,除实验D组外均超过干预前水平,D组为唯一低于干预前水平组别,说明芪茵荷叶饮对IGT大鼠FPG具有调节作用,可能为高剂量茵陈蒿发挥主要作用,但调节血糖效果不稳定,仍需延长观察时间以确定疗效。FINS水平与胰岛β细胞功能、血糖的稳定以及T2DM发生发展密切相关,研究表明IGT的发生与FINS浓度的进一步增加有关[17]。本研究干预6周时FINS下降,12周时略有回升但均未达到给药前水平,说明芪茵荷叶饮可通过调节FINS改善β胰岛细胞功能。HOMA-IR可以反映胰岛素抵抗状态和胰岛素敏感性,指数随胰岛素抵抗程度增加而升高。本研究中模型组大鼠HOMA-IR上升,出现IR状态,而经芪茵荷叶饮干预6周和12周后,部分实验组HOMA-IR较模型组下降,且除A和B组外均低于给药前水平,说明芪茵荷叶饮在保护胰岛β细胞、改善胰岛功能、减轻胰岛素抵抗方面具有一定功效。
正交实验结果提示,仅不同剂量茵陈蒿对FBG影响存在统计学差异,茵陈蒿取高剂量效果最佳;仅不同剂量黄芪对FINS和HOMA-IR存在统计学差异,黄芪取低剂量效果最佳。荷叶对3项指标的影响均不显著,从经济学角度可取低剂量。综合分析,黄芪为君、茵陈蒿为臣、荷叶为辅,低剂量黄芪、高剂量茵陈蒿配伍低剂量荷叶为最优方案。
本研究病理切片显示模型组大鼠骨骼肌组织水肿、有炎症细胞浸润,说明IGT大鼠骨骼肌存在炎性反应。研究表明,糖尿病前期就可能已经存在炎性反应[18]。骨骼肌是机体慢性炎症发生、发展的重要组织,骨骼肌慢性炎症是T2DM发病的早期分子事件[19]。胰岛素抵抗是IGT的主要表现,长期高脂饮食引起体重增加,可使体内炎性因子分泌增加、炎症信号通路激活,从而诱发胰岛素抵抗,导致骨骼肌稳态失调、肌组织结构受损[20]。
NF-κB是重要转录激活因子,在静息状态下IκBα与NF-κB杂二聚体以结合形式位于细胞质中,抑制NF-κB活化。当机体受到某些外界刺激时,IκBα 磷酸化从 NF-κB 二聚体解离,NF-κB 活化并进入细胞核,调控细胞功能[21]。相关研究表明NF-κB作为机体重要的炎症转录因子,与葡萄糖摄取紊乱及胰岛素抵抗密切相关,其表达水平在糖尿病前期即开始升高[22]。本研究通过NF-κBp65和IκBα基因表达水平来反映NF-κB信号通路的激活状况。本研究中实验G组较M组NF-κBp65蛋白表达水平下降显著,G组为低剂量黄芪+高剂量茵陈蒿+低剂量荷叶,说明此配伍可能会抑制NF-κB信号通路进而减轻炎症反应,与正交实验结果一致。
5 结论
黄芪、茵陈蒿和荷叶三药存在交互作用,按影响主次顺序为黄芪>茵陈蒿>荷叶,最佳配伍为半量黄芪、2倍量茵陈蒿和半量荷叶。此配伍组方可改善IGT大鼠胰岛素抵抗,通过抑制NF-κB信号通路、减轻炎症反应,从而控制或延缓IGT向T2DM演变。

