蒸汽爆破辅助提取油茶籽蛋白及其功能性质分析
张善英,徐鲁平,郑丽丽,艾斌凌,郑晓燕,杨 旸,潘永贵,盛占武
(1.中国热带农业科学院 海口实验站, 海口 570102; 2.海南大学 食品学院, 海口 570228;3.海口市香蕉生物学重点实验室,海口570102)
油茶(CamelliaoleiferaAbel.)是我国特有的重要食用油树种,主要在我国华南地区分布和种植,油茶籽年产量超过2.5亿kg[1]。油茶籽粕是油茶籽提油后主要的副产品,油茶籽粕含有12%~15%的蛋白质[2]。油茶籽蛋白具有较高的经济价值,可用作原料进行发酵生产菌体蛋白饲料[3]和蛋白酶[4]。当前,油茶籽蛋白提取的方法主要有传统碱溶酸沉法、超声辅助提取以及水酶法提取等[5-6],单纯的碱溶酸沉法蛋白质提取率低,酶法主要用于实验室生产,并且酶法和超声处理都存在成本高等缺点。
蒸汽爆破原理是在高温和高压过程中,高饱和蒸汽瞬间释放到环境中并迅速降温,使生物材料受到破坏产生低相对分子质量的化合物,被广泛用于材料预处理。当前蒸汽爆破技术也被应用到蛋白质提取方面,蒸汽爆破可以提高高温豆粕蛋白质提取率,改变蛋白质的理化性质和结构,增强其亲水性[7]。将蒸汽爆破与碱溶酸沉法相结合提取花生蛋白,其蛋白质提取率由41.8%提高到52.6%,并且蛋白质的起泡性、乳化性、持水性等都得到显著提高[8]。
本文将蒸汽爆破技术与碱溶酸沉法结合提取油茶籽中的蛋白质,研究碱溶酸沉提取油茶籽蛋白的工艺条件,并从pH、NaCl浓度、蔗糖浓度、蛋白质量浓度等外在因素方面研究蒸汽爆破前后油茶籽蛋白的功能性质的变化,为油茶籽蛋白在食品中的进一步应用提供参考。
1 材料与方法
1.1 实验材料
油茶籽、大豆油,市售;石油醚(沸程60~90℃)、硫酸铜、硫酸钾、浓硫酸、硼酸、氢氧化钠等,分析纯。
QBS-80 蒸汽爆破机,河南省鹤壁正道生物能源有限公司;UV-1800紫外-可见分光光度计,岛津仪器有限公司;数显恒温水浴振荡器;AL-104型精密电子天平;电热恒温水浴锅;S20K pH计。
1.2 实验方法
1.2.1 油茶籽的蒸汽爆破处理
将干燥油茶籽放入蒸汽爆破机中,在压力0.8~2.3 MPa下处理30~120 s得到汽爆油茶籽。
1.2.2 油茶籽粕的制备
经汽爆处理与未汽爆处理的油茶籽粉碎后过40目筛,用水代法(料液比1∶4.5,pH 9,温度75℃,时间150 min)提取油茶籽油后,将所得的油茶籽粕冷冻干燥,完全收集并保存于-20℃,待分析。
1.2.3 油茶籽蛋白等电点的确定
称取适量未汽爆处理油茶籽粕样品,样品与蒸馏水质量体积比为1∶20,用1 mol/L 的NaOH调其pH至11。在水浴温度40℃下浸提40 min。以8 000 r/min离心10 min后取上清液,用1 mol/L HCl分别将上清液pH调为2.0、2.5、3.0、3.5、4.0、4.5、5.0,静置60 min后离心 (8 000 r/min,10 min),弃上清液,沉淀冷冻干燥后称重。
1.2.4 碱溶酸沉法提取油茶籽蛋白
取适量干燥后的油茶籽粕按一定的料液比加入蒸馏水,用1 mol/L的NaOH 调节pH,在水浴摇床中以不同的温度提取一定时间后,8 000 r/min 离心10 min,用1 mol/L HCl调节上清液的pH至等电点。室温静置沉淀2 h后离心(8 000 r/min,10 min),去除上清液,用去离子水洗沉淀至中性,透析袋透析除杂48 h,冷冻干燥沉淀后得油茶籽蛋白。油茶籽蛋白提取率按下式计算。
油茶籽蛋白提取率=m1/m2×100%
式中:m1为提取的油茶籽蛋白质量,g;m2为原料中油茶籽蛋白质量,g。
1.2.5 油茶籽蛋白吸水性与吸油性分析
吸水性:取0.5 g油茶籽蛋白样品于离心管中,加入10 mL蒸馏水,振荡5 min后静置30 min,8 000 r/min离心15 min,弃上清液,称量试管内容物质量。
吸油性:准确称取0.5 g油茶籽蛋白样品于离心管中,加入5 mL大豆油,振荡5 min后静置30 min,再以8 000 r/min离心15 min,弃上清液,称量试管内容物质量。
1.2.6 油茶籽蛋白起泡性及泡沫稳定性分析
蛋白质量浓度的影响:称取适量油茶籽蛋白样品于100 mL蒸馏水中,使蛋白质量浓度分别为1、2、3、4、5 g/100 mL,调节油茶籽蛋白溶液pH为7。
pH的影响:称取1.0 g油茶籽蛋白于100 mL蒸馏水中,用1 mol/L HCl或NaOH溶液调至不同的pH (2、4、6、8、10)。
NaCl浓度的影响:称取1.0 g油茶籽蛋白样品溶于100 mL pH 7的浓度分别为0、0.1、0.2、0.3、0.4、0.5 mol/L NaCl溶液中。
蔗糖浓度的影响:称取0.5 g油茶籽蛋白,分别加入100 mL 浓度分别为0、3、5、7、9 mol/L的蔗糖溶液,调节pH为7.0。
将上述处理样品于30℃水浴保温静置10 min。然后以8 000 r/min均质2 min,快速测量均质停止时泡沫的体积(V1)。继续在30℃水浴条件下保温,10 min后继续测量泡沫体积(V2)。按下式计算起泡性和泡沫稳定性。
起泡性=V1/100×100%
泡沫稳定性=V2/V1×100%
1.2.7 油茶籽蛋白乳化性与乳化稳定性分析
蛋白质量浓度的影响:称取适量油茶籽蛋白样品于50 mL蒸馏水中,调节蛋白质量浓度分别为1、2、3、4、5 g/100 mL,调节溶液pH为7。
pH的影响:称取0.2 g油茶籽蛋白于50 mL蒸馏水中,用1 mol/L HCl或NaOH溶液调至不同的pH (2、4、6、8、10)。
NaCl浓度的影响:称取0.2 g油茶籽蛋白样品溶于20 mL pH 7的浓度分别为0、0.1、0.2、0.3、0.4、0.5 mol/L的NaCl溶液中。
蔗糖浓度的影响:称取 0.1 g 油茶籽蛋白,分别加入 20 mL浓度分别为0、3、5、7、9 mol/L的蔗糖溶液,调节pH 为7.0。
在上述处理样品中分别加入体积分数为25% 的大豆油,以8 000 r/min搅拌乳化1 min,形成均一的乳化液,立即从底部取50 μL该乳化液,加入5 mL 0.1%的SDS溶液,迅速摇匀后立即测定样品在500 nm波长处的吸光度(A0)(以SDS溶液为空白),10 min后再从底部取50 μL乳化液,稀释同样倍数,测定吸光度(A10)。 乳化性以A0表示,乳化稳定性指数(ESI)按下式计算。
ESI=A10/(A0-A10)×t
式中:t为静置时间,10 min;A0为均质后0 min 乳化液吸光度;A10为均质后10 min乳化液吸光度。
2 结果与分析
2.1 油茶籽蛋白等电点(见图1)

图1 油茶籽蛋白等电点测定结果
由图1可知,当pH在2.0~5.0之间时,油茶籽蛋白的沉淀量随着pH的增大先增大后减小,当pH为3.0时,沉淀量达到最大,为0.443 7 g。因此,确定油茶籽蛋白等电点为3.0。
2.2 油茶籽蛋白提取工艺的研究
2.2.1 料液比对油茶籽蛋白提取率的影响(见图2)
由图2可知,随着料液比的增大,油茶籽蛋白提取率下降。这可能是因为过多的水使油茶籽粕中非蛋白类物质溶出增加,从而影响蛋白质的溶出。经汽爆处理的油茶籽蛋白提取率显著高于未汽爆处理的,这可能是因为蒸汽爆破属于高温高饱和蒸汽过程,破坏了油茶籽的结构,并且瞬时高温有助于促进蛋白质聚集,加剧蛋白质的溶出,提高了蛋白质提取率[9]。

注:pH 11,提取温度40℃,提取时间40 min。与未汽爆处理相比,*为差异显著,P<0.05,**为差异极显著,P<0.01。下同。
图2 料液比对油茶籽蛋白提取率的影响
2.2.2 pH对油茶籽蛋白提取率的影响(见图3)

注:料液比1∶10,提取温度40℃,提取时间40 min。
由图3可知,油茶籽蛋白提取率随着pH的增大先上升后下降,当pH为10时,油茶籽蛋白提取率最大,汽爆处理与未汽爆处理的油茶籽蛋白提取率分别为(63.33±0.67)%和(56.17±1.79)%,随着pH的继续增大,油茶籽蛋白提取率下降。pH过大会使蛋白质变性,颜色加深甚至变黑、产生不良气味[10],并且,当pH过高时,酸沉过程则需要消耗大量的酸,从而产生大量的盐,不利于蛋白质的沉淀分离且增加了提取成本。因此,油茶籽蛋白的最佳提取pH为10。
2.2.3 提取时间对油茶籽蛋白提取率的影响(见图4)
由图4可知,随着提取时间的延长,油茶籽蛋白提取率随之增大,在50 min之前,油茶籽蛋白提取率增幅较大,但当提取时间超过50 min,油茶籽蛋白提取率基本趋于稳定。在提取初期,提取时间短,蛋白没有完全溶出,随着提取时间延长蛋白不断溶出,当蛋白溶出达到一定量,即使时间继续延长蛋白质提取总量不会再发生显著变化。从节约成本角度来看,选择提取时间50 min最为适宜。此时汽爆处理油茶籽蛋白提取率为(68.14±1.68)%,是未汽爆处理的1.20倍。

注:料液比1∶10,提取温度40℃,pH 10。
2.2.4 提取温度对油茶籽蛋白提取率的影响(见图5)
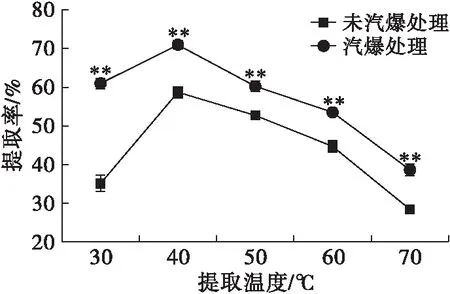
注:pH 10,料液比1∶10,提取时间50 min。
由图5可知,随着提取温度的升高,油茶籽蛋白提取率增加,但超过40℃后油茶籽蛋白提取率下降。随着温度升高提取体系的黏度降低,分子间相互作用减弱从而蛋白质溶出增加;当温度继续升高可能会引起部分蛋白质变性,蛋白质提取率下降,因此选择40℃为最佳提取温度,此时未汽爆处理油茶籽蛋白提取率为(58.74±1.45)%,汽爆处理油茶籽蛋白提取率为(71.01±1.13)%。
综上所述,油茶籽蛋白最佳提取条件为:料液比1∶10,pH 10,提取时间50 min,提取温度40℃。
2.3 油茶籽蛋白功能性质
2.3.1 吸水性和吸油性
蛋白质吸水性和吸油性对食品具有重要意义,可通过油和水以及蛋白的相互作用来改善食品的风味和口感[11]。汽爆处理和未汽爆处理的油茶籽蛋白吸水性分别为(10.8±0.06)g/100 g和(9.35±0.05)g/100 g,吸油性分别为(15.6±0.1)g/100 g和(10.8±0.05)g/100 g,均相对较好。经汽爆处理后,油茶籽蛋白的吸油性和吸水性显著提高,可能是因为蒸汽爆破使更多包裹于蛋白质中的亲水基团和亲脂基团暴露,增加了基团之间与脂质和水之间的作用力。
2.3.2 起泡性与泡沫稳定性
2.3.2.1 pH的影响(见图6)


图6 pH对起泡性与泡沫稳定性的影响
由图6可知,未汽爆处理与汽爆处理油茶籽蛋白起泡性均随着pH的增加而增大。pH在2~4时,起泡性增幅较小,可能是因为在等电点附近时,净电荷量较少,可溶解的蛋白质浓度较低,使得泡沫形成量增幅缓慢。随后,油茶籽蛋白起泡性及泡沫稳定性随着pH的增加而增加,可能是不溶性蛋白质颗粒由于静电作用吸附于气-液界面增加了蛋白质膜的黏性,并且随着pH远离等电点,蛋白质受到分子间的斥力增大,溶解性增加,许多基团暴露出来,蛋白质迅速扩散到气-液界面,降低气泡界面张力[10],从而提高了泡沫稳定性。蒸汽爆破改变了蛋白质的结构,暴露了更多的基团,防止蛋白质在油-水界面展开,从而提高油茶籽蛋白的起泡性和泡沫稳定性[9]。
2.3.2.2 蛋白质量浓度的影响(见图7)
由图7可知,经汽爆处理的油茶籽蛋白起泡性和泡沫稳定性均随着蛋白质量浓度的增大而增大,且大于未汽爆处理的。这可能是因为蛋白质量浓度越高,更多的气泡可能被捕获在蛋白质所形成的柔性界面膜内,越有利于形成稳定的气泡,所形成的蛋白质粘附性也越好,因而有利于提高蛋白质的起泡性和泡沫稳定性[11]。此结果与文献[12]的结果一致。蛋白质量浓度影响起泡性的另一原因可能是所形成的蛋白质气泡与液相相溶之后,迅速吸附到气-液界面发生重排形成稳定薄膜[13],从而提高油茶籽蛋白起泡性和泡沫稳定性。
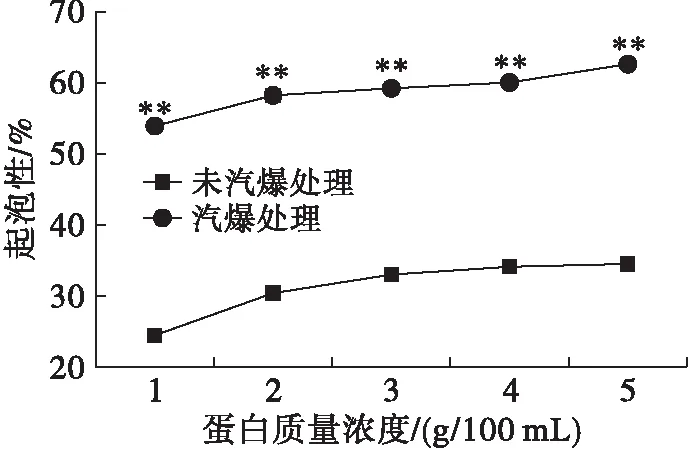

图7 蛋白质量浓度对起泡性与泡沫稳定性的影响
2.3.2.3 NaCl浓度的影响(见图8)


图8 NaCl浓度对起泡性与泡沫稳定性的影响
由图8可知,汽爆处理与未汽爆处理的油茶籽蛋白起泡性均随着NaCl浓度的增加而减小,泡沫稳定性则呈现先上升后下降的趋势,但经汽爆处理的油茶籽蛋白起泡性和泡沫稳定性均大于未汽爆处理的。适当的盐浓度可以产生盐溶作用,但当溶液中离子强度过高时会发生盐析作用,并且高离子强度会对蛋白质产生静电屏蔽作用,使得蛋白质之间静电电荷排斥减小,并导致不溶性聚集体形成,使蛋白质溶解度降低[14],最终导致油茶籽蛋白起泡性和泡沫稳定性降低。
2.3.2.4 蔗糖浓度的影响(见图9)
由图9可知,相对于未汽爆处理的油茶籽蛋白,汽爆处理的油茶籽蛋白起泡性和泡沫稳定性均较高。油茶籽蛋白起泡性随着蔗糖浓度的增加而增大,可能是因为蔗糖的加入使得溶液体系黏度增加,提高了蛋白质的起泡性[15]。油茶籽蛋白泡沫稳定性则呈现先上升后下降的趋势,可能是因为蔗糖浓度较低时,随着蔗糖浓度增加溶液黏度增大,使水与汽泡更难分离,气-液界面膜稳定性增加,产生的泡沫不易消除,因此蛋白质泡沫稳定性增加[16];当蔗糖浓度超过一定范围时,溶液体系黏度太大,蛋白质分子在气-液界面难以展开,使气-液界面膜体积减少,抑制了泡沫的膨胀,从而泡沫稳定性下降。
2.3.3 乳化性与乳化稳定性
2.3.3.1 pH的影响(见图10)


图10 pH对油茶籽蛋白乳化性与乳化稳定性的影响
由图10可知,未汽爆处理与汽爆处理的油茶籽蛋白乳化性和乳化稳定性均呈现先下降后上升的趋势。当pH为4时,接近油茶籽蛋白等电点,蛋白质所带净电荷较少,分子间作用力较小,蛋白质亲水性降低,从而使油-水界面的蛋白质减少,乳化性和乳化稳定性都最低。随着pH继续增大,较大的pH使得埋藏在蛋白质分子内的官能团暴露出来,并且油-蛋白质界面和水-蛋白质界面影响了油-水界面的作用,使蛋白质溶解度增加,参与乳化作用的蛋白质含量增加,使得乳化性和乳化稳定性提高[17]。汽爆处理油茶籽蛋白乳化性和乳化稳定性均高于未汽爆处理的,可能是因为蒸汽爆破属于瞬时高温高压过程,蛋白质发生变性,导致蛋白结构发生改变,更多的疏水基团和亲脂基团暴露,使其乳化性发生改变[9]。
2.3.3.2 蛋白质量浓度的影响(见图11)


图11 蛋白质量浓度对乳化性与乳化稳定性的影响
由图11可知,随着蛋白质量浓度的增加,油茶籽蛋白乳化性快速升高,可能是随着蛋白质量浓度的增加,蛋白质向油-水界面扩散能力增强,蛋白质表面覆盖率提高,形成更多的乳状液,因此乳化性增加[18]。当蛋白质量浓度低于3 g/100 mL时,乳化稳定性随着蛋白质量浓度的增加迅速增加;当蛋白质量浓度大于3 g/100 mL时,乳化稳定性下降。高蛋白质量浓度的乳液相对稳定,液滴之间的空间和静电排斥力增强而防止蛋白质聚集,可以有效地防止增加的界面蛋白质液滴之间的絮凝,提高乳化稳定性。但当蛋白质量浓度高到一定程度时,活化能增加,可以阻止蛋白质迁移,降低蛋白质的有效吸附性,从而使蛋白质的乳化稳定性下降[18]。
2.3.3.3 NaCl浓度的影响(见图12)


图12 NaCl浓度对乳化性与乳化稳定性的影响
由图12可知,NaCl 的添加使油茶籽蛋白乳化性和乳化稳定性先升高后下降,当NaCl浓度为0.2 mol/L时,乳化性最高,NaCl浓度为0.1 mol/L时,乳化稳定性最高。NaCl浓度较低时,蛋白质的展开度增加,提高了蛋白质溶解度,油-水界面的蛋白质浓度增加,发生了盐溶效应。随着NaCl浓度的继续增加,乳化性和乳化稳定性下降,原因可能是NaCl浓度增大,蛋白质表面电荷减少[19],蛋白质之间静电斥力减小,降低油-水界面的稳定性,使蛋白质乳化性和乳化稳定性降低。因此,一定浓度的NaCl有助于提高油茶籽蛋白的乳化性和乳化稳定性。
2.3.3.4 蔗糖浓度的影响(见图13)


图13 蔗糖浓度对乳化性与乳化稳定性的影响
由图13可知,随着蔗糖浓度增大,油茶籽蛋白乳化性和乳化稳定性均呈上升的趋势,并且汽爆处理的油茶籽蛋白乳化性和乳化稳定性大于未汽爆处理的。其原因可能是蔗糖的添加使得水相介质流变性改变,乳化体系黏度增加,稳定性增强,并且蔗糖可以阻碍蛋白质的聚集、巩固胶束结构,有利于蛋白质的乳化,且蔗糖可以在油-水界面形成膜,膜的稳定性是影响乳化性和乳化稳定性的主要原因[20]。因此,蔗糖的添加能够改善油茶籽蛋白的乳化性和乳化稳定性。
3 结 论
蒸汽爆破结合碱溶酸沉法可以提高油茶籽蛋白提取率,经蒸汽爆破处理(压力0.8~2.3 MPa,时间30~120 s)后最佳碱溶酸沉提取条件为料液比1∶10、提取温度40℃、pH 10、提取时间50 min。在最佳条件下,油茶籽蛋白提取率为71.01%,比未蒸汽爆破处理的提高了12.27个百分点,且蛋白质产品的功能性质得到提高。pH、蛋白质量浓度、NaCl浓度均对油茶籽蛋白的起泡性和泡沫稳定性、乳化性和乳化稳定性有不同程度的影响;蔗糖浓度对油茶籽蛋白起泡性作用较明显,但对泡沫稳定性无改善作用,其对蛋白质的乳化性与乳化稳定性起改善作用。蒸汽爆破具有低耗、无污染、工作效率高、提取效率高以及提高物料功能性质等优点。因此,通过本研究可以对油茶籽蛋白在食品中的进一步应用具有一定的指导意义。

