中国红豆杉植株再生体系优化
王 威,白江平,王 清,黄惠英
(1.甘肃农业大学农学院,甘肃 兰州 730070; 2.甘肃农业大学生命科学院,甘肃 兰州 730070)
中国红豆杉(Taxuswallichianavar.chinensis)为红豆杉科红豆杉属常绿乔木。红豆杉属植物,全世界有11 种,中国原产有4个种1个变种,即中国红豆杉(中国特有物种)、东北红豆杉、云南红豆杉、西藏红豆杉、南方红豆杉(变种)。红豆杉是植物界的活化石,国家一级重点保护珍稀濒危植物。从红豆杉中提取的紫杉醇及其衍生物是目前世界上公认的广普、高活性抗癌药物,被称为“晚期癌症的最后一道防线”[1-2]。
从一棵红豆杉树皮中提取的紫杉醇含量仅为0.01%~0.05%。治疗一个癌症病人需要3~6棵100年的红豆杉树皮用于提取紫杉醇子[4]。红豆杉在自然条件下生长缓慢,再生能力差,种子处于深休眠状态,需经两冬一夏才能萌发,发芽率低[5]。人工繁殖主要靠扦插和种子育苗移栽等方法[6-8],但繁殖速度较慢,繁殖材料利用率低,无法满足紫杉醇提取所需用的原料[9]。利用组织培养技术工厂化生产红豆杉种苗,再进行人工栽培,是解决紫杉醇原料短缺的途径之一[10]。
近年来有关红豆杉的研究主要集中在人工种植,组织和细胞培养[10-13],微生物和基因工程[14-16],遗传转化[16],紫杉醇的合成、化学提取等方面[16-17]。通过寻找最优化的愈伤组织诱导培养基和愈伤组织分化培养条件,建立高效的植株再生系统及组培体系,以期为中国红豆杉基因工程的遗传转化,组培生产大量的愈伤组织或悬浮细胞,从中提取紫杉醇提供技术参考。
1 材料和方法
1.1 材料
试验用的中国红豆杉枝条采自甘肃省陇南市徽县,2016年6月剪取8年龄当年生的嫩枝。中国红豆杉的试管苗由甘肃农业大学农学院组培实验室提供。
1.2 方法
1.2.1 外植体的灭菌处理及培养 将采回来的枝条剪去叶片后剪切成2~4 cm长的段,每段带2~3个侧芽,先用洗衣粉溶液浸泡10~15 min,再用自来水冲洗40 min,在超净工作台上,用75%的乙醇浸泡30 s后用15%的84消毒液浸泡12~15 min,再用0.1%的HgCl2消毒6~10 min,无菌水冲洗4~5次,然后接种到WPM附加植物生长调节剂2-ip,6-BA和NAA的初代培养基上。培养条件在25±2℃,16 h/d、1 600~2 000 lx光照条件下培养。
1.2.2 愈伤组织诱导和芽分化培养 将试管苗的叶片剪为长0.5 cm的小片,茎剪切成1 cm小段,分别接种到愈伤组织诱导的10种培养基(接种时茎段平放于培养基上,叶片的上表皮面与培养基接触)。每瓶培养基上接种10块,每个处理接种3瓶,每个处理设3个重复。将接种好材料的三角瓶和培养皿置于人工气候箱,在(25±1)℃、12 h/d、1 600 lx光照条件下进行培养。培养10 d后观察出愈时间,30 d后统计愈伤组织诱导率,50 d后统计芽分化率和出苗的情况。
出愈率=愈伤化外植体数/总接种外植体数×100%
分化率=分化出芽愈伤组织数/总愈伤组织数×100%
各处理,各阶段培养所用的培养基,全部以WPM为基本培养基,附加AC 0.3%、蔗糖3%、琼脂0.6%,pH 5.8。
1.2.3 试验设计及数据处理 试验设计和数据处理采用《农业田间试验统计分析软件》[18]。
1.3 选择试验因素确定上、下线水平
根据红豆杉组织和细胞培养等相关文献报道[16-17],以3种外源激素最高使用浓度为上限,以不使用为下限进行设计(表1)。

表1 3种外源激素使用浓度上、下界值
1.4 外源激素NAA,6-BA和2-ip配比组合及浓度实际值
为了减轻工作量,试验对3种外源激素浓度和不同配比采用了三因子D-饱和最优设计[19]。根据3种外源激素使用的浓度上、下界值,计算浓度梯度的变化区间,再按照三因素D-饱和最优设计表配置出10种组合(表2)。
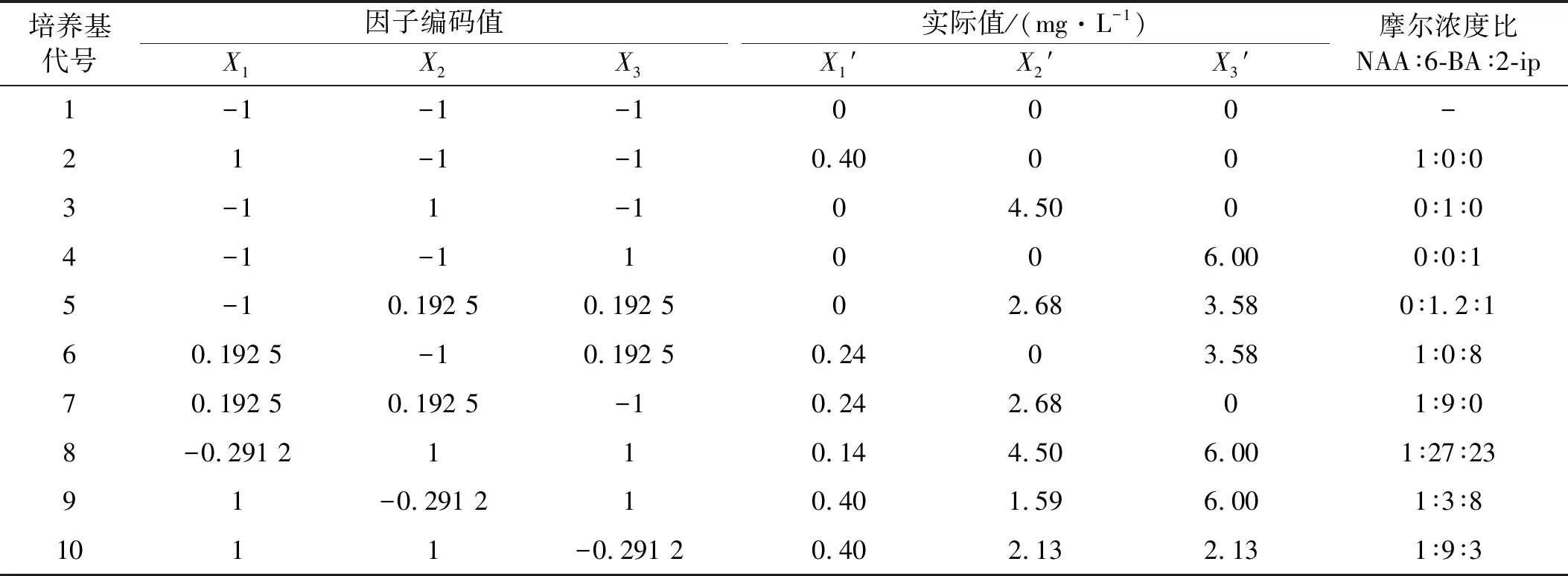
表2 各培养基3种外源激素组合编码及实际值
1.5 结果统计分析
统计资料采用多元回归分析,即先建立结构矩阵,解线性方程组得到相关矩阵和解。当回归模型通过拟合性检验后,利用回归方程寻求优化的因子组合,以获得外源激素浓度和配比的优化组合。
2 结果与分析
2.1 不同的外源激素浓度配比对中国红豆杉试管苗茎段愈伤组织及分化成苗的影响
将中国红豆杉试管苗的茎段和叶片分别接种到10种6-BA,NAA和2-ip不同浓度配比的WPM培养基上,30 d后统计愈伤组织诱导率,50 d后统计分化率(表3)。
运用多元二次数学模型Y=b0+∑bjXj+∑BijX1X3+∑BijXj2,对试管苗茎段的愈伤组织诱导率、芽分化率、根诱导率进行统计,分别得到三元二次回归方程:
Y(s愈)=0.930-0.037X1-0.039X2-0.035X3-0.039X1X2-0.016X1X3-0.008X2X3-0.074X12-0.04X22-0.030X32
(r=0.946 6,f=83.932)
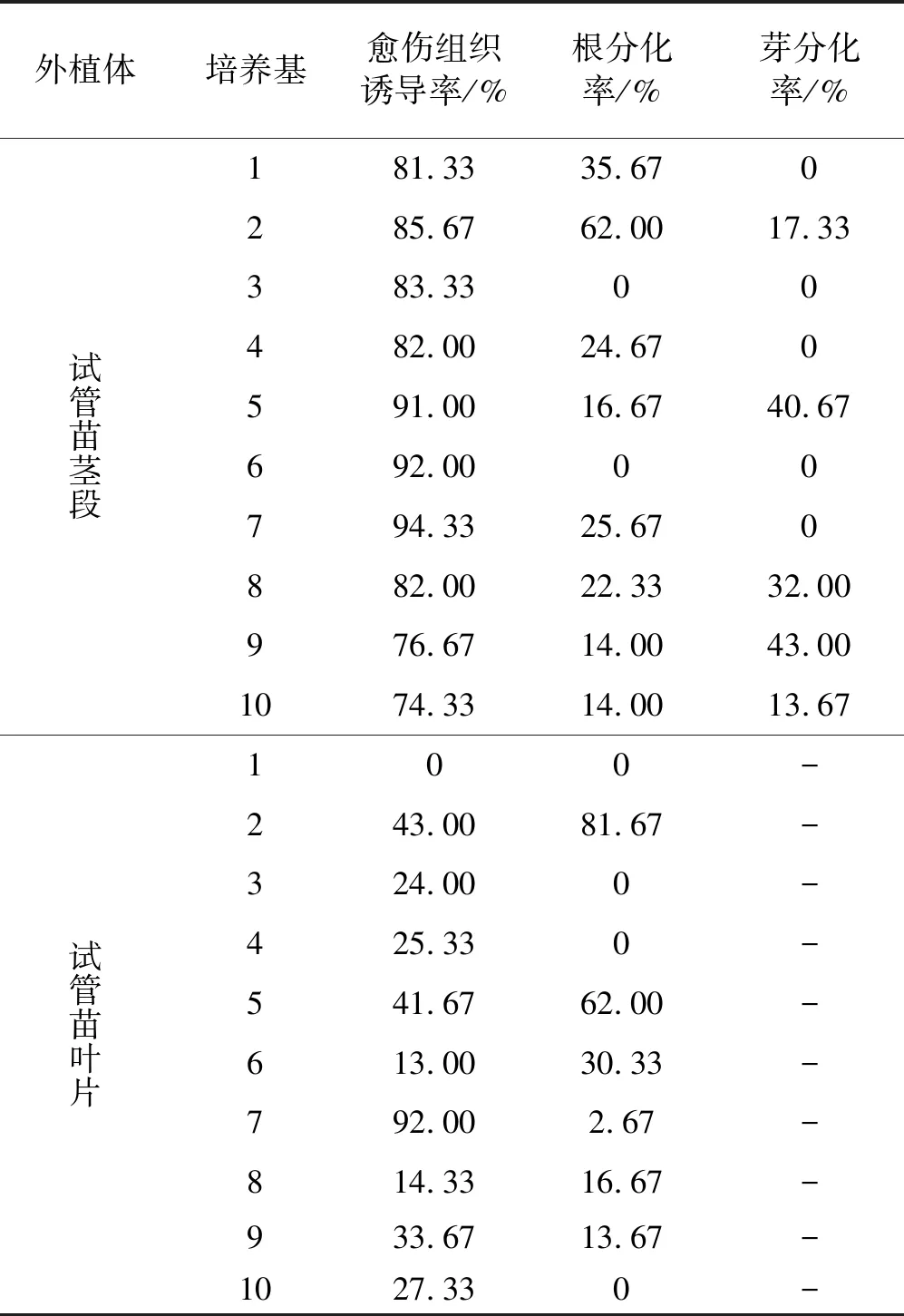
表3 3种外源激素浓度配比下中国红豆杉试管苗茎段愈伤组织诱导率及分化成苗率
Y(S根)=0.046-0.027X1-0.037X2-0.049X3-0.012X1X2-0.125X1X3-0.128X2X3-0.128X12-0.056X22-0.154X32
(r=0.987 6,f=90.521)
Y(S芽)=0.930-0.037X1-0.039X2-0.035X3-0.039X1X2-0.016X1X3-0.008X2X3-0.74X12-0.047X22-0.030X32
(r=0.946 6,f=83.932)
由于试管苗的叶片培养均未发生芽分化,因此只对不同外源激素浓度和配比对叶片愈伤和生根的影响效应进行多元回归分析,得到三元二次方程:
Y(1愈)=0.611-0.041X1-0.008X2-0.089X3- 0.006X1X2-0.181X1X3-0.032X2X3-0.180X12-0.377X22-0.187X32
(r=0.992 9,f=154.749)
Y(1根)=0.129-0.018X1-0.091X2-0.038X3-0.237X1X2-0.184X1X3-0.146X2X3-0.128X12-0.056X22-0.154X32
(r=0.9879,f=90.521)
2.2 D-饱和最优设计对中国红豆杉茎段培养的不同外源激素浓度和配比寻优
利用回归方程寻优,得到中国红豆杉试管苗茎段、叶片愈伤组织诱导、芽、根分化的3种外源激素使用浓度较优组合(表4)。
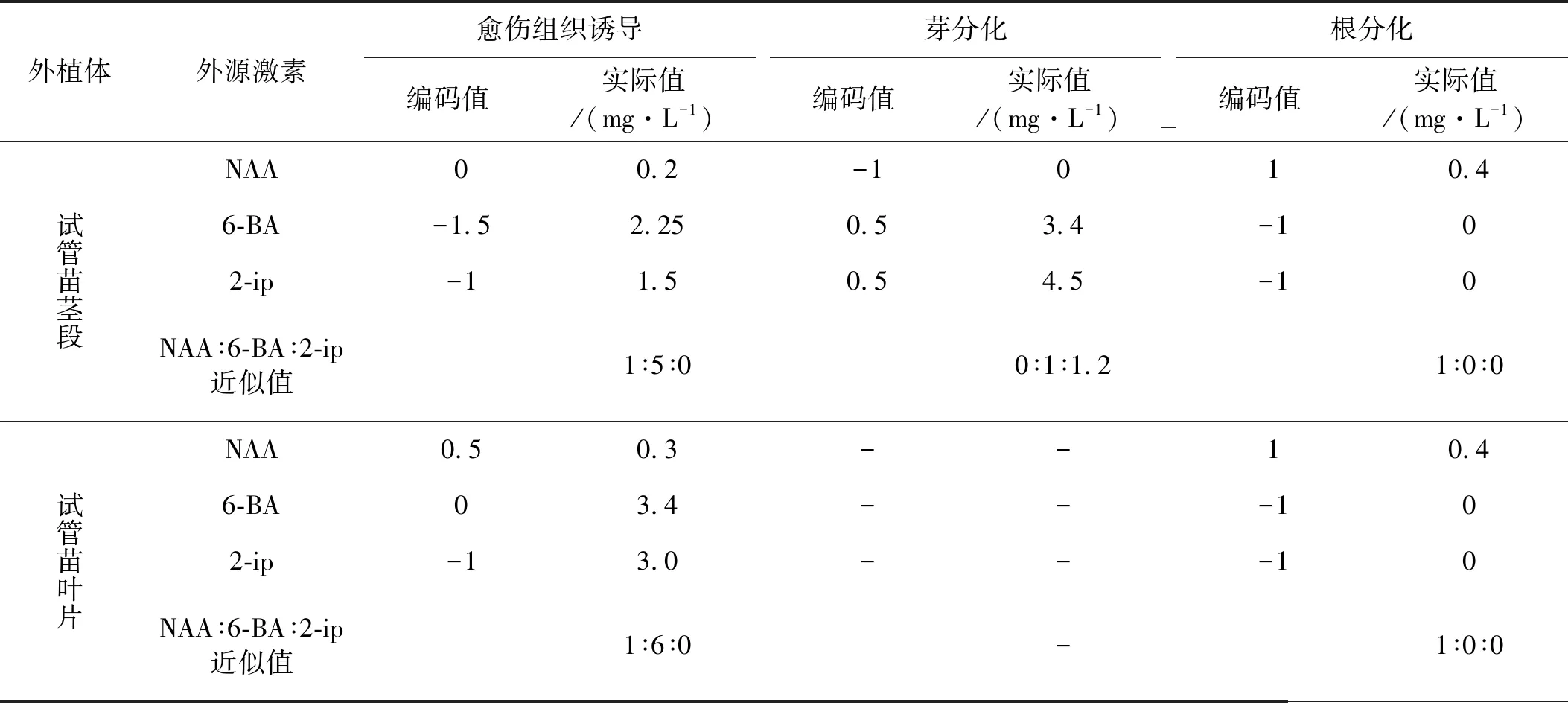
表4 D-饱和最优设计对中国红豆杉茎段培养的3种外源激素浓度和配比寻优
结果表明,在培养基WPM中添加了NAA 0.2 mg/L、6-BA 2.25 mg/L、2-ip 1.5 mg/L,当生长素/细胞分裂素摩尔浓度比为1∶5时,有利于茎段脱分化形成愈伤组织;(2)在培养基WPM中只添加NAA 0.4 mg/L对根分化有利;(3)在培养基WPM中只添加6-BA 3.4 mg/L与2-ip 4.5 mg/L,不加NAA,当两种激素摩尔浓度比为1∶1.2时,有利于芽分化;(4)在培养基WPM中添加NAA 0.3 mg/L和6-BA 3.4 mg/L、2-ip 3.0 mg/L,摩尔浓度比增大到(1∶6)时,有利于叶片脱分化形成愈伤组织。
3 讨论
(1)组织培养技术是生物工程技术的基础,在红豆杉细胞培养和基因工程的遗传转化工作中建立好的植株再生体系主要依赖于植物组织培养技术,与一般的植物组织培养相比要求更高,内容更加复杂。首先要有一个高频的再生系统,其中包括外植体的选择,最佳培养基和适宜品种的确定等。试验对中国红豆杉试管苗的茎段及叶片的再生能力进行了研究,经过试验对比,初步确定试管苗茎段是比较容易再分化的材料,具有生长状况易于确定,诱导率高、分化能力较强的突出特点,试验结果与Wang G Y等[20]的研究基本一致。用试管苗叶片诱导出来的愈伤组织容易死亡,再生能力差,试验结果与甘烦远等[21]的研究结论相似。因此,用叶片作细胞培养和遗传转化的受体材料有待进一步研究。
(2)好的细胞培养和植株再生体系的基础是筛选出好的培养基。红豆杉组织培养技术研究始于20世纪80年代,文献报道的培养基配方中的基本成分大部分是MS或B5等[21-22],在试验中变化最多的是植物生长调节剂,尤其是生长素和细胞分裂素[23]。通常筛选最佳培养基配方采用的方法是将激素设计为系列浓度,然后组配所有可能的组合,进行培养筛选。如果将这一方法应用到细胞培养和遗传转化体系的培养基筛选中工作量很大。为了得到可靠的试验数据,在试验中快速、准确的设计和处理大量的数据,可采用三因素D-饱和最优设计方法。采用了以WPM为基本培养基,附加0.3% AC、3%蔗糖、0.6%琼脂,pH 5.8,针对6-BA,2-ip和NAA,用三因素D-饱和最优设计配置10个组合,筛选出了适合诱导茎段和叶片愈伤组织的培养基,茎段愈伤组织分化芽的培养基和生根培养基。
4 结论
对植物生长调节剂6-BA,2-ip和NAA应用三因素D-饱和最优设计方法,在配置的10个组合培养基中筛选出了WPM +6-BA 2.25 mg/L+2-ip 1.5 mg/L+NAA 0.2 mg/L为最适合诱导茎段愈伤组织的培养基。WPM+6-BA 3.4 mg/L+2-ip 3.0 mg/L+NAA 0.2 mg/L为叶片最适合诱导愈伤组织的培养基;WPM+6-BA 3.4 mg/L+2-ip 3.0 mg/L为最适合茎段愈伤组织分化芽的培养基,WPM+NAA 0.4 mg/L为适合的生根培养基。
从试管苗茎段和叶片的再生能力比较试验中发现,用叶片诱导出来的愈伤组织,随着培养时间的延长和继代次数的增加,愈伤组织逐渐变黑死亡,未能分化出芽。初步判断试验中筛选的培养基适合试管苗茎段的植株再生培养,而不适合叶片的植株再生培养。

