微波消融联合吉非替尼治疗表皮生长因子受体突变晚期肺腺癌
于 波,李春海
(1.桓台县人民医院肿瘤科,山东 淄博 256400;2.山东大学齐鲁医院放射介入科,山东 济南 250014)
肺癌是目前全世界发病率及死亡率最高的恶性肿瘤之一,通常分为小细胞肺癌(small cell lung cancer, SCLC)和非小细胞肺癌(non-small cell lung cancer, NSCLC),其中NSCLC占80%左右,包括腺癌、鳞癌及大细胞癌等。近年来,肺腺癌发病率升高,约占NSCLC的50%[1]。肺腺癌早期无特异性临床症状,确诊时多数已为晚期,失去根治性手术机会,单一治疗方法各有其局限性,患者总体生存率较低[2]。本研究探讨微波消融联合分子靶向药物吉非替尼治疗表皮生长因子受体(epidermal growth factor receptor, EGFR)突变的晚期肺腺癌患者的临床效果。
1 资料与方法
1.1 一般资料 选取2016年8月—2018年9月桓台县人民医院收治的110例EGFR突变晚期肺腺癌患者,男54例,女56例,年龄27~64岁,平均(46.5±17.1)岁。纳入标准:经纤维支气管镜或穿刺活检病理明确诊断,具有可测量病灶;临床分期为ⅢB期或Ⅳ期(排除可手术的寡转移),不能手术切除;高通量测序证实存在EGFR突变(包括G719/A/C/S、19外显子插入缺失、L858R、L861Q突变等);患者体力状况评分0~2分,预计生存期>3个月。排除血液系统疾病、急性心脑血管疾病、严重精神疾病及肝肾功能不全等患者。
采用随机数字法将110例患者分为治疗组和对照组,每组55例,2组患者性别、年龄及肿瘤最大径、临床分期、分化程度、远处转移部位差异均无统计学意义(P均>0.05),见表1。
1.2 仪器与方法 采用Siemens Somatom 64排CT机为引导设备,管电流250 mAs,管电压120 kV。对治疗组行CT引导下微波消融肺部肿瘤联合吉非替尼(Gefitinib,AstraZeneca,国药准字J20100014)治疗。于微波消融前5 min肌内注射镇痛药物及止吐药物取选取适当体位,根据CT所示肿瘤大小、形态确定消融点数量及部位;常规消毒皮肤,将消融针穿入消融部位,与微波治疗仪连接后加热,根据肿瘤位置、大小等具体情况确定治疗时间及功率;操作结束后关闭治疗仪,拔出体内电极针;2~3天后给予口服吉非替尼[250 mg/(次·天)]。对照组仅口服吉非替尼[250 mg/(次·天)]治疗。2组均给予长期口服吉非替尼,至病情进展或患者不良反应严重时停用。
对存在颅脑多发转移者给予全脑放射治疗,对骨转移者根据具体情况给予相应治疗(放射治疗、骨水泥等)。治疗期间监测2组患者血液生化指标,定期检测心电图及胸部CT,如出现并发症、不良反应,则给予相应治疗。
1.3 指标观察 统计并对比2组疗效及不良反应。所有患者均于治疗6个月后复查CT进行疗效评价,疗效评价参照实体肿瘤疗效评价标准(response evaluation criteria in solid tumors, RECIST)(2000年),分为完全缓解(complete response, CR)、部分缓解(partial response, PR)、稳定(stable disease, SD)、进展(progressive disease, PD)。有效为CR+PR,疾病控制为CR+PR+SD。统计治疗6个月期间出现的不良反应,如皮疹、腹泻、肝肾功能异常、胸痛、发热和气胸等。
1.4 统计学分析 采用SPSS 19.0统计分析软件。计量资料以±s表示,组间比较采用t检验;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
治疗6个月后,治疗组CR 12例、PR 32例、SD 7例、PD4例,临床有效率为80.00%(44/55),疾病控制率92.73%(51/55),见图1;对照组CR 9例、PR 24例、SD 10例、PD 12例,临床有效率为60.00% (33/55),疾病控制率78.18%(43/55);治疗组临床有效率及疾病控制率均高于对照组(χ2=5.238、4.681,P=0.022、0.031)。
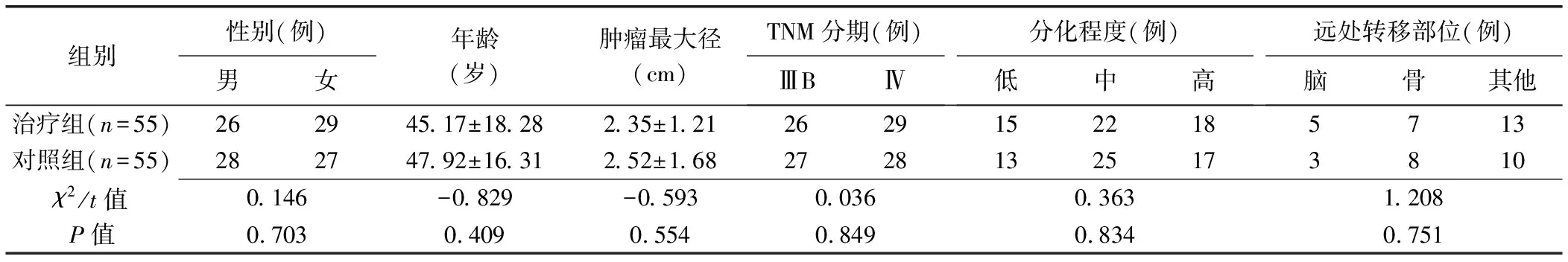
表1 2组患者一般资料比较
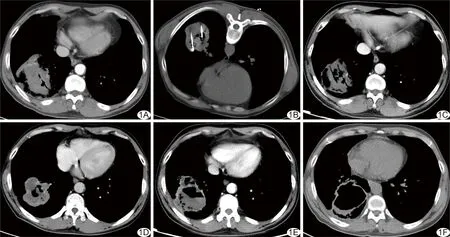
图1 治疗组患者,男,46岁,低分化腺癌(T4N2M0,ⅢB期) A.治疗前CT图像; B.双针60 W多点微波消融; C.消融治疗6 min后,病灶中心可见低密度区; D.消融治疗后1个月,CT示病灶缩小,空洞形成; E.消融治疗后3个月,CT示肿瘤空洞较前增大,其内可见坏死,周边强化; F.消融治疗后6个月,CT示肿瘤壁明显变薄,内有大空洞形成,疗效评价PR
治疗期间,治疗组出现5例气胸(4例少量气胸,未予特殊处理,1例胸腔闭式引流24 h后恢复正常),咯血8例、胸痛8例、发热14例、皮疹23例、腹泻8例、肝功能异常6例;对照组未见气胸,咯血3例、胸痛5例、发热3例、皮疹25例、腹泻7例、肝功能异常7例;治疗组气胸、咯血、胸痛及发热发生率均高于对照组(χ2=5.238、4.352、5.434、8.419,P=0.022、0.037、0.041、0.004),但2组腹泻、皮疹、肝功能异常例数差异均无统计学意义(χ2=0.077、0.148、0.087,P=0.781、0.701、0.768))。
3 讨论
肺癌患者5年生存率不足20%[3],初诊时多已是晚期病变而失去手术治疗机会,临床通常采用放射治疗、化学治疗、靶向治疗、免疫治疗及消融等措施来控制肿瘤进展。将消融等局部治疗方法与全身治疗相结合,进而提高治疗效果、改善患者生活质量并延长生存期,是临床治疗的主要目标和发展方向。本研究探讨CT引导下微波消融联合分子靶向药治疗EGFR突变的晚期肺腺癌的临床疗效。
EFGR在人体内广泛表达,在肿瘤生长、转移过程中起重要作用。吉非替尼作为一种EFGR-酪氨酸激酶抑制剂(tyrosine kinas inhibitor, EGFR-TKI),通过竞争EGFR催化区域上的Mg-ATP结合位点而阻断EGFR磷酸化,抑制肿瘤细胞生长、增殖及血管形成,促进肿瘤细胞凋亡[4-5]。对于存在EGFR突变的肿瘤患者,目前建议采用EGFR-TKI进行治疗。既往研究[6-7]显示,口服吉非替尼治疗EGFR突变的晚期肺腺癌(ⅢB~Ⅳ期)的有效率为50%~66%。
微波消融是在影像学技术引导定位下将消融针置入消融部位,通过微波治疗仪使组织中的水分子高速振动进而产生热能,组织中心温度可迅速上升至110℃,边缘组织温度则可达60℃,使细胞内蛋白质变性坏死。作为一种微创治疗技术,微波消融对于无法手术的肺癌患者是安全、有效的局部治疗手段[8-9],其常见并发症包括胸痛、气胸、咯血及发热等。出现胸痛的主要原因是治疗过程中损伤了胸膜,以及消融肿瘤组织及正常肺组织凝固性坏死产生炎性刺激等。治疗后发生气胸的主要原因是穿刺造成的肺及胸膜损伤,术后患者呼吸动度过大或剧烈咳嗽也可导致气胸。张肖等[10]对102例肺腺癌患者的128个肺转移病灶进行消融,仅极少数出现大量气胸者需要进行胸腔闭式引流,而少量气胸、胸痛、发热等症状经对症治疗后会很快缓解。本研究治疗组中,5例在穿刺过程中出现气胸,其中4例为少量气胸,1例于胸腔闭式引流24 h后恢复正常;胸痛8例、咯血8例、发热14例,经对症处理后均于48 h内恢复正常;虽然并发症发生率总体高于对照组,但均在可控范围内,提示微波消融治疗的安全性较好。本研究2组皮疹、腹泻及肝功能异常发生率差异均无统计学意义,考虑为应用吉非替尼所致。
张晶等[11]应用物理消融、化学消融以及放射性粒子植入联合治疗肺癌, 6个月后PR率为88.46%,疾病控制率达94.87%,疗效显著。本研究中经微波消融联合吉非替尼全身治疗6个月后治疗有效率为80.00%,疾病控制率为92.73%,临床效果较好,优于单独应用吉非替尼治疗。微波消融术是一种有效的局部治疗手段,消融后原发肿瘤细胞活性降低、坏死,肿瘤负荷下降,患者免疫抑制被解除[12];微波消融还可影响某些肿瘤生长因子的水平,刺激机体产生抗肿瘤免疫[13],坏死的肿瘤组织释放可溶性肿瘤抗原,后者刺激机体产生特异的免疫抗体,提高机体细胞免疫功能[14-15],联合应用吉非替尼后有效率提高。
本研究的局限性:样本量较少,病例选择可能存在人为选择偏倚;观察时间较短,未统计无进展生存时间及总生存期。
综上所述,CT引导下微波消融局部治疗联合吉非替尼全身治疗可提高对于EGFR突变晚期肺腺癌患者的近期治疗效果,是一种安全、有效、值得推广使用的临床治疗模式,但其远期治疗效果及对患者总生存期的影响尚需进一步观察。