苦豆子赖氨酸脱羧酶基因启动子在拟南芥中的表达分析
陆姗姗,洪园淑,刘萍*
(1.宁夏优势特色作物现代分子育种重点实验室,宁夏 银川 750021;2.宁夏大学农学院,宁夏 银川 750021; 3.青岛求实职业技术学院,山东 青岛 266109)
启动子位于结构基因5′端上游,是调控基因准确表达和有效转录所必需的结构,通过对下游基因表达时期与表达量的调节,决定植物完成特殊生长发育阶段的转变或应答特殊环境胁迫,因而具有转录起始的特异性[1]。为获得精确稳定的结果,在研究启动子功能时往往采用转基因遗传表达的方法,分析不同条件下转基因植株中报告基因的表达水平以确定启动子的表达活性与特性[2]。Gu等[3]克隆获得玉米(Zeamays)的ZmGLU1启动子,遗传转化至烟草(Nicotianatabacum)中发现该启动子可在烟草根部高效表达;裴柳玲等[4]研究发现水稻(Oryzasativa)胁迫相关的OsPM1启动子遗传转化拟南芥(Arabidopsisthaliana)后,在受高盐、低温和干旱诱导下均可影响外源基因的表达;李英华等[5]将大豆(Glycinemax)GmGBP1启动子片段(含光响应元件TCT-motif位点变异SNP-796G)与双萤光素酶(luciferase,LUC)报告基因融合构建植物表达载体并转化烟草,瞬时表达结果显示,在短日照条件下,SNP-796G会导致TCT-motif光效应元件变异,引起LUC显著上调表达,推测对缩短大豆生育期有作用。
赖氨酸脱羧酶(lysine decarboxylase, LDC)的主要生物学功能是催化赖氨酸脱羧生成尸胺(cadecine, Cad),在植物生长发育和抗逆性等方面发挥重要作用[6-8],也是属于喹诺里西啶类生物碱(quinolizidine alkaloids, QAs)的氧化苦参碱(oxymatrine, OMA)(又称苦参素)和苦参碱(matrine,MA)生物合成途径的第一个关键酶[9-10],杨毅等[11-12]克隆了苦豆子(Sophraalopecuroides)赖氨酸脱羧酶基因的蛋白质编码区序列SaLDC,发现该基因的表达和OMA的积累呈正相关关系,并且SaLDC的表达和OMA的积累均受干旱胁迫的影响。本实验室在已有苦豆子SaLDC编码区的基础上,步移克隆得到该基因上游的启动子序列,并将长度不同的启动子5′端缺失片段分别与GUS报告基因融合,农杆菌介导遗传转化苦豆子愈伤组织,结果显示不同长度的SaLDC启动子片段均可驱动GUS在苦豆子愈伤组织中瞬时表达,但启动活性随5′缺失片段长度的增加而逐渐减弱[13]。为进一步验证SaLDC启动子的功能,本研究开展生物信息学分析,并将含有该启动子的重组表达载体遗传转化拟南芥,开展时空和组织特异性表达以及光照和干旱诱导研究,不仅为该启动子顺式作用元件的研究提供依据,还有助于从分子水平探讨该基因调控表达的机制,为研究SaLDC在OMA生物合成途径中的作用奠定基础。
1 材料与方法
1.1 材料
拟南芥生态型为哥伦比亚野生型(Columbia),由北京市农林科学院农业生物技术研究中心谢华教授惠赠。
1.2 试剂
根癌农杆菌(Agrobacteriumtumefaciens)EHA 105和pBI 121质粒载体由本实验室保存;Taq DNA聚合酶(TaKaRa);T4DNA连接酶和限制性核酸内切酶HindIII、BamHI(NewEngland Biolabs, NEB);pEASY-T1 simple Cloning Kit和大肠杆菌TOP 10感受态(TransGen Biotech);质粒提取试剂盒(天根生化科技有限公司,北京);Silwet L-77(GE Healthcare Bio-Sciences AB);4-甲基伞形酮(4-Methylumbelliferone,4-MU)(世纪奥科生物技术有限公司);DNA胶回收试剂盒、β-葡萄糖苷酸酶(β-glucuronidase,GUS)、5-溴-4-氯-3-吲哚-β-D-葡萄糖苷酸(5-bromo-4-chloro-3-indolyl-β-D-glucuronide,X-Gluc)、4-甲基伞形酮-β-D-葡萄糖醛酸苷(4-Methylumbelliferyl-β-D-glucuronide,4-MUG)、TritonX-100以及所有引物合成和测序工作均购自生工生物工程(上海)股份有限公司或由其完成,其他试剂为进口或国产分析纯。
1.3 方法
1.3.1SaLDC启动子的克隆、序列分析和表达载体构建 在本实验室已有SaLDC编码区基础上,设计巢式PCR特异引物和简并引物,以苦豆子基因组DNA为模板,通过两次步移,去掉重叠片段拼接后,获得SaLDC启动子片段。目标片段经1.2%琼脂糖凝胶电泳检测、回收纯化后连接至pEASY-T1 simple载体,经转化、蓝白斑和氨苄青霉素(ampicillin,Amp)抗性平板筛选出阳性克隆并测序,测序后的片段用PLACE数据库(http://www.dna.affrc.go.Jp/htdocs/PLACE/)和PlantCARE数据库(http://bioinformatics.psb.μgent.be/webtools/plantcare/html/)进行SaLDC启动子序列顺式作用元件预测。
提取含SaLDC启动子片段的T载体质粒DNA,通过Primer Premier 5.0软件对SaLDC启动子序列进行酶切位点分析,在序列的上下游引物5′端分别设计插入HindIII(AAGCTT)和BamHI(GGATCC)酶切位点,双酶切质粒DNA,回收并验证目的片段,同时双酶切pBI 121质粒,用目的片段代替其中35S启动子,T4DNA连接酶连接后得到SaLDC启动子片段的重组表达载体,导入大肠杆菌TOP 10,经卡那霉素(kanamycin,Kan)筛选获得的阳性克隆经双酶切验证后,重组质粒遗传转化至农杆菌EHA 105。
1.3.2拟南芥种植和农杆菌介导的蘸花法遗传转化拟南芥 拟南芥种子经5% NaClO和75%乙醇除菌处理,接种于MS培养基中,并于4 ℃冰箱内春化3~4 d后转到(22±1) ℃的人工气候箱内,16 h光照/8 h黑暗条件下生长,待4~6片叶时移栽到营养土中。
将1.3.1构建好含SaLDC启动子片段表达载体的农杆菌单克隆于含Kan(50 mg·L-1)的LB液体培养基中28 ℃培养至A600=0.8~1.5,收集菌体,用侵染缓冲液(1/2 MS+5%蔗糖+0.02% Silwet L-77)悬浮菌体至A600=0.6~0.8,侵染未开花的拟南芥花蕾1~2 min,10 min后重复侵染一次。侵染过的植株侧放在纸盒中22 ℃避光24 h后于人工气候箱内正常管理,直至收取T0代种子。将收集到的T0代拟南芥种子无菌处理后于含Kan(25 mg·L-1)的MS筛选培养基内进行抗性苗筛选,直到获得阳性克隆拟南芥T2代株系。
1.3.3SaLDC启动子在转基因拟南芥中的表达 将转SaLDC启动子的拟南芥T2代种子按1.3.2方式播种,对春化后4 d(2片叶)、11 d(4片叶)、16 d(6片叶)的拟南芥幼苗进行GUS染色,观察并拍照记录不同生长阶段转基因植株的GUS表达情况;对春化后生长30 d的转基因拟南芥根、茎、叶、花序和角果分别作GUS染色,观察、记录GUS在拟南芥不同器官的表达情况。
1.3.4转基因拟南芥对不同光照条件的响应 将春化后生长16 d的转基因拟南芥幼苗置于培养箱内作以下处理:1) 3 d全光照培养;2) 2 d光照+1 d黑暗培养;3) 1 d光照+2 d黑暗培养;4) 3 d全黑暗培养,对上述处理的拟南芥幼苗分别进行GUS染色,仔细观察染色情况并拍照记录。
1.3.5转基因拟南芥对干旱胁迫的响应 对春化后生长16 d的转基因拟南芥幼苗用6% PEG模拟干旱胁迫,分别于0、1、2、4、8和24 h时采集拟南芥整株,平均分成2份,一份用于GUS染色,另一份按单株提取总蛋白,采用考马斯亮蓝法[14]测定总蛋白含量,定量法测定GUS酶活性,均3次重复。
GUS酶活性测定方法:以胁迫0 h为空白对照,转基因拟南芥总蛋白提取液与含GUS反应底物的缓冲液酶促反应30 min后,反应液在荧光分光光度计(日立,F-4600)激发光365 nm,发射光455 nm,狭缝10 nm条件下,读取各胁迫样品蛋白提取液中GUS与底物4-MUG反应生成4-MU的荧光值,并根据4-MU标准曲线计算出转基因拟南芥中GUS酶的活性。

1.4 数据处理
采用Office 2007分析数据,并用DPS 6.0进行方差分析。
2 结果与分析
2.1 SaLDC启动子序列克隆

图1 SaLDC启动子片段琼脂糖凝胶电泳Fig.1 Agarose gel electrophoresis of SaLDC promoter M:DL2000 DNA 条带 DL2000 DNA Marker;1,2:SaLDC启动子条带 SaLDC promoter.
以苦豆子基因组DNA为模板扩增SaLDC启动子序列,琼脂糖凝胶电泳检测获得约1300 bp大小的条带(图1)。克隆获得的启动子片段经连接、转化、挑取Amp平板上的单菌落摇菌后菌液PCR验证,阳性克隆送公司测序,测序结果表明SaLDC启动子片段为1260 bp(图2),序列提交NCBI获登录号:KY038928。
2.2 SaLDC启动子序列信息学分析
经PLACE和PlantCARE数据库对所获得的1260 bpSaLDC启动子序列预测分析,该启动子转录起始位点为起始密码子上游45 bp处的碱基A,将其标记为+1(图2)。SaLDC启动子序列中不仅包含核心元件TATA-box(-27)和CAAT-box(-82),还含有大量生物和非生物相关的顺式作用元件, 包括干旱胁迫响应元件MYBCORE;病原体响应元件WBOXATNPR1;茉莉酸甲酯响应元件CGTCA-motif;组织表达特异性元件Skn1-motif、GCN4- motif以及光响应元件IBOXCORE、ACE、G-box、chs-CMA1a和chs-CMA2a等。此外,在该序列中还存在大量增强子元件GATA-box,11个GATA-box中有7个集中分布于-765 bp以内,1个定位于-811,另3个分布于-1212~-1026;在-1177~-442的正负链上共分布有6个抑制子元件WRKY710S(表1)。

图2 苦豆子SaLDC启动子序列Fig.2 SaLDC promoter sequence of S. alopecuroides

表1 SaLDC启动子区域顺式作用元件位置和功能Table 1 Physical location and function of Cis-elements in the SaLDC promoter
注:*表示该顺式作用元件在互补链上;表中所列位置为3′端的第一个碱基。
Note: *The Cis-acting elements on the complementary strand; this location is the first base at the 3′ end.
2.3 SaLDC启动子在转基因拟南芥中的时空和组织特异性表达
2.3.1SaLDC启动子在转基因拟南芥中的时空表达特性 不同生长阶段的转基因拟南芥幼苗均可通过GUS染色检测到其活性,但表达水平存在差异。春化后生长4 d(2片叶)的拟南芥植株地上部染色较深,尤以叶片、叶柄和茎中颜色深,说明叶和茎中GUS表达强度较根高;生长11 d(4片叶)的植株中叶柄和茎的染色相对于叶片要深些,但浅于生长4 d的,显示生长11 d的叶片中GUS表达强度降低,而叶柄和茎的表达强度却比生长4 d的高;生长16 d(6片叶)的植株无论是叶片、叶柄还是茎,其GUS表达强度均较生长4和11 d的有所下降(图3)。可见,SaLDC启动子驱动GUS在拟南芥中的表达强度具有时空特异性,在拟南芥生长早期有较强的驱动下游功能基因表达的作用,但随植株的生长这种作用有下降趋势。
2.3.2SaLDC启动子在转基因拟南芥中的组织特异性表达 对春化后生长30 d的转基因成株拟南芥的根、茎、叶、花序和角果分别作GUS染色发现,叶片和花萼染色较深,根、茎、花瓣和角果染色浅,说明SaLDC启动子在转基因拟南芥不同器官中驱动GUS表达的能力有差异,在叶片和花萼中优势表达,但在茎、花瓣、角果和根中表达较弱(图4),有一定的组织表达特异性。
2.4 SaLDC启动子对不同光照条件的响应
生物信息学分析发现在SaLDC启动子上共有7类16个光响应顺式作用元件(表1),为验证该启动子对光信号的响应情况,对转SaLDC启动子的拟南芥植株(春化后16 d)进行不同光照时间处理。研究表明,在黑暗与光照条件下生长的转基因拟南芥幼苗中的SaLDC启动子均能驱动GUS表达,与持续黑暗生长3 d的转基因拟南芥叶片中的染色程度相比,持续光照生长3 d明显深于2 d光照+1 d黑暗培养以及1 d光照+2 d黑暗培养,而且染色深度是光照3 d>2 d>1 d>0 d(图5),表明虽然SaLDC在黑暗条件下能够驱动GUS,但光诱导可以更有效地促使GUS表达上调。

图3 含SaLDC启动子的转基因拟南芥不同生长阶段GUS表达Fig.3 Expression of GUS driven by SaLDC promoter at different growth stages in transgenic A. thaliana A:生长4 d Growing 4 d;B:生长11 d Growing 11 d;C:生长16 d Growing 16 d.

图4 含SaLDC启动子的转基因拟南芥组织特异性表达Fig.4 Tissue specific expression of SaLDC promoter in transgenic A. thaliana A:豆荚Pod;B:叶片Leaf;C:根Root;D:茎Stem;E:花序Floral.
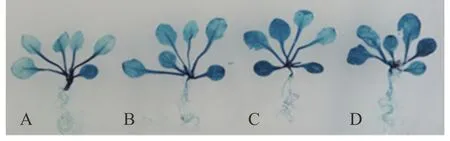
图5 含SaLDC启动子的转基因拟南芥在不同光照条件下的GUS表达Fig.5 Expression of GUS driven by SaLDC promoter under different light conditions in transgenic A. thaliana A:3 d 黑暗培养3 days darkness;B:1 d光照+2 d黑暗培养1 day light+2 days darkness;C:2 d光照+1 d黑暗培养2 days light+1 day darkness;D:3 d光照培养3 days light.
2.5 SaLDC启动子对干旱胁迫的响应
由于SaLDC启动子序列中含有2个与干旱相关的响应元件MYBCORE(表1),选取春化后16 d的转基因拟南芥幼苗模拟干旱胁迫0~24 h,用GUS染色观察报告基因表达情况。经干旱胁迫和未经干旱胁迫处理的转基因拟南芥植株均能被GUS染色,胁迫1~2 h后拟南芥植株的GUS染色明显较未胁迫前加深,但随胁迫时间的延长,染色又逐渐变浅(图6)。可见,转基因拟南芥中SaLDC启动子对干旱胁迫响应迅速,在胁迫初期能迅速驱动下游GUS表达水平上调,然而,随胁迫时间的延长SaLDC启动子对干旱胁迫的响应有所减弱,致使GUS的表达强度逐渐降低,由此说明,SaLDC启动子是一个干旱诱导型启动子。
为进一步精确分析转基因拟南芥在模拟干旱胁迫下SaLDC启动子驱动GUS的表达差异,对GUS酶活性进行定量测定,结果显示不同PEG胁迫时间对转基因拟南芥中GUS酶活性均有影响(图7),胁迫1~2 h时,显著升高(P<0.05),分别是胁迫前的1.39和1.21倍;随后GUS酶活性逐渐下降,胁迫4 h时较胁迫前有所下降,但无显著性差异;胁迫8 h时GUS酶活性降至最低(P<0.01),较胁迫前下降了28.2%;当胁迫至24 h时基本恢复至未胁迫水平,与GUS染色的表观结果完全一致。
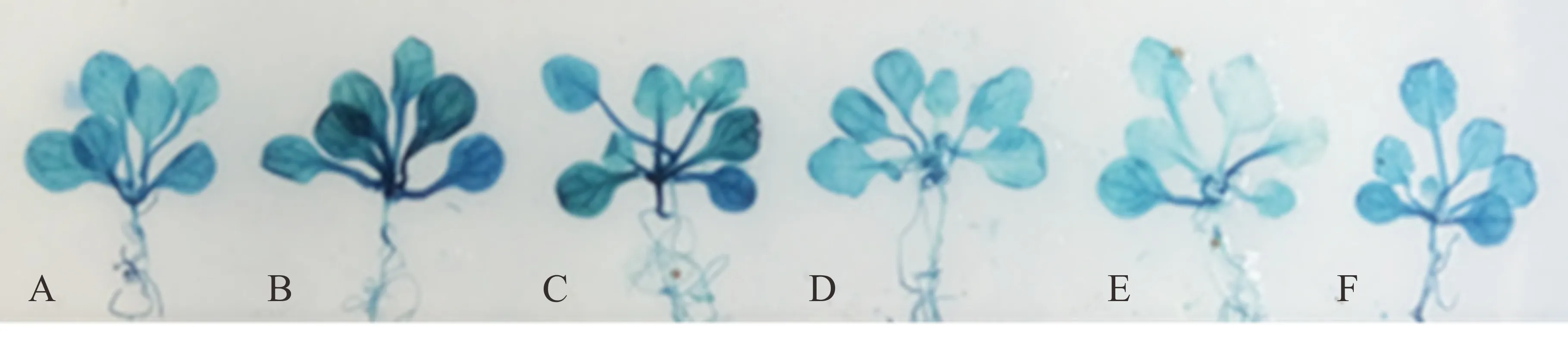
图6 PEG胁迫对SaLDC启动子驱动GUS表达强度的影响Fig.6 GUS expression driven by SaLDC promoter in transgenic A. thaliana under PEG stressPEG胁迫时间PEG stress time:A, 0 h;B, 1 h;C, 2 h;D, 4 h;E, 8 h;F, 24 h.
3 讨论

图7 PEG胁迫后转基因拟南芥中GUS酶活性差异比较Fig.7 GUS enzyme activity expression difference in transgenic A. thaliana under PEG stress 不同小写字母表示0.05水平差异显著,不同大写字母表示0.01水平差异显著。Different lowercase letters indicates significant differences at 0.05 level, and uppercase letters indicate significant differences at 0.01 level.
基因表达受其上游启动子调控,有研究报道启动子主要分为组成型启动子、诱导型启动子和组织特异型启动子3类[15],组织特异性启动子所调控的下游基因往往只在特定条件和组织器官中特异表达,从而避免持续稳定、高效表达所造成的浪费,降低了植物的代谢负担[16]。刘华等[17]分析了2个花生(Arachishypogaea)品种开花后20、40 和60 d种子以及根、茎、叶和花7个不同组织中油酸脱氢酶基因AhFAD2A和AhFAD2B的表达,发现这2个基因在各组织中都有表达,但在花后40 d的种子中表达量最高,表现出明显的时空特异性;张吉顺等[18]利用实时荧光定量PCR对烟草赖氨酸脱羧酶基因NtLDC1进行组织特异性表达分析,发现该基因在烟草叶片组织中的表达水平最高,在茎中表达水平最低;Naoumkina等[19]将克隆到的瓜尔豆(Cyamopsistetragonoloba)甘露聚糖合酶基因的启动子与报告基因融合并转入紫花苜蓿(Medicagosativa),研究显示该启动子只在紫花苜蓿的胚乳组织中特异表达。本研究发现SaLDC启动子虽然在转基因拟南芥幼苗和成株的各组织中均能驱动GUS报告基因表达,但表达强度有区别,在幼苗中随生长时间的延长,叶片中表达活性下降;在成株的叶片和花萼中表达活性高于根、茎、花瓣和角果,由此可见,SaLDC启动子既有时空表达特异性,又有组织表达特异性。
植物通过感知多种环境因子(光、温度、水分等)的转导信号,诱导基因表达以调节自身正常的生长发育[20]。由诱导型启动子驱动的抗逆基因的表达研究已在多种植物中开展[21-24],程寅胜等[25]用NaCl、干旱、赤霉素(gibberellin A3,GA3)、茉莉酸甲酯(methyl jasmonate,MeJA)以及光照处理含砀山酥梨(Pyrusbretschneideri‘Dangshan Suli’)糖转运相关基因PbTMT4启动子的转基因拟南芥,结果显示这些非生物胁迫因子一定程度上均可提高拟南芥中GUS的转录水平;李小冬等[26]发现紫花苜蓿MsMBF1C启动子上具有与植物耐热调节相关的结合位点,42 ℃高温热诱导后转基因拟南芥中GUS与At-MBF1C的表达都得到显著提高。研究表明LDC的表达也受多种环境因子的影响,NaCl可促使冰叶日中花(Mesembryanthemumcrystallinum)的LDC表达上调[27];低温能够使耐冷性强的黄瓜(Cucumissativus)品种在发芽期诱导赖氨酸脱羧酶基因表达,但该基因在耐冷性弱的品种中不能被诱导[28],苗永美等[29]对携带有CsLDC的耐冷黄瓜品种进行低温和盐胁迫,证明CsLDC是低温和盐快速响应基因;杨毅等[12]通过qPCR检测发现苦豆子植株SaLDC的表达对干旱胁迫有响应。本研究将SaLDC启动子融合GUS遗传转化拟南芥,经干旱胁迫后,转基因拟南芥幼苗的GUS酶活性从胁迫1~8 h发生显著变化,由此预示SaLDC启动子能利用拟南芥植物体内自身存在的调节机制调控基因表达,在经受干旱胁迫时,启动了相应的应答机制,在转录水平上参与SaLDC调控表达,从而抵御外界环境胁迫,使基因表达与植物生长状态协调统一。
在植物生长发育过程中,光不仅直接参与光合作用,还是调控相关基因表达的一个重要的信号[30],光诱导型启动子通过其光调控元件的特殊组合方式调控基因的表达[31],Wang等[32]克隆并分析了白杨(Populus)Pt-RbcS启动子,发现其包含有TCT-motif、ATCT-motif和GAG-motif等光响应元件,该启动子驱动GUS优先在具有光合组织的叶和茎中表达,本研究在苦豆子SaLDC启动子中发现7类共16个光响应元件,包括IBOXCORE、ACE、G-box、GAG-motif、TCT-motif等,研究发现,虽然黑暗与光照条件下SaLDC启动子均能驱动转基因拟南芥中GUS表达,但表达的程度是光照3 d>2 d>1 d>0 d,说明光诱导可以促使该启动子中的光响应元件发挥作用,提高GUS在mRNA上的转录水平,这与实践中光照促进植物生长发育相一致。
4 结论
SaLDC启动子序列中除了基本顺式作用元件外,还有多个响应外界刺激的生物和非生物作用元件。虽然SaLDC启动子在拟南芥幼苗的不同生长阶段和成株的各组织器官中均能驱动GUS表达,但有时空特异性和组织特异性。生物信息分析、组织化学染色和定量分析等多个角度说明SaLDC启动子受光照和PEG胁迫诱导,可作为光照和干旱胁迫诱导型启动子用于后续研究。

