肺炎克雷伯菌AmpC酶检测及抗生素选择
刘永瑞 张妍 李秀英

摘要:目的 调查济寧市第一人民医院肺炎克雷伯菌质粒介导AmpC酶表型及其对常用抗生素的耐药性,为临床用药提供依据。方法 收集2017年1月~7月济宁市第一人民医院临床分离的非重复肺炎克雷伯菌97株,应用头孢西丁纸片扩散法进行肺炎克雷伯菌AmpC酶表型初筛,对初筛阳性菌用多重PCR方法检测质粒介导AmpC酶基因,分析其耐药情况。结果 97株肺炎克雷伯菌中共筛选出40株对头孢西丁不敏感菌株,经多重PCR扩增,有7株AmpC酶阳性,检出率为7.22%(7/97),均为DHA型。产质粒介导AmpC酶菌株仅对亚胺培南敏感(100.00%)。结论 济宁市第一人民医院产质粒介导AmpC酶肺炎克雷伯菌发生率相对较低,以DHA型基因为主,治疗应首选碳青霉烯类抗菌药物。
关键词:肺炎克雷伯菌;质粒;AmpC酶;药敏结果
中图分类号:R378.99 文献标识码:A DOI:10.3969/j.issn.1006-1959.2019.19.039
文章编号:1006-1959(2019)19-0122-03
Klebsiella Pneumoniae AmpC Enzyme Detection and Antibiotic Selection
LIU Yong-rui,Zhang Yan,LI Xiu-ying
(Department of Respiratory,the First People's Hospital of Jining,Jining 272100,Shandong,China)
Abstract:Objective To investigate the AmpC phenotype of Klebsiella pneumoniae mediated by Klebsiella pneumoniae in Jining First People's Hospital and its resistance to common antibiotics, and provide evidence for clinical use.Methods A total of 97 strains of non-repetitive Klebsiella pneumoniae isolated from the First People's Hospital of Jining City from January to July 2017 were collected. The phenycepin diffusion method was used to screen the AmpC enzyme phenotype of Klebsiella pneumoniae. The primary screening positive bacteria were detected by multiplex PCR method for plasmid-mediated AmpC enzyme gene, and the drug resistance was analyzed.Results A total of 40 strains of cefoxitin-insensitive strains were screened from 97 strains of Klebsiella pneumoniae. Seven strains of AmpC enzyme were positive by multiplex PCR, and the detection rate was 7.22% (7/97), all of which were DHA type. The plasmid-mediated AmpC enzyme strain was only sensitive to imipenem (100.00%).Conclusion The incidence of plasmid-mediated AmpC enzyme Klebsiella pneumoniae in the First People's Hospital of Jining City is relatively low. The DHA type gene is the main treatment. The carbapenem antibiotics should be the first choice for treatment.
Key words:Klebsiella pneumoniae;Plasmid;AmpC enzyme;Drug susceptibility results
根据中国细菌耐药监测显示,目前我国临床分离菌株以革兰氏阴性杆菌为主,其中肠杆菌属中以大肠杆菌及肺炎克雷伯菌为主[1]。随着β-内酰胺类抗生素在临床的广泛应用,细菌对β内酰胺类抗生素耐药的现象也日益严重。其中细菌产生各种水解酶是革兰氏阴性杆菌耐药的主要机制[2],目前临床上研究比较多、且对广谱β-内酰胺类抗生素耐药的重要机制是细菌产生AmpC β-内酰胺酶(AmpC酶),AmpC酶是由革兰氏阴性杆菌的染色体或质粒介导产生的一类β-内酰胺酶。革兰氏阴性杆菌产AmpC酶菌株呈现广泛的耐药。因此及时检测质粒介导的AmpC酶对指导临床抗生素的选择具有一定意义。本研究对我院肺炎克雷伯菌产质粒介导AmpC酶基因型及耐药性进行研究,旨在为临床合理应用抗生素提供参考依据。
1材料与方法
1.1材料 ①菌株来源:收集2017年1月~7月济宁市第一人民医院全院住院患者临床标本中(包括呼吸道、血液、分泌物等)分离的无重复肺炎克雷伯菌97株。②质控菌株:大肠埃希菌 ATCC 25922为阴性质控菌株,阴沟肠杆菌 029M为阳性质控菌株。
1.2试剂及仪器 主要试剂与仪器包括Vitek 2 Compact全自动微生物检定仪(法国生物梅里埃公司)、PCR扩增仪(美国 Perkin Elmer公司)、头孢西丁(FOX,30 μg)药敏纸片(英国Osoid公司)、凝胶电泳仪(上海天能公司)。
1.3方法
1.3.1细菌分离培养与鉴定 对临床分离非重复菌株接种血琼脂培养基,试验菌株应用全自动微生物检定仪进行鉴定。
1.3.2产AmpC酶菌株初筛 采用K-B纸片扩散法初筛,以FOX(30 μg)药敏纸片检测分离菌株,按照美国临床实验室标准化委员会(NCCLS)标准,抑菌圈直径≤18 mm者可疑为产AmpC酶菌株。
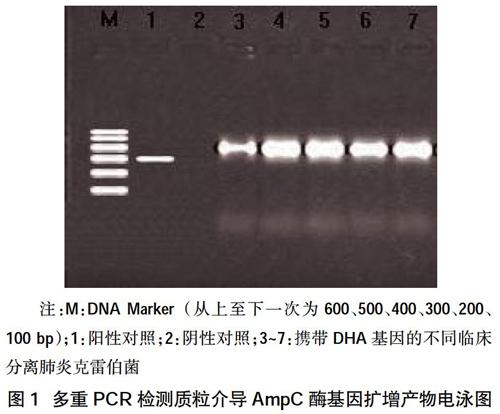
1.3.3质粒AmpC酶基因检测 应用细菌DNA提取试剂盒提取初筛试验阳性菌为PCR模板,操作按说明书进行。用多重PCR引物序列(上海生工合成)[3],引物序列见表1。反应体系50 μl。反应条件为:94℃预变性 3 min;94℃变性35 s,56℃退火40 s,72℃延伸1 min,循环30次;72℃延伸8 min。最后所得PCR产物加入1.5%琼脂糖凝胶中电泳,通过凝胶电泳仪观察结果并拍照记录。
2结果
2.1初步筛选结果 97株肺炎克雷伯菌中有40株对头孢西丁中介或耐药,为初筛产AmpC酶阳性菌,检出率为41.24%(40/97)。
2.2多重PCR结果 多重PCR显示7株肺炎克雷伯菌株扩增阳性条带(405 bp),判定均为DHA型,检出率为7.22%(7/97),见图1。
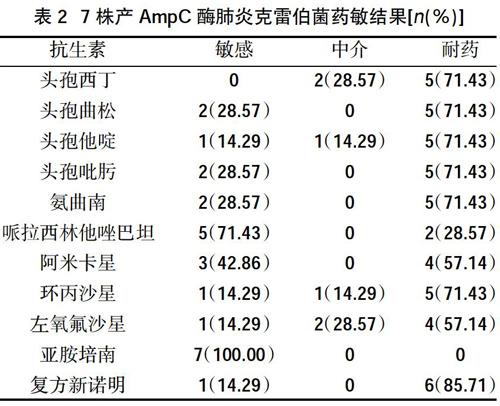
2.3药敏结果 产DHA型质粒AmpC酶的肺炎克雷伯菌对三、四代头孢菌素耐药,仅对亚胺培南较敏感(100.00%),见表2。
3讨论
肺炎克雷伯菌是临床常见的条件致病菌[4],自从1988年美国发现第一个质粒介导的AmpC酶,新质粒以每年1~2个的数目被发现,近几年质粒介导的AmpC酶相继被发现[5],质粒介导的AmpC呈持续高表达,且可以通过转化、接合等方式转移给其他细菌,从而造成耐药菌株的广泛产生。质粒介导的AmpC酶在大肠杆菌、克雷伯菌、产气肠杆菌及奇异变形杆菌中持续高表达,因此产质粒介导AmpC酶肺炎克雷伯菌所致的感染病死率更高[6],从而增加了临床抗感染治疗的难度,通过检测肺炎克雷伯菌中AmpC酶在我院的分布以及其药敏情况,对于指导临床合理应用抗生素提供一定的依据。
本试验采用头孢西丁药敏纸片法对临床分离的97株肺炎克雷伯菌进行初筛,其中可疑产AmpC酶菌株40株。对初筛阳性肺炎克雷伯菌采用多重PCR技术检测其基因型,结果显示7株肺炎克雷伯菌扩增出目的片段大小约405 bp的条带,根据片段大小确定为DHA型AmpC酶,产质粒介导AmpC酶肺炎克雷伯菌的总检出率7.22%,低于张戡等[7]的报道,考虑可能与收集菌株时间范围较小有关,下一步可通过研究更多菌株来减少误差。世界范围AmpC耐药基因以CMY型多见,国内以DHA-1型和ACT型多见,本研究对产质粒介导AmpC酶肺炎克雷伯菌进行AmpC酶基因检测,确定均为DHA型,与文献报道一致[8,9],结合本研究结果推测,DHA型可能是国内质粒介导AmpC酶的主要基因型。
本研究药敏结果显示,产AmpC酶肺炎克雷伯菌表现为多重耐药,对头孢曲松、头孢他定、头孢吡肟等三、四代头孢菌素均耐药。四代头孢菌素因能快速通过外膜屏障,一般推荐治疗产AmpC酶菌株感染,本试验中产AmpC酶肺炎克雷伯菌对四代头孢菌素头孢吡肟也呈现高度耐药(71.43%),考虑可能同时合并其他耐药机制,因此本院对于产质粒介导AmpC酶肺炎克雷伯菌感染应避免使用四代头孢菌素;产AmpC酶肺炎克雷伯菌对环丙沙星、左氧氟沙星、阿米卡星等喹诺酮及氨基糖甙类抗生素也高度耐药,提示产酶肺炎克雷伯菌可能存在多种耐药机制;产酶菌株仅对碳青霉烯类抗生素亚胺培南敏感,因碳青霉烯类抗生素对β-内酰胺酶高度稳定,与青霉素结合蛋白亲和力强,因此临床治疗产AmpC酶肺炎克雷伯菌感染首选碳青霉烯类抗生素。同時,为了控制耐药菌的流行,应加强AmpC的检测,以指导临床合理应用抗菌药物。
参考文献:
[1]胡付品,郭燕,朱德妹,等.2016年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2017,17(5):481-491.
[2]赵虎,孔宪涛.AmpC β内酰胺酶的检测[J].中华检验医学杂志,2003,26(6): 390-392.
[3]王新慧,许可欣.产AmpC 酶大肠埃希菌的检测及耐药分析[J].国际检验医学杂志,2016,37(8):1112-1114.
[4]Younas S,Ejaz H,Zafar A,et al.AmpC beta-lactamases in Klebsiella pneumoniae:An emerging threat to the paediatric patients[J].Park Med Assoc,2018,68(6):893-897.
[5]Markovska R,Schneider I,Marteva-Proevsk Y,et al.First detection of the AmpC beta-lactamase ACC-1 in a Klebsiella pneumoniae isolate in Bulgaria[J].Chemother,2012,24(5):307-308.
[6]王晓丽,葛亮,李兴华.产超广谱β-内酰胺酶和头孢菌素酶肺炎克雷伯菌的分布及耐药特征分析[J].中华医院感染学杂志,2018,28(1):5-9.
[7]张戡,邓敏,谢新,等.产AmpC肺炎克雷伯菌质粒介导的多药耐药性与基因型研究[J].中华医院感染学杂志,2016,26(1):7-9.
[8]Liu XQ,Liu YR.Detection and genotype analysis of AmpC β-lactamase in Klebsiella pneumoniae from tertiary hospitals[J].Exp Ther Med,2016,12(1):480-484.
[9]郑港森,刘赞赞,张加勤,等.大肠埃希菌和肺炎克雷伯菌质粒型AmpC酶基因型的检测分析[J].国际检验医学杂志,2015, 36(11):1505-1506.

