PIVKA-Ⅱ、AFP-L3、CEA联合检测在原发性肝癌中的诊断价值研究
李洪波,张伟鹏
(1.湖北医药学院附属国药东风总医院肿瘤科,湖北十堰 442000;2.荆门市第二人民医院肿瘤内科,湖北荆门 448000)
世界现今已存在的恶性肿瘤中,原发性肝癌的发病率高达第6位。这个数据表明该疾病已严重影响人们的生活质量,并且严重威胁人们的生命。2012年有研究人员统计发现,全世界因肝癌死亡的人数约74万,其中中国的病例死亡数占到了一半以上。由此可见,中国肝癌的致死率极高,居民健康受到了严重威胁[1]。中国临床早期通常采取常规的CT扫描对原发性肝癌患者进行诊断,但是常规CT扫描诊断范围有限,目前随着临床技术的不断发展,肿瘤标志物癌胚抗原(CEA)、肿瘤相关抗原甲胎蛋白-L3(AFP-L3)和维生素K缺乏诱导蛋白(PIVKA-Ⅱ) 逐渐应用于原发性肝癌的诊断中,诊断准确率较高,灵敏度和特异度更好,检查时间更短[2]。所以在原发性肝癌诊断中应用肿瘤标志物CEA、AFP-L3和PIVKA-Ⅱ,对原发性肝癌的治疗有重要意义,现报道如下。
1 资料与方法
1.1一般资料 选取2017年3月至2018年3月湖北医药学院附属国药东风总医院诊治的疑似肝癌患者90例为研究对象,将其按照诊断方式不同分为对照组和研究组。纳入标准[3]:(1)患者入院初步诊断为疑似肝癌;(2)患者均知情同意本研究;(3)患者生命的基本特征处于正常平稳的状态。排除标准:(1)严重的心脑血管疾病者;(2)肝肾功能异常患者;(3)精神异常不能配合诊断治疗者。研究组患者45例,男21例,女24例;年龄39~71岁,平均(58.6±3.9)岁;病程0.8~3.0年,平均(1.6±0.6)年;平均直径为(1.20±0.14)cm。对照组患者45例,20例,女25例;年龄36~72岁,平均(56.8±4.6)岁;病程1.0~3.5年,平均(1.8±0.7)年;平均直径为(1.10±0.17)cm。本研究经湖北医药学院附属国药东风总医院经医院伦理委员会批准。2组患者一般资料比较,差异无统计学意义(P>0.05),见表1。
1.2方法
1.2.1仪器 研究组肿瘤标记物PIVKA-Ⅱ、AFP-L3和CEA采用全自动化学发光分析仪(购自中国南昌高腾科技有限公司,型号CHEMCLIN-CC-600)检测,对照组使用的仪器为CE16层螺旋CT(购自中国浙江中诚工程管理科技有限公司),具体参数为电流380 mAs,电压120 kV,螺距1.375∶1,层厚1.0 mm[4]。
1.2.2诊断方法 对照组应用常规CT扫描诊断。在患者进行检查的前1日应控制患者的饮食,清空患者肠道,使检查结果更加准确,还应在检查的当日禁饮禁食。让患者卧于床位,最好选取合适的位置仰卧,使用超声探头从腹部至盆腔进行多个方位的检查,观察纵切面、扇形切面及横切面,记录患者肿瘤的大小、位置、形态、数量、回声特点以及边缘位置[5]。
研究组应用肿瘤标志物PIVKA-Ⅱ、AFP-L3和CEA进行诊断。当患者处于空腹状态时,从患者的静脉血管抽取新鲜血液3 mL,置于离心管中,在高速离心机下进行离心分离,选取离心后的上清液,采用先进的全自动化学发光分析仪进行检测,并进行阳性判断,若处于正常值上限为阳性,低于正常值上限为阴性[6]。各项指标检测正常值AFP-L3为0.0~13.6 μg/L,CEA为0~5 μg/L,PIVKA-Ⅱ为0~34 ku/L。当出现AFP-L3>20 μg/L、CEA>10 μg/L或PIVKA-Ⅱ>34 kU/L其中任意一项时即视为联合诊断阳性。此次研究的金标准为患者术后肿瘤标本的病理检测结果。
1.3观察指标 统计并详细记录2组患者临床断符合率、灵敏度、特异度、诊断时间。

2 结 果
2.1研究组和对照组的临床诊断符合率比较 诊断结果方面,研究组以AFP-L3=20 μg/L,CEA=10 μg/L,PIVKA-Ⅱ=34 kU/L为临界值,其中任意一项高于界值即视为联合诊断阳性,共检查出42例,总符合率为93.3%;对照组CT诊断为标准,共检查出38例,总符合率为84.4%,研究组患者的诊断符合率明显高于对照组(P<0.05)。见表1。
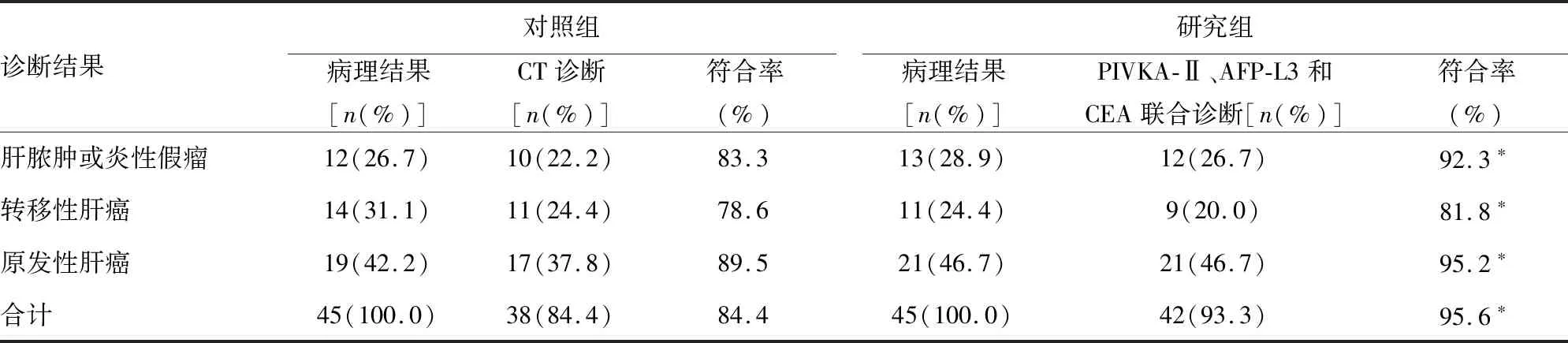
表1 研究组和对照组与临床诊断符合率比较
注:与对照组比较,*P<0.05
2.2研究组和对照组灵敏度、特异度和检查时间比较 研究组灵敏度、特异度分别为91.6%、80.9%,对照组灵敏度、特异度分别为76.5%、65.2%;研究组及对照组检查时间分别为(16.4±2.1)min、(22.3±2.4)min。研究组灵敏度和特异度更高,检查时间更短(P<0.05)。见表2、图1。
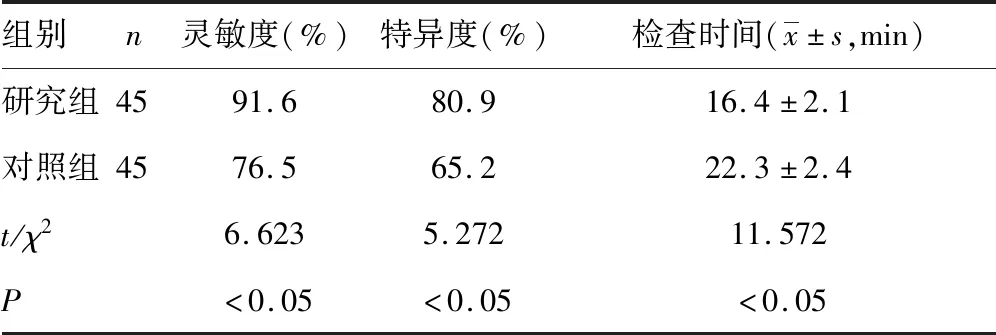
表2 研究组和对照组灵敏度、特异度和检查时间比较
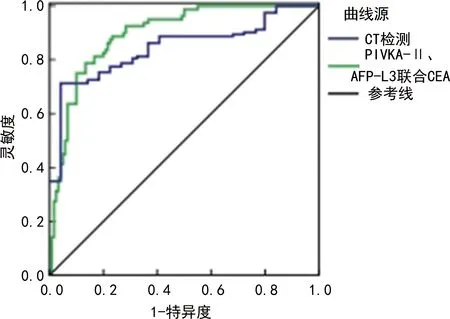
图1 CT及 AFP-L3、PIVKA-Ⅱ联合CEA诊断原发性肝癌的ROC曲线
3 讨 论
肝癌属于消化系统病变的恶性肿瘤,发病机制隐匿,早期临床症状也不明显[8]。在被确诊的肿瘤患者中肝癌较为常见,确诊后生命周期短,且最长生命期短。因此,短时间内对肝癌疾病准确诊断和治疗十分重要[9-10]。
PIVKA-Ⅱ,是凝血酶原的一种异常形式,近年被认为是原发性肝癌的新型敏感血清学标志物[11]。亚太肝病学会和日本肝病学会均已将 PIVKA-Ⅱ纳入指南中,推荐其用于原发性肝癌的筛查、辅助诊断、治疗效果监测、复发和预后评估。在中国,2015年发布的《中国慢性乙型肝炎防治指南》也将 PIVKA-Ⅱ 列为肝癌筛查的重要指标。肝脏是合成PIVKA-Ⅱ的主要器官,肝癌细胞能够产生大量PIVKA-Ⅱ,同时分泌到肝细胞外,表达水平和肿瘤出现时间成正相关[11-12],特异度和灵敏度都较高[13]。
CEA是一种多糖蛋白复合物,可以用来鉴定肿瘤[14-15]。CEA在健康人体内也会有少量的表达,当机体出现肿瘤时,尤其是消化系统恶性肿瘤,CEA会大量表达[15]。血清AFP-L3水平在机体出现癌症时不断升高,并且会随着患者病情的加重而不断上升[16-17]。本研究中通过对以上三种肿瘤标志物的检验联合诊断肿瘤,联合诊断结果与病理检验结果高度吻合,说明联合诊断的可信度高。联合诊断的灵敏度和特异度都高于影像学诊断,说明采用肿瘤标志物的检验联合诊断肿瘤的准确性能够在常规影像诊断基础上有所提高。
肿瘤标志物检验和影像学诊断都是肿瘤诊断最常见的手段,也是筛查肿瘤的重要途径。本文研究结果显示,研究组患者的诊断符合率明显高于对照组(P<0.05),研究组的检查时间明显低于对照组(P<0.05),原因在于肿瘤标记物CEA、PIVKA-Ⅱ和AFP的水平与肿瘤的恶性程度有着密切的关系,三者对于原发性肝癌患者的分期、预后以及肿瘤发生转移都起到重要的作用[12,18-20]。CEA、PIVKA-Ⅱ和AFP在原发性肝癌的早期诊断中都有一定的提示作用,因此,三者联合诊断符合率的提高和检查时间的缩短对于肝癌患者的尽早诊断和治疗有着重要的意义。由于肿瘤标志物检验的方法简单,可行性好,对于早期原发性肝癌的准确性高,检验时间短,因此,在筛查原发性肝癌方面有着较好的前景。但是肿瘤标志物检验也有其局限性,不能够直观的反应肿瘤的大小和准确分期限制了其在临床上的应用范围。
4 结 论
综上所述,在原发性肝癌诊断当中应用肿瘤标志物PIVKA-Ⅱ、AFP-L3和CEA进行诊断,可以达到较高的诊断准确率,同时缩短检出时间,对原发性肝癌的治疗有重要意义。

