共同腔畸形患儿蜗神经对电刺激的反应及耳蜗术后效果研究
徐艳艳 晁秀华 徐磊 罗建芬 王睿婕 樊兆民
共同腔畸形(common cavity deformity,CCD)是一种比较严重的内耳畸形。Edward Cock于1883年首次报道这种耳蜗畸形,并认为其是由胚胎发育第4周时听囊发育停滞导致的[1]。CCD的特征性影像学表现为耳蜗、前庭及半规管形成一个共同腔,蜗轴缺如。虽然CCD影像学的描述比较简单,但其表型、腔体的大小及腔体与内听道的位置关系等变异较大。此外,CCD常伴有半规管发育畸形、内听道狭窄及蜗神经发育不良。CCD耳蜗畸形在临床上常表现为重度至极重度感音神经性耳聋。目前,人工耳蜗植入术(CI)仍旧是提高CCD听力的最佳有效方法。既往研究报道共腔畸形耳蜗术后效果较耳蜗发育正常患儿差,且变异较大,一些患儿可获得言语,而另一些患儿术后仅可提高对声音的感知能力[2,3]。人工耳蜗的工作原理是通过电极将声音信号转化为电信号刺激耳蜗内残余的螺旋神经节细胞将信息传递到听皮层。既往研究表明,耳蜗内残余螺旋神经节细胞的功能是决定耳蜗术后效果的关键因素[4,5]。
当前利用神经遥测技术可以记录电极周围蜗神经的电刺激复合动作电位(electrically evoked compound action potential,eCAP)。既往动物实验研究表明,蜗神经的功能影响蜗神经对电刺激的反应,包括刺激阈值及eCAP的振幅等[7]。通过计算eCAP阈值及eCAP增益曲线的坡度可以评估耳蜗内蜗神经存活的数目[4]。因此,本研究目的是通过记录CCD患者电极周围eCAP及eCAP增益曲线,评估CCD残余螺旋神经节细胞对电刺激反应的特点;评估CCD患儿耳蜗术后听觉言语发展情况及其与耳蜗发育正常患儿之间的差异。
1 资料与方法
1.1 临床资料
收集2016年6月~2018年12月在我院行人工耳蜗植入的CCD患儿6例,其中男性4例,女性2例,中位数年龄2.6(2.1~7.0)岁。2例(CCD2,CCD4)为双侧植入,其中CCD2双耳均为CCD,而CCD4对侧为Mondini畸形。其余4例均为单耳植入(其中右耳植入2例,左耳植入2例),因此,共腔畸形共有7耳。人工耳蜗植入中位数年龄1.2(0.9~4.9)岁。所有患儿均植入24 REST电极(Cochlear Nucleus公司,澳大利亚),所有患儿的电极均全部植入。1例患儿(CCD4)对侧为Mondini畸形,其余患儿双侧均为CCD。4例患儿(CCD1、CCD3、CCD4、CCD5)伴有蜗神经发育不良,其余2例患儿蜗神经发育尚可。2例患儿(CCD1、CCD5)无术前助听器配戴史,其余4例患儿术前均双耳配戴助听器。患儿的基本信息见表1。选取6例耳蜗发育正常的人工耳蜗使用患儿作为对照组,患儿在术前残余听力及言语识别能力、助听器配戴经历、人工耳蜗植入年龄、使用时长等与对照组相匹配。对照组1例患儿使用REST电极,其余患者均使用CI422电极。
1.2 术前听力学评估及手术资料
两组患儿术前气导听性脑干反应(ABR)检查最大给声强度均未记录到波形分化。所有患儿术前气导纯音听阈均表现为双耳极重度感音神经性耳聋。CCD组所有患儿均采用经乳突入路行人工耳蜗植入术,在外半规管位置开约1.0 mm×3.0 mm的骨窗,将电极弯成大C型,于开窗处先将C型的顶端植入腔体中,再将电极的两端缓慢放入腔体中,尽量让电极与腔壁贴近。CCD组所有患儿术中均未发生脑脊液涌出,待电极植入后用自体肌肉将开窗处封闭。术后CBCT示电极均完全植入在腔体内(图1)。对照组患儿采用常规的经乳突-面隐窝入路。所有患儿术后均未发现脑脊液漏及脑膜炎等症状。
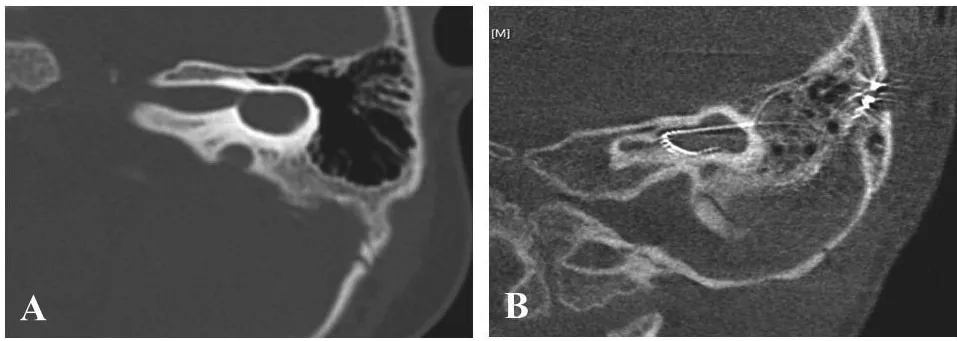
图1 共腔畸形耳蜗CT表现及电极植入后CT表现
1.3 eCAP测试
所有患儿于开机半年后使用Custom Sound EPTM(Version 4.3)记录电极周围的eCAP反应。采用双相电脉冲波作为刺激,记录电极为电极根部方向距离刺激电极的第二个电极(即记录电极No.=刺激电极No.-2),参考电极为MP2;刺激速率为15 Hz;刺激强度在最大舒适阈值(C值)以下;放大器增益为40~50;叠加次数为50~100次;延迟为98~142 s。分别记录1~22号电极周围的eCAP波,并计算出eCAP引出率。分别记录电极近端、中端及远端(REST及CI422电极3号为近端、21号为远端)处各1个电极(常规选择3号、12号及21号,若所选电极记录不到eCAP波则选择附近电极)的eCAP增益曲线,并记录该电极eCAP诱发阈值(T值)及eCAP增益曲线的坡度。

表1 CCD组患儿基本信息
1.4 耳蜗术后调试及效果评估
所有患儿于术后1个月开机并定期调机,采用游戏测听及视觉强化测听等方法确定MAP中刺激阈值(T值)及最大舒适阈值(C值)。分别于开机后6 m、12 m、18 m及24 m行声场下耳蜗助听听阈评估、听觉能力及言语可懂度评估及言语识别率测试。耳蜗助听听阈测试在声场中进行,采用扬声器给声,患儿距离扬声器1米,扬声器与耳蜗呈45°角,测试信号为啭音,分别测试250 Hz、500 Hz、1 kHz、2 kHz及4 kHz耳蜗助听听阈。低龄儿童采用视觉强化测听或游戏测听。听觉能力评估采用听觉行为分级标准(CAP),CAP评估分为0~7分8个等级,用于反映患者日常生活环境中的听觉水平[8];言语可懂度评估采用言语可懂度分级标准(SIR),SIR评估分为1~5分5个等级,用于评估患者的言语产生能力[9]。言语评估包括林氏六音辨识测试、闭合式言语测试。所有言语评估均在声场中进行,闭合式言语测试使用普通话早期言语感知测试词表。
1.5 统计学分析
采用SPSS 20.0软件进行统计学分析。结果以均数±标准差表示。采用Mann-Whitney U-test的方法比较CCD组及对照组eCAP反应T值、eCAP增益曲线坡度的差异,及耳蜗术后6 m及12 m助听听阈、CAP评分及SIR评分之间的差异。采用配对t检验的方法比较CCD组术前及术后助听听阈、CAP及SIR评分之间的差异。
2 结果
2.1 CCD耳蜗术后调试
5例患儿(CCD4及CCD6除外)开机时MAP中即使用较大的刺激脉宽及较低的刺激速率,开机12个月时除1例患者(CCD6)使用脉宽值为25 s,刺激速率为900 pps(每秒脉冲数量)外,其余患者均使用脉宽值为50 s或75 s,刺激速率为500 pps。开机12个月时CCD组及对照组MAP中3号、12号及21号电极的T值及C值见表2。CCD组MAP中各电极的T值及C值均明显高于对照组,差异有统计学意义(P<0.05)。4例患儿(CCD1、CCD2R、CCD2L及CCD5)均出现不同程度的面神经刺激表现,其中CCD2双耳的面肌抽搐随耳蜗使用时间的延长均不断加重。所有患儿面肌抽搐无明显责任电极,但总体趋势表现为远端处电极比近端处电极更容易引起面抽。耳蜗调试时,将C值设置在能引起面抽的最小值以下。2例(CCD3及CCD5)患者仅部分电极工作,其余患者所有电极均工作。

表2 CCD组及对照组MAP中T值及C值(nC)
2.2 eCAP测试结果
对照组患儿各电极均可记录到eCAP波,eCAP的引出率为100%。CCD组3耳(CCD2L、CCD4、CCD6)在所有电极处均可以记录到eCAP波,其余耳仅在部分电极处记录到eCAP波,eCAP的引出率为74.03%。对照组电极近端、中端及远端eCAP的诱发阈值分别为12.44±3.07、13.41±2.03及9.34±2.41nC,CCD组近端、中端及远端电极eCAP的诱发阈值分别为26.94±5.39、21.06±5.52及23.60±5.33 nC(见表3)。CCD组各电极处eCAP诱发阈值均明显高于对照组,差异有统计学意义(P<0.05)。CCD组内各电极间eCAP诱发阈值无明显统计学差异(P>0.05)。对照组电极近端、中端及远端eCAP增益曲线的坡度分别为3.94±1.13、5.43±2.55及6.83±5.36,CCD组近端、中端及远端电极eCAP增益曲线的坡度分别为2.72±5.13、4.13±5.33及2.47±3.61(见图2)。CCD组各电极处eCAP增益曲线的坡度均明显小于对照组,差异有统计学意义(P<0.05)。CCD组内电极间eCAP增益曲线的坡度无明显统计学差异(P>0.05)。CCD 组中1例患儿(CCD3)仅在电极远端记录到eCAP波,因此仅测试远端处eCAP增益曲线。CCD组除1例患者(CCD6)eCAP增益曲线坡度高于对照组平均水平,其余患者eCAP增益曲线均低于对照组平均水平(见图2)。

表3 电极近端、中端及远端处各电极eCAP诱发阈值(T值)(nC)

图2 CCD组及对照组eCAP增益曲线的坡度
2.3 术后听力及言语发展效果
术前及术后6 m、12 m、18 m、24 m的助听听阈见表4。CCD组耳蜗术后6 m、12 m、18 m、24 m的助听听阈分别为50.18±25.78 dB HL、41.66±26.39 dB HL、35.2±6.8 dB HL、33.0±7.3 dB HL,术后6 m及12 m时CCD组耳蜗助听听阈明显高于对照组(P<0.05),术后18 m及24 m时CCD组耳蜗助听听阈与对照组相似。CCD组术前及术后6 m、12 m、18 m、24 m的CAP评分分别为0.3±0.5、2.7±1.8、3.6±1.5、5.0±0、5.3±0.5(图3)。CCD组术前及术后6 m、12 m、18 m、24 m的SIR评分分别为1.2±0.4、1.3±0.5、1.8±1.1、2.8±0.9、2.8±0.9。与术前相比,CCD组术后CAP评分及SIR评分均有提高。与对照组相比,CCD组术后CAP评分及SIR评分均较术前有提高,且在12 m时差异有统计学意义(P<0.05)。在最后随访时间,CCD1仅能察觉到声音,CCD3可理解简单短语,其余患儿均可分辨林氏六音。CCD2、CCD5及CCD6 MESP三项测试均可通过。由于患儿配合较差,未能进行开放式言语测试。

表4 CCD组及对照组术前及术后耳蜗助听听阈(dB HL)
3 讨论
本研究采用单个脉冲的电刺激评估了CCD患儿共同腔体内残余蜗神经对电刺激的反应,并比较了CCD患儿与耳蜗发育正常患儿间eCAP诱发阈值及eCAP增益曲线之间的差异。研究结果发现CCD组eCAP诱发阈值明显高于对照组,eCAP增益曲线的坡度明显低于对照组。本研究结果表明,CCD患儿蜗神经对电刺激的反应较耳蜗发育正常患儿差。既往曹克利等[10]研究于术中记录CCD患儿电刺激听性脑干诱发反应(EABR)发现CCD患者EABR的诱发阈值明显高于耳蜗发育正常患儿。EABR同样也反应了一组蜗神经接收电刺激后的反应。本研究结果与既往报道一致。
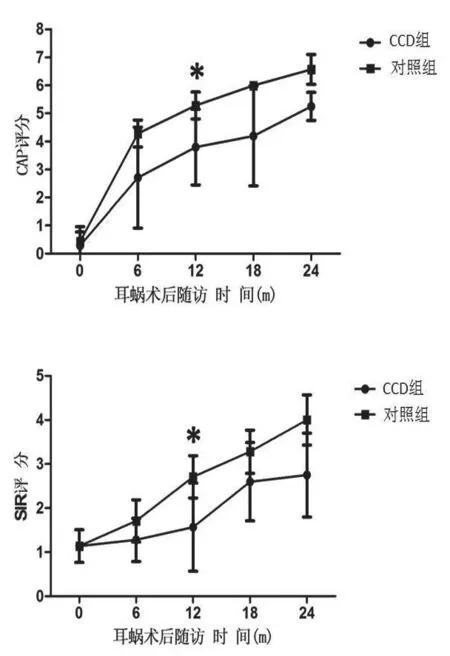
图3 CCD组及对照组耳蜗术后CAP评分及SIR评分
本研究中CCD组电极远端、中端及近端处电极eCAP诱发阈值及eCAP增益曲线坡度间并无统计学差异,这表明CCD患儿腔体内不同部位蜗神经对电刺激的反应无明显的差异。既往报道,依据CCD解剖结构及组织发育推测CCD腔体的前下、前及前上可能是神经存活较多的地方[11]。然而,本研究并未发现不同电极处蜗神经的功能有较大的差异。其原因可能为:一方面电极植入时较难控制其在耳蜗内的位置,因此同一编号的电极在不同患者中可能位于腔体的不同位置;另一方面不同位置处的电极距离腔体侧壁的距离不同,这也会影响其对电刺激的反应。本研究中1例患儿eCAP增益曲线的坡度明显高于其他患儿,而另一例患儿仅在1个电极周围记录到eCAP,部分患儿在所有电极处均可记录到eCAP波,而其余患儿仅在部分电极处记录到eCAP波,这些结果均表明CCD患儿残余蜗神经的功能具有较大的个体差异性。
本研究中所有患儿MAP中T值及C值均明显高于对照组,这一结果表明CCD患儿需要较大的刺激电量才能引起神经反应。曹克利等[10]同样报道CCD患者耳蜗调试时需要较大的刺激脉宽,本研究结果与既往报道一致。既往在CI患儿中研究显示,尽管eCAP诱发阈值与MAP中T值及C值并无明显的相关性,但eCAP诱发阈值大多更靠近MAP中的C值[12]。本研究中CCD患儿电极eCAP诱发阈值同样在MAP中T值与C值之间,且更靠近C值。由于本研究病例数较少,且患儿使用电极型号不同,我们并未分析eCAP诱发阈值与MAP中T值与C值之间的关系。我们同样认为尽管eCAP诱发阈值不能较好的预测MAP中的T值与C值,但对T值与C值的大概范围有一定的指导意义。本研究中我们首次报道CCD患儿MAP中使用较低的刺激速率。既往研究发现,残余蜗神经较少的患者其残余螺旋神经节细胞的同步性也较差[13]。降低刺激速率可以更好的适应不同螺旋神经节细胞的不应期,使得每次刺激时神经都能够达到最大反应。Buchman曾报道蜗神经发育不良患儿降低刺激速率会获得更好结果[14]。我们的调试理念与Buchman报道相同,旨在希望通过降低刺激速率提高CCD患儿耳蜗术后效果。
本研究中所有患儿耳蜗术后助听听阈及听觉言语能力均较术前有提高,这表明人工耳蜗植入对CCD有效。但是,CCD患儿耳蜗术后效果比耳蜗发育正常患儿差。尽管CCD患儿耳蜗术后助听听阈可达到耳蜗发育正常患儿相似的水平,但其听觉及言语能力较耳蜗发育正常患儿差,且发展较慢。此结果与既往报道相一致,Zhang等[2]报道了6例CCD患者,随访12~64个月,术后助听听阈、CAP、SIR评分均较对照组差。Xia等[3]报道了21例CCD患者CI术后效果,术后2年有约一半的患者有简单的言语,但言语测试结果较对照组差。此外,CCD患儿耳蜗术后听觉言语能力差异较大,术后18个月1例患儿仅提高了对声音的感知能力,2例患儿SIR评分为2分,1例患儿SIR评分为4分。总之,CCD患儿耳蜗术后效果较耳蜗发育正常患儿差,且个体间差异较大。这一结果也与CCD患儿对电刺激的反应较耳蜗发育正常患儿差,且个体间差异较大相一致。
本研究尚存在一些不足。首先,本研究样本量较少,由于CCD是比较少见的耳蜗畸形,加之既往有部分患儿术后失访,共收集了6例7耳。其次,对照组与实验组使用的电极型号不完全一致,由于REST电极比CI422电极粗,且对正常耳蜗的损伤也较大,因此耳蜗发育正常的患儿一般选用CI422电极。此外,本研究部分患者的随访时间较短,本研究发现人工耳蜗对CCD患儿有效,但其术后效果较差,且个体差异较大,希望给临床医师及患儿家属一定的指导意义。
4 结论
CCD患儿蜗神经对电刺激的反应较耳蜗发育正常患儿差,且个体间差异较大。CCD患儿需要较大的电量方能记录到eCAP波,且eCAP增益曲线的坡度比耳蜗发育正常患儿小。人工耳蜗植入对CCD患者有效,术后1年左右耳蜗助听听阈能达到耳蜗发育正常患儿相似的水平,但CCD患者听觉及言语能力发育较慢。CCD患儿耳蜗术后效果也存在较大的个体差异性。

