大林姬鼠和黑线姬鼠血清中两种免疫酶的比较分析
贾修歧 杨新宇 金志民

摘要:采用PAGE方法对大林姬鼠(Apodemus peninsulae)和黑线姬鼠(Apodemus agrarius)血清中SOD、POD两种免疫酶的分布和活性进行比较分析并建立SOD、POD电泳图谱。结果表明,在大林姬鼠和黑线姬鼠血清中SOD和POD均有表达,但两种鼠个体间的酶的分布和活性存在明显差异。
关键词:大林姬鼠(Apodemus peninsulae);黑线姬鼠(Apodemus agrarius);SOD;POD
中图分类号:Q592.1;Q956 文献标识码:A
文章编号:0439-8114(2019)18-0156-02
DOI:10.14088/j.cnki.issn0439-8114.2019.18.038 开放科学(资源服务)标识码(OSID):
Comparative analysis of two kinds of immune enzymes in serum of
Apodemus peninsulaeand and Apodemus agrarius
JIA Xiu-qi,YANG Xin-yu,JIN Zhi-min
(School of Life Science and Technology,Mudanjiang Normal University,Mudanjiang 157011,Heilongjiang,China)
Abstract: PAGE method was adopted to compare and analyze the distribution and activity of SOD and POD 2 immune enzymes in the serum of Apodemus peninsulae and Apodemus agrarius, and the electrophoresis patterns of SOD and POD enzymes were established. The results showed that SOD and POD were expressed in the serum of Apodemus peninsulae and Apodemus agrarius, but there were significant differences in the distribution and activity of enzymes between the two species.
Key words: Apodemus peninsulae; Apodemus agrarius; SOD; POD
大林姬鼠和黑线姬鼠都是广泛分布于中国农田和林区的主要破坏者,且两种鼠分类地位较近,在生境选择和食性方面存在较大重叠[1,2]。
超氧化物酶(SOD)和过氧化物酶(POD)是生物体中广泛存在且起至关重要作用的免疫类酶,超氧化物歧化酶属于金属酶类。SOD能特异地歧化生物体内产生的超氧负离子自由基(O2-),以维持O2-的生理平衡浓度,在抗辐射损伤、抗炎症、预防衰老以及防治肿瘤方面起重要作用,作为研究与自由基有关反应的特殊工具酶;过氧化物酶存在于细胞的过氧化物体内,其主要功能是清除氨基酸分解代谢及糖醛酸合成代谢等过程中形成的过氧化物,在肝细胞中数量特别多。过氧化物酶体的标志酶是过氧化氢酶,它的作用主要是将过氧化氢水解,对细胞起保护作用[3,4]。试验动物作为科技基础支撑条件之一,对人类生存以及人类科技活动有重要作用,越来越受到世界各国政府和科学家的重视,甚至作为衡量一个国家和地区科学技术水平高低的重要标志之一,了解两种鼠血清中SOD和POD对其进行试验动物化具有深远意义[5]。
近年来,有关大林姬鼠和黑线姬鼠的研究报道已有许多[6-11]。但关于这两种鼠血清中SOD和POD的活性与分布还未见报道。本试验对大林姬鼠和黑线姬鼠血清中SOD和POD进行比较分析,以期为大林姬鼠和黑线姬鼠的试验动物化研究以及对农林害鼠的防治提供基础生化数据。
1 材料与方法
1.1 材料
1.1.1 試验动物 试验鼠于2019年3—5月捕自黑龙江省牡丹江市三道关林场,健康成年个体各3只。
1.1.2 试验仪器 DYY-III2稳压稳流电泳仪,北京市六一仪器厂生产;高速冷冻离心机(Beckman coultar)、微量移液枪(Eppendorf)、凝胶成像系统,美国Alpha公司AlphaImager Mini。
1.1.3 试验药品 Tris、HCl、TEMED、过硫酸铵、丙烯酰胺、甲叉双丙烯酰胺、甘氨酸、溴酚蓝、蔗糖、琼脂糖、丙三醇、冰乙酸、乙酸钠、氯化钠、过氧化氢、核黄素、联苯胺等均为天津市大茂化学试剂有限公司生产的分析纯或生化试剂,氯化硝基四氮唑蓝(NBT)、吩嗪硫酸甲酯(PMS)由Solarbio生产。
1.2 方法
1.2.1 血清制备 从大林姬鼠、黑线姬鼠心脏采血,室内静置20 min后于4 000 r/min、4 ℃离心20 min,上清液为血清。
1.2.2 电泳 采用PAGE电泳的方法[12],对大林姬鼠和黑线姬血清中SOD和POD两种免疫酶进行比较分析,SOD、POD染色方法参照文献[13]。为避免试验偶然误差,分别在相邻点样孔冲刺点样。
2 结果与分析
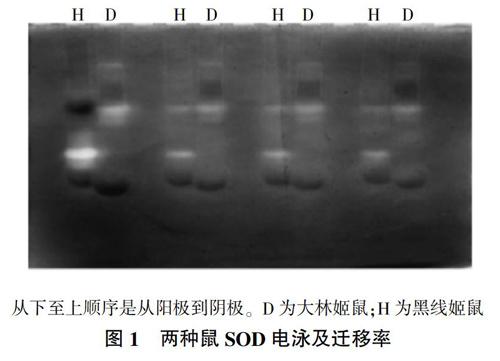
2.1 两种鼠血清中SOD的电泳图谱与分析
由图1、表1可见,大林姬鼠和黑线姬鼠血清中SOD共分出10条谱带,迁移率范围为0.17~0.52,其中大林姬鼠分离出6条谱带,黑线姬鼠分离出6条谱带,SOD6和SOD9谱带为大林姬鼠和黑线姬鼠共有带,SOD6活性表现为黑线姬鼠>大林姬鼠,SOD9活性表现为大林姬鼠>黑线姬鼠;SOD2、SOD4、SOD5、SOD10为大林姬鼠特有谱带,活性表现为SOD4>SOD5>SOD10>SOD2;SOD1、SOD3、SOD7、SOD8为黑线姬鼠特有谱带,活性表现为SOD1>SOD3>SOD7>SOD8。
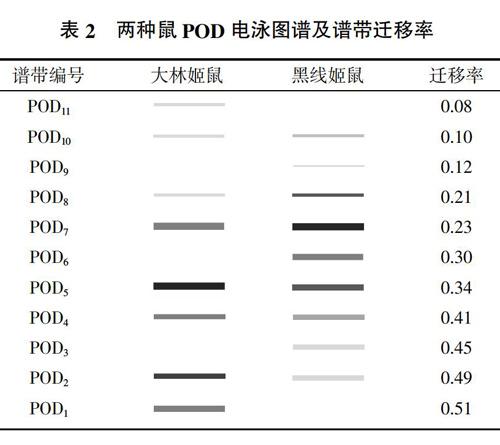
由图2、表2可见,大林姬鼠和黑线姬鼠血清中POD共分出11条谱带,迁移率范围为0.08~0.51,其中大林姬鼠分离出8条谱带,黑线姬鼠分离出9条谱带。POD2、POD4、POD5、POD7、POD8、POD10 6条谱带为大林姬鼠和黑线姬鼠所共有,其中POD2、POD4、POD5活性表现为大林姬鼠>黑线姬鼠;POD7、POD8、POD10活性表现为黑线姬鼠>大林姬鼠。POD1和POD11为大林姬鼠特有带,活性表现为POD1>POD11;POD3和POD9为黑线姬鼠特有带,活性表现为POD3>POD9。
3 小结与讨论
由两种鼠的电泳图谱可知,大林姬鼠和黑线姬鼠血清中SOD和POD的分布相似,但两种鼠之间酶的活性存在明显差异,大林姬鼠血清中SOD谱带数虽然多于黑线姬鼠,但SOD活性大多较黑线姬鼠弱;黑线姬鼠血清中POD的谱带数和活性均强于大林姬鼠。表明黑线姬鼠在自然界中的抗逆性强于大林姬鼠。这可能与两种鼠的生境选择相关,黑线姬鼠不仅分布在农田和林区,也有少数分布在草原和高山地区[14]。生境范围广说明该种动物对不同生境的适应能力强,从而反射出该种动物的抗逆性强。
本试验通过PAGE法对大林姬鼠和黑线姬鼠血清中的两种免疫酶SOD和POD进行比较、分析,并建立SOD和POD电泳图谱。研究结果表明,两种鼠血清中SOD和POD均有表达,但其酶活性存在明显差异。大林姬鼠和黑线姬鼠作为试验动物具备多种优势,且两者均为农林害鼠,通过对大林姬鼠和黑线姬鼠血清中两种免疫酶的研究可为其作为试验动物和农林业害鼠的防治提供基础生化依据。
参考文献:
[1] 夏武平.大林姬鼠种羣数量与巢区的研究[J].动物学报,1961, 13(Z1):171-180.
[2] 杨再学,郭永旺,王 登,等.贵州地区黑线姬鼠种群繁殖特征[J].动物学杂志,2016,51(6):939-948.
[3] 周虞灿,邵邻相,何新霞.三种鼠组织超氧化物歧化酶和乳酸脱氢酶同工酶的比较研究[J].兽类学报,1990,10(4):299-303.
[4] 陈晓虹,王林嵩,瞿文元.河南省小鲵科两种动物酯酶、过氧化物酶同工酶的比较研究[J].动物学杂志,2000,35(5):19-23.
[5] 徐 平.实验动物资源开发、保存和共享利用[J].中国比较医学杂志,2011,21(Z1):48-56.
[6] 黄广传,司俊杰,蒙 新,等.不同生境和季节社鼠与大林姬鼠的微生境选择比较[J].兽类学报,2019,39(3):242-251.
[7] KIM J,KIM W,AN J,et al. Complete genome sequencing and comparative genomic analysis of Helicobacter Apodemus isolated from the wild Korean striped field mouse (Apodemus agrarius) for potential pathogenicity[J].Frontiers in pharmacology,2018,9:838.
[8] JASON L A,MINORU N,KENTA U,et al. Comparison of the intestinal helminth community of the large Japanese field mouse (Apodemus speciosus) between urban,rural,and natural sites in Hokkaido,Japan[J].Parasitology international,2019,70:51-57.
[9] KARAMYSHEVA T V,TORGASHEVA A A,YEFREMOV Y R,et al. Spatial organization of fibroblast and spermatocyte nuclei with different B-chromosome content in Korean field mouse,Apodemus peninsulae(Rodentia,Muridae)[J].Genome,2017,60(10):815-824.
[10] 殷強玲,谢 昀,张全福,等.啮齿类动物中汉坦病毒感染血清学和病原学检测方法比较研究[J].病毒学报,2019,35(2):196-201.
[11] SKIVKA L,RUDYK M,HURMACH I,et al. Serum level of HMGB1 indicates outcome of the treatment of tumor bearing animals with antineoplastic drug NSC631570[J].Meta gene,2018,17(1):S17.
[12] 易 诚,杨春文,金建丽,等.棕黑锦蛇雌雄个体不同器官/组织同工酶比较分析[J].黑龙江畜牧兽医,2016(11):218-221.
[13] 陈毓荃.生物化学实验方法和技术[M].北京:科学出版社,2002.6,30.
[14] 杜增瑞,王泽长,朴相根.黑线姬鼠的形态、生活习性及其分布[J].吉林医科大学学报,1963(3):489-494.

