茶树愈伤组织诱导
刘静


摘要:以茶树[Camellia sinensis (L.) O. Ktze.]种子在无菌条件下萌发的根和叶为外植体,探究在MS培养基中不同种类植物生长调节剂对茶树根和叶愈伤组织诱导的影响。结果表明,以幼根为外植体诱导愈伤组织的最适培养基为NAA 1.0 mg/L+6-BA 0.5 mg/L+2,4-D 1.5 mg/L,诱导率为85.1%;培养基NAA 1.0 mg/L+6-BA 0.5 mg/L+2,4-D 2.0 mg/L为幼叶诱导愈伤组织的最适培养基,诱导率为87.0%。
关键词:茶树[Camellia sinensis (L.) O. Ktze.];愈伤组织;组织培养;诱导率
中图分类号:S571.1 文献标识码:A
文章编号:0439-8114(2019)18-0149-03
DOI:10.14088/j.cnki.issn0439-8114.2019.18.036 开放科学(资源服务)标识码(OSID):
Callus induction from tea tree
LIU Jing
(School of Modern Agriculture and Biotechnology,Ankang University,Ankang 725000,Shaanxi,China)
Abstract: The effects of different plant growth regulators on the induction of tea[Camellia sinensis(L.) O. Ktze.] root and leaf callus in MS medium were investigated by using the germinated roots and leaves of tea seeds as explants under aseptic conditions. The results showed that the optimum medium for callus induction was NAA 1.0 mg/L+6-BA 0.5 mg/L+2,4-D 1.5 mg/L, and the induction rate was 85.1%. NAA 1.0 mg/L+6-BA 0.5 mg/L+2,4-D 2.0 mg/L was the optimal medium for callus induction in young leaves, with an induction rate of 87.0%.
Key words: tea tree[Camellia sinensis (L.) O. Ktze.]; callus; tissue culture; induction rate
茶树[Camellia sinensis (L.) O. Ktze.]属山茶科山茶属多年生常绿木本植物,茶叶中含有机化学成分和无机矿物元素等,具有提神醒脑、解毒、利尿等功效[1]。茶树按照繁殖方式的不同分为种子繁殖和无性繁殖,种子直播简单易行,成本低廉,但天然茶树种子萌发受时间和季节的影响,并且难以摆脱气候和环境的不利影响,育种目的难以真正实现。无性繁殖以扦插为主,但是该方法在育苗周期、繁殖系数、对环境的要求方面有一定的缺陷,这使得茶树新品种的繁育和推广速度受到限制[2],利用组织培养繁殖不仅可以解决上述问题,而且具有材料利用率高、育苗周期短、繁殖数量大、不受季节影响等诸多优点。本试验以茶树无菌苗的幼根和幼叶为外植体,通过植物組织培养技术补充茶树愈伤组织诱导途径,旨在为茶树无菌苗的工厂化生产提供理论依据。
1 材料与方法
1.1 材料
供试材料为陕茶1号茶树成熟蒴果,当年10月初采收,种子采收后一部分常温保存,另一部分在4 ℃条件下冷藏保存。
所需植物生长调节剂为6-苄氨基嘌呤、萘乙酸、2,4-二氯苯乙酸,所需基本培养基为MS(Murashige and Skoog)培养基。
1.2 方法
1.2.1 茶树种子的杀菌 茶树种子剥去果皮后,流水冲洗2 h,用75%乙醇杀菌30 s,0.1%氯化汞杀菌8 min,无菌水冲洗5~6次。
1.2.2 茶树种子的不同处理方法 ①将低温储存的茶树种子(带种皮)杀菌后接种在空白MS培养基上。②将低温储存的茶树种子杀菌并去除种皮后接种在空白MS培养基上。③将低温储存的茶树种子杀菌并去除种皮,再将子叶切除2/3后接种于空白MS培养基上。
空白MS培养基中蔗糖浓度为30 g/L,琼脂含量为8 g/L,pH为5.8,光照度为1 500 lx,光照时间为12 h/d,温度为25 ℃。30 d后统计不同处理方法对茶树种子的萌发率及幼苗生长的影响。
萌发率=萌发的种子个数/接种的未污染的种子总数×100%
1.2.3 常温储存的茶树种子萌发率和低温储存的茶树种子萌发率的比较 将常温储存和低温储存的茶树种子杀菌,去除种皮后将子叶切除2/3分别接种于空白MS培养基上。30 d后统计不同处理方法下茶树种子的萌发率及幼苗生长情况。
萌发率=萌发的种子个数/接种的未污染的种子总数×100%
1.2.4 茶树愈伤组织诱导 当无菌苗生长到3~4 cm时,将茶树无菌苗的幼根切成0.5 cm长,无菌苗的幼叶切成0.5 cm×0.5 cm大小分别接种于愈伤组织诱导培养基上,愈伤组织诱导培养基以MS为基本培养基,附加不同浓度的植物生长调节剂,共9种:①NAA 1.0 mg/L+6-BA 0.5 mg/L+2,4-D 1.0 mg/L;②NAA 1.0 mg/L+6-BA 0.5 mg/L+2,4-D 1.5 mg/L;③NAA 1.0 mg/L+6-BA 0.5 mg/L+2,4-D 2.0 mg/L;④NAA 1.0 mg/L+6-BA 0.5 mg/L+2,4-D 3.0 mg/L;⑤NAA 0.1 mg/L+6-BA 1.0 mg/L;⑥NAA 0.5 mg/L+6-BA 1.0 mg/L;⑦NAA 1.0 mg/L+6-BA 1.0 mg/L;⑧6-BA 0.5 mg/L+2,4-D 1.0 mg/L;⑨6-BA 1.0 mg/L+2,4-D 1.0 mg/L。接种30 d后统计愈伤组织诱导率,比较不同浓度的植物生长调节剂组合对愈伤组织诱导的影响。
愈伤组织诱导率=(长出愈伤组织的外植体数/外植体总数)×100%
2 结果与分析
2.1 不同处理方法对低温储存种子萌发率及幼苗生长的影响
从表1可以看出,冷藏一段时间的茶树种子,其中保留内种皮的种子萌发率为0,去除内种皮保留完整子叶的种子萌发率为84.3%,去除内种皮保留1/3子叶的种子萌发率为90.1%。观察发现带有内种皮的茶树种子接种2 d后附带培养基全部褐化,且后期没有萌发迹象(图1a),在萌发时间上,以一芽三叶为培养目标,未去除种皮的种子未见萌发,去除种皮的完整种子(图1b)萌发需要的时间为14 d;萌发最快的为去除种皮的带有1/3子叶的种子,只需10 d左右;可能由于茶树紧实的种子结构抑制了芽点的生长,所以将子叶分开后对芽点的生长更有利。去除种皮的冷藏种子萌发率保持在80.0%以上,生长状况良好,不仅茎叶茁壮,还有数条侧根长出(图1c)。
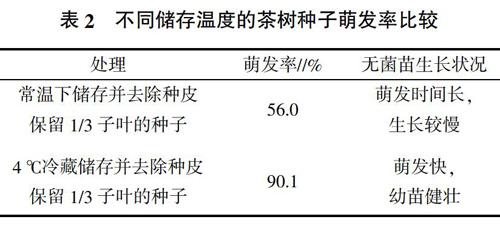
2.2 不同储存温度对茶树种子萌发率的影响
从表2可以看出,未经冷藏的去除内种皮保留1/3子叶的茶树种子萌发率为56.0%。种子萌发所需时间长,且生长缓慢;而经过冷藏的种子萌发率可达90.1%,种子萌发快,幼苗健壮,经过冷藏的去除种皮的种子萌发率远高于未经冷藏处理种子,可能是种子内部含有脱落酸等抑制萌发的内源性激素,经过一段时间的冷藏处理,抑制物质流失,有利于种子萌发。
2.3 茶树愈伤组织的诱导
2.3.1 以无菌苗的根为外植体诱导愈伤组织情况 在以幼根为外植体诱导愈伤组织的过程中,主要表现为以下几种情况:第一,幼根接种在培养基上后有部分出现褐化现象,继代培养无明显变化或逐渐死亡(图2a);第二,愈伤组织生长速度较慢,通过30 d的诱导只有少量淡黄色的愈伤组织且质地较硬(图2b),可能由于茶树为木本植物,虽然为幼根,但也有少部分木质化,导致愈伤组织生长缓慢且质地较硬;第三,愈伤组织的诱导率较低。从表3可以看出,1号至4号培养基中,随着2,4-D的浓度升高,愈伤组织的诱导率明显升高,2,4-D的浓度以1.5~2.0 mg/L为宜,超过或低于这一范围,愈伤组织的诱导率均表现出下降的趋势。在5号至7号培养基中,愈伤组织生长缓慢,数量少。8号培养基无愈伤组织产生,综上所述,以幼根为外植体,诱导愈伤组织的最适培养基为2号培养基(NAA 1.0 mg/L+6-BA 0.5 mg/L+2,4-D 1.5 mg/L)。
2.3.2 以幼叶为外植体诱导愈伤组织情况 茶树幼叶在接种后逐渐向上皱卷,膨大变厚,10 d后在外植体切口边缘出现少量黄白色颗粒状愈伤组织(图3a);30 d后,幼叶切口边缘的愈伤组织逐渐增多,愈伤组织颜色为黄白色(图3b)。从表4可以看出,在1号至4号培养基中,2号和3号培养基的愈伤组织诱导率较高,分别为83.7%和87.0%,通过多次继代培养,可以得到大量淡黄色愈伤组织。5号至7号培养基中,在6-BA浓度相同的情况下,愈伤组织随着NAA浓度的升高,诱导率呈递增趋势,当NAA浓度达到1.0 mg/L时,愈伤组织诱导率可达75.0%。在8号、9号培养基中,6-BA的浓度从0.5 mg/L增加到1.0 mg/L,诱导率从24.3%提高至72.4%。诱导出的愈伤组织逐渐由淡黄色转变为浅黄绿色,质地较松脆。综上所述,无论是愈伤组织诱导率还是愈伤组织的质量,3号培养基(NAA 1.0 mg/L+6-BA 0.5 mg/L+2,4-D 2.0 mg/L)都较为适合。
3 小结与讨论
3.1 茶树种子的萌发
本试验所用茶树种子为当年10月初采集,其中一部分茶树种子常温保存,另一部分茶树种子放置4 ℃冰箱保存,研究发现茶树种子的种皮和贮存温度对种子萌發有较大影响,种皮极易引起培养基的褐化,并限制茶树种子的萌发,试验中没有去除种皮的种子萌发率为零,去除种皮的种子有较高的萌发率,并且低温储存的种子萌发率远高于常温储存。武田善行等[3]研究发现茶树种子经过一段时间冷藏处理后,可促进发芽和显著提高发芽整齐度,种子经短期低温处理效果显著,但随着冷藏时间加长其效果逐渐变小。郭带英[4]认为茶树种子在低温下贮藏能延长其生命力并保持较高的萌发率。
3.2 茶树愈伤组织诱导中对外植体的选择
以茶树无菌苗的根和叶为外植体诱导愈伤组织,叶愈伤组织诱导率相对较高,陈玉玲等[5]比较了幼茎和叶诱导愈伤组织的效果,认为幼茎要好于叶片,叶片的叶脉较叶缘更易产生愈伤组织,局部的褐化对愈伤组织生长影响不大,叶片诱导愈伤组织的最适培养基为MS+6-BA 0.4 mg/L+2,4-D 2.0 mg/L。奚彪等[6]选择春季的腋芽为外植体,成功诱导出愈伤组织并获得了再生植株,但其成梢率低、生长慢。目前,已经成功利用茶树的营养器官和生殖器官通过组织培养技术得到完整植株,但对于最优外植体仍然没有定论,可见,在外植体的选择上仍然具有继续探索的必要性。
3.3 存在的问题和今后的研究方向
茶树再生体系的建立包括愈伤组织的诱导、继代、分化,最后形成具有较高生长能力的植株这一系列过程。本试验通过9种不同培养基诱导愈伤组织,部分培养基能够得到较为理想的愈伤组织,但仍有部分培养基没有诱导出愈伤组织,并且已得到的愈伤组织生长速度慢、数量少。通过种子培养出的无菌苗作为外植体来源,可以明显地控制外植体褐化,但仍然有部分根在诱导中发生褐化并难以改善。虽然有报道称子叶为茶树愈伤组织诱导的最佳材料[7],但在本试验中未能实现,这将在后期研究中进一步探索。茶树再生体系的建立,因素多样,联系复杂,需要调整的空间较大,所以,还需要大量的研究对该体系的建立提供技术支持和完善的理论。
参考文献:
[1] 边世平.茶叶的化学成分及其保健作用[J].青海大学学报(自然科学版),2004,22(4):64-65.
[2] 黄燕芬,吴 曦,周国兰,等.茶树无菌播种建立植株再生体系[J].河南农业科学,2013,42(5):60-63.
[3] 武田善行,叶乃兴.低温贮藏对茶籽发芽的影响[J].茶叶科学简报,1994(4):44.
[4] 郭带英.茶籽的采收及贮藏对幼苗成活率的影响[J].广东茶叶,1986(1):18-22.
[5] 陈玉玲,马丽霞,纪红冰,等.茶愈伤组织诱导的研究[J].河北师范大学学报(自然科学版),2007,31(3):389-391.
[6] 奚 彪,刘祖生.外植体性质对茶腋芽组培快繁的影响[J].茶叶,1994,20(4):14-17.
[7] 黄燕芬,周国兰,赵华富,等.茶子未成熟胚子叶柄离体培养诱导再生植株[J].贵州农业科学,2011,39(3):31-33.

