不同途径注射地塞米松对2型糖尿病大鼠房水药物浓度和血糖的影响
沈燕燕,黄 亮,晏 立,吴晓蓉,邵 毅,梅 锋
0引言
糖尿病视网膜病变(diabetic retinopathy,DR)是2型糖尿病(diabetes mellitus,T2DM)最常见和最严重的微血管并发症之一[1]。许多研究已经证明炎症反应在T2DM患者微血管病变的发生中起着关键作用[2-3]。地塞米松具有抗炎作用,其已在眼科临床中用于治疗DR[4-5]。全身使用糖皮质激素可导致T2DM患者出现血糖(blood sugar,BS)升高、消化性溃疡及骨质疏松等一系列副作用[6],局部使用糖皮质激素也可导致血糖升高[7]。此外,有研究发现眼局部注射地塞米松可使血糖升高[8]。眼部地塞米松常用给药途径包括局部点眼、眼周注射、玻璃体腔注射。局部点眼由于滴眼液在眼表面常被快速引流,同时受到泪膜、角膜、结膜上皮屏障的阻挡,造成药物吸收时间短、局部浓度低、生物利用率低[9],效果持续时间短,从而无法到达眼后节发挥治疗作用。玻璃体腔注射易出现眼内炎症、孔源性视网膜脱离、眼压升高、眼部出血等并发症[10]。眼周注射在结膜或筋膜组织下注射的药物有效地绕过了表面的泪膜和结膜屏障,且能够在组织层之间的潜在空间内留下大量的药物并将药物运送到后段,是较为理想的给药途径。为此,本研究通过结膜下、球旁、球后注射三种途径注射地塞米松,观察三种途径注射后对T2DM大鼠房水药物浓度和血糖的影响,以期为临床更好地使用地塞米松提供思路。
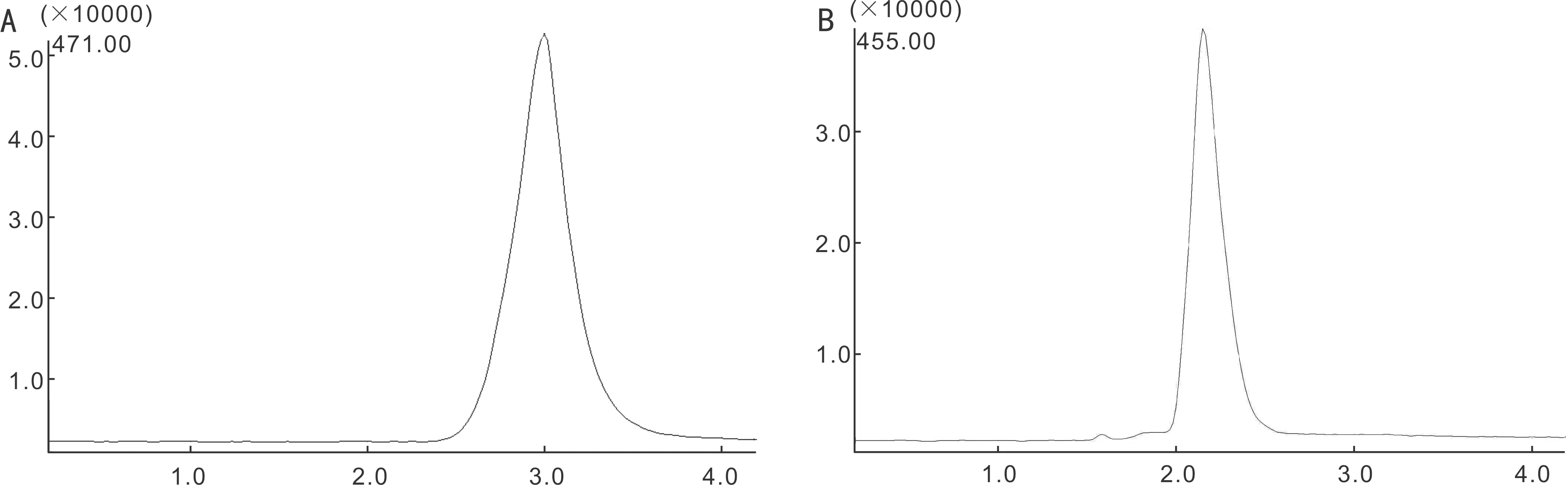
图1地塞米松磷酸钠和泼尼松质谱检测质荷比A:地塞米松磷酸钠;B:泼尼松。
1材料和方法
1.1材料实验动物:清洁级4周龄SD雄性幼鼠240只,体质量180~220g,由湖南斯莱克景达实验动物有限公司提供[SCXK(湘)2016-0002],自由摄食饮水,自然光照,保持安静,室温26℃,分笼饲养。主要试剂:链脲佐菌素(streptozotocin,STZ,美国SCE公司),地塞米松磷酸钠注射液(河南润弘制药股份有限公司,国药准字H41020327),地塞米松磷酸钠标准品(批号C101069215,中国食品药品检定研究院),泼尼松(批号C10016502,中国食品药品检定研究院),甲醇和乙腈为分析纯。主要仪器设备:血糖监测仪(江苏鱼跃医疗设备股份有限公司),液相-质谱联用仪(LCMS-2010EV,日本岛津)。本研究符合动物伦理学标准且得到我院伦理委员会批准。
1.2方法
1.2.1 T2DM大鼠模型建立SD大鼠(n=240)普通饲料(碳水化合物60%、蛋白质22%、脂肪10%、其它8%,由南昌大学动物科学部提供)适应性喂食1wk,然后高糖高脂饲料(蛋白质19.8%、碳水化合35.2%、脂肪45.0%,由北京博泰宏达生物有限公司提供)喂养6wk,禁食24h,腹腔注射亚致病剂量STZ(按30mg/kg剂量给药,STZ临用前以pH4.2,0.01mmol/L枸橼酸缓冲液配成30g/L浓度,置于冰浴上操作),间隔2d再注射1次,第2次注射STZ 72h后,血糖浓度>16.7mmol/L者即为T2DM大鼠模型。本研究中2次STZ腹腔注射后,192只SD大鼠血糖浓度明显升高(25.22±7.78mmol/L),且出现缓慢的消瘦、饮食大幅增多,24h尿量明显增多,部分大鼠出现烂尾现象,具有糖尿病典型的“三多一少”临床表现,说明T2DM大鼠模型建立成功。
1.2.2动物分组和药物处理将造模成功的T2DM大鼠(n=192)随机分为实验组(n=96,注射地塞米松)和对照组(n=96,注射生理盐水),每组T2DM大鼠根据给药途径不同随机分为3个亚组,即球旁注射组、球后注射组、结膜下注射组,每个亚组T2DM大鼠32只,其中24只用于房水药物浓度测量,8只用于血糖浓度测量。禁食不禁水12h后,T2DM大鼠左下腹腔乙醇消毒后,腹腔注射10%水合氯醛无菌溶液(0.3mL/100g)麻醉。实验组大鼠根据分组给予地塞米松磷酸钠注射液0.1mL[11],对照组大鼠根据分组给予生理盐水0.1mL。
1.2.3血糖浓度测定注射开始后大鼠禁食不禁水,每个亚组随机选取大鼠8只,每只大鼠分别于注射0、2、4、8、12、24h连续尾静脉穿刺采血,测定血糖浓度(试纸法)。
其次是理解信息。理解信息是在通读全文后,针对某一句话,放入语境中理解语义,这也需要对专业术语有深入了解,需要翻译者有较强的英语思维,跨越文化差异带来的影响,将特定情境下的语义正确的表达出来。
1.2.4房水地塞米松浓度测定
1.2.4.1房水采集注射开始后0.5、2、4、8、12、24h,每个亚组分别随机选取4只大鼠并取双眼房水样本。取样时,予10%水合氯醛无菌溶液(0.3mL/100g)腹腔注射进行麻醉,0.9%生理盐水冲洗双眼,清洁无菌纱布吸干,显微注射器刺入前房抽取房水25μL。所有样本置于-20℃冰箱中冷冻保存,待测。
1.2.4.2样本处理精密吸取15μL房水于1.5mL离心管中,加入5μL泼尼松溶液(内标物,1600ng/mL)、5μL地塞米松磷酸钠和60μL乙腈,涡旋7min,于5000r/min离心10min,精密量取上清液20μL注入高效液相色谱仪分析,记录峰面积,计算房水中地塞米松浓度。
1.2.4.3质谱条件离子化方式:电喷雾离子化(ESI);扫描方式:选择性负离子监测(SIM);加热块温度(block):200℃;曲型脱溶剂装置温度(CDL):250℃;CDL电压:250V;检测电压:1.85kV;雾化气流速:1.5L/min;干燥气流速:2.0L/min;质荷比:[M-H]-地塞米松磷酸钠m/z=471,内标泼尼松m/z=455,见图1。
1.2.4.4标准曲线绘制取地塞米松磷酸钠标准品制备浓度为100、200、400、800、1600、3200、6400ng/mL标准工作液,取15μL空白房水(正常大鼠房水)于1.5mL的离心管中,精密加入5μL泼尼松溶液(内标物,1600ng/mL)、5μL标准工作液和60μL乙腈,配制成质量浓度为25、50、100、200、400、800、1600ng/mL的标准含地塞米松房水样品,根据1.2.4.3进行操作,制备标准曲线。每个浓度重复5次。分别以空白房水中地塞米松磷酸钠的质量浓度为横坐标,以地塞米松磷酸钠与内标的峰面积比为纵坐标,进行线性回归,得标准曲线方程为:Y=0.0009728X+0.0021639,R2=0.9995715,R=0.9997857。地塞米松在25.0~1600.0μg/mL时线性关系良好。

表1 注药前后各组T2DM大鼠血糖浓度
注:aP<0.05vs同组0h;cP<0.05vs同组2h;eP<0.05vs同组4h;gP<0.05vs同组8h;iP<0.05vs同组12h。

图2不同途径注药对T2DM大鼠血糖浓度的影响A:不同途径注射地塞米磷酸钠对T2DM大鼠血糖的影响;B:不同途径注射生理盐水对T2DM大鼠血糖的影响。
1.2.4.5系统适用性试验(1)精密度试验:取地塞米松磷酸钠标准品制备质量浓度为1000、2000、4000、6000ng/mL的标准工作液,根据1.2.4.2样本处理方法进行样本处理,根据1.2.4.3进样分析,每个浓度重复5次,计算日内精密度。样品置于-20℃冰箱中保存连续5d进样,每个浓度重复3次,计算日间精密度。日内精密度、日间精密度均小于5%,符合实验要求。(2)回收率试验:取地塞米松磷酸钠标准品制备质量浓度为1000、2000、4000、6000ng/mL的标准工作液。根据1.2.4.2样本处理方法进行样本处理,根据1.2.4.3进样分析,每个浓度重复5次,根据标准曲线回归方程计算样品检出量,方法回收率=样品检出量/样品加入量。方法回收率均大于90%,相对标准偏差(relative standard deviation,RSD)均小于5%,符合实验要求。(3)稳定性试验:取地塞米松磷酸钠标准品,分别于0、1、2、4、6、8、12、16、20、24h时进样20μL,测定地塞米松峰面积,计算RSD。RSD<2%(n=10),表明供试品溶液在24h内稳定性良好。(4)重复性试验:平行精密吸取5份地塞米松磷酸钠标准品,每份5.0mL,置于10mL容量瓶中,根据1.2.4.2样本处理方法进行样本处理,根据1.2.4.3进样分析,测定地塞米松峰面积值,计算RSD。RSD<2%(n=5),表明方法重复性良好。
1.2.4.6房水地塞米松浓度测定取待测各组T2DM大鼠双眼房水样品,根据1.2.4.2样本处理方法进行样本处理,根据1.2.4.3进样分析,记录峰面积,根据标准曲线计算房水中地塞米松浓度。
2结果
2.1不同途径注药对T2DM大鼠血糖浓度的影响不同途径注射地塞米松磷酸钠前后,各组大鼠血糖浓度时间差异有统计学意义(F时间=386.419,P时间<0.001),但组间差异无统计学意义(F组间=0.151,P组间=0.861),时间和组间交互作用差异亦无统计学意义(F时间×组间=1.286,P时间×组间=0.276)。三种途径注药后2、4、8、24h大鼠血糖浓度与其注药前(0h)比较,差异均有统计学意义(P<0.05),见表1,图2A。
不同途径注射生理盐水前后,各组大鼠血糖浓度时间差异有统计学意义(F时间=394.157,P时间<0.001),组间差异无统计学意义(F组间=0.12,P组间=0.888),时间和组间交互作用差异亦无统计学意义(F时间×组间=2.311,P时间×组间=0.057)。球旁注射组T2DM大鼠注药后2、4、8、12、24h,球后注射组和结膜下注射组大鼠注药后2、4、12、24h血糖浓度与其注药前(0h)比较,差异均有统计学意义(P<0.05),见表1,图2B。

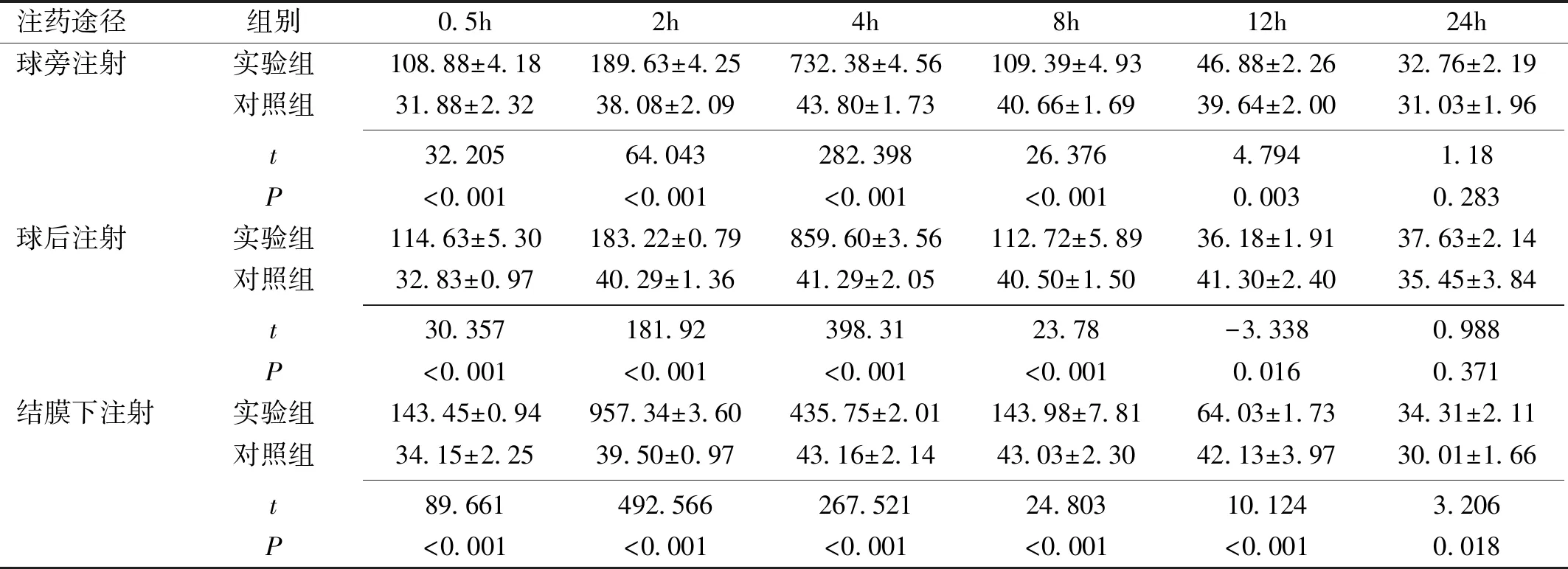
注药途径组别0.5h2h4h8h12h24h球旁注射实验组108.88±4.18189.63±4.25732.38±4.56109.39±4.9346.88±2.2632.76±2.19对照组31.88±2.3238.08±2.0943.80±1.7340.66±1.6939.64±2.0031.03±1.96 t32.20564.043282.39826.3764.7941.18P<0.001<0.001<0.001<0.0010.0030.283球后注射实验组114.63±5.30183.22±0.79859.60±3.56112.72±5.8936.18±1.9137.63±2.14对照组32.83±0.9740.29±1.3641.29±2.0540.50±1.5041.30±2.4035.45±3.84 t30.357181.92398.3123.78-3.3380.988P<0.001<0.001<0.001<0.0010.0160.371结膜下注射实验组143.45±0.94957.34±3.60435.75±2.01143.98±7.8164.03±1.7334.31±2.11对照组34.15±2.2539.50±0.9743.16±2.1443.03±2.3042.13±3.9730.01±1.66 t89.661492.566267.52124.80310.1243.206P<0.001<0.001<0.001<0.001<0.0010.018


组别0.5h2h4h8h12h24h球旁注射组108.88±4.18a189.63±4.25a732.38±4.56a,c109.39±4.93a46.88±2.26a,c32.76±2.19c球后注射组114.63±5.30a183.22±0.79a859.60±3.56112.72±5.89a36.18±1.91a37.63±2.14结膜下注射组143.45±0.94957.34±3.60435.75±2.01c143.98±7.8164.03±1.7334.31±2.11 F88.56175248.76215127.27636.454201.0655.361P<0.001<0.001<0.001<0.001<0.0010.029
注:aP<0.05vs同时间结膜下注射组;cP<0.05vs同时间球后注射组。
2.2不同途径注药对T2DM大鼠双眼房水地塞米松浓度的影响球旁注射地塞米松磷酸钠/生理盐水后4h,实验组大鼠双眼房水地塞米松浓度达到峰值(732.38±4.56ng/mL),注射后0.5~12h,两组大鼠双眼房水地塞米松浓度差异均有统计学意义(P<0.05);球后注射地塞米松磷酸钠/生理盐水后4h,实验组大鼠双眼房水地塞米松浓度达到峰值(859.60±3.56ng/mL),注射后0.5~12h,两组大鼠双眼房水地塞米松药物浓度差异均有统计学意义(P<0.05);结膜下注射地塞米松磷酸钠/生理盐水后2h,实验组大鼠双眼房水地塞米松浓度达到峰值(957.34±3.60ng/mL),注射后0.5~24h,两组大鼠双眼房水地塞米松药物浓度差异均有统计学意义(P<0.05),见表2。
注射地塞米松磷酸钠后0.5~24h,球旁注射组、球后注射组、结膜下注射组大鼠双眼房水地塞米松浓度差异均有统计学意义(P<0.05),见表3。注射后0.5、2、8h,球旁注射组和球后注射组大鼠双眼房水地塞米松浓度均低于结膜下注射组,差异均有统计学意义(P<0.05)。注射后4h,球旁注射组和结膜下注射组大鼠双眼房水地塞米松浓度均低于球后注射组,且结膜下注射组低于球旁注射组,差异均有统计学意义(P<0.05)。注射后12h,球旁注射组和球后注射组大鼠双眼房水地塞米松浓度均低于结膜下注射组,且球后注射组低于球旁注射组,差异均有统计学意义(P<0.05)。注射后24h,球旁注射组大鼠双眼房水地塞米松浓度低于球后注射组,差异有统计学意义(P<0.05)。
3讨论
本研究发现,三种不同途径注射地塞米松磷酸钠或生理盐水后2h时,大鼠血糖浓度均有一过性升高,分析认为,当机体处于应激状态时,下丘脑-垂体-肾上腺轴和交感神经肾上腺系统激活,机体释放儿茶酚胺、皮质醇、生长激素、胰高糖素等分解代谢激素,这些激素直接刺激糖原分解、糖原异生,升高血中葡萄糖[12]。由于STZ的作用,大鼠胰岛B细胞坏死[13],导致胰岛B细胞功能缺陷,无法对血糖进行有效调控,导致血糖升高[14]。Zhang等[15]研究发现,玻璃体视网膜手术后T2DM患者眼周注射地塞米松后血糖升高,汪彬等[16]研究发现1型糖尿病大鼠眼局部注射地塞米松后大鼠血糖升高。此外,有研究表明,水合氯醛可提高实验动物的血糖水平[17]。由此可知,T2DM大鼠血糖升高可能是多因素共同协作的结果。本研究发现,注射地塞米松磷酸钠后大鼠血糖升高水平略高于注射生理盐水。Kymionis等[18]评估眼局部使用地塞米松对糖尿病患者血糖水平的影响,结果显示地塞米松组糖尿病患者血糖水平显著升高(P=0.003),而对照组(平衡盐溶液)未发现任何统计学差异,说明眼局部使用地塞米松提高了控制性糖尿病患者的血糖水平。
本研究结果表明,眼局部三种途径给药后,结膜下注射较球旁和球后注射后房水地塞米松浓度先达到峰值。Kim等[19]发现皱襞部、扁平部是巩膜最具渗透性的区域,药物经巩膜到达眼前段,且药物在巩膜的渗透性并不依赖于其亲脂性[20],本实验采用的注射用地塞米松磷酸钠为水溶性,易于巩膜吸收。因结膜下注射比球旁、球后注射后药物能更接近巩膜,故结膜下注射比球旁、球后注射经巩膜扩散量更大。此外,我们观察到大鼠眼局部结膜下注射地塞米松磷酸钠后,部分液体从针孔处溢出,溢出的药物可通过角膜途径吸收。Urtti等[21]研究发现,局部应用滴眼液后前房房水中的药物峰值浓度可在20~30min后出现;Ghate等[22]研究发现,结膜下注射NaF 2h时可在视网膜上观察到浓度峰值;Weijtens等[23]评估结膜下注射地塞米松患者房水、玻璃体和血清中的地塞米松浓度,并与球周注射比较,分析结膜下注射作为将地塞米松输送到玻璃体内的有效性,结果发现注射后2.5h,房水中估计的最大地塞米松浓度为858ng/mL,达到药物浓度峰值,结膜下注射2.5mg地塞米松后玻璃体地塞米松峰值浓度比球周注射5mg地塞米松后高出3倍,该研究还发现地塞米松从房水扩散到玻璃体腔可能是地塞米松进入玻璃体腔的第三种方式。这与本研究观察到结膜下注射途径先出现药物浓度峰值是一致的。
此外,我们发现,眼局部三种途径给药后,药物浓度峰值结膜下注射(957.34±3.60ng/mL)>球后注射(859.60±3.56ng/mL)>球旁注射(732.38±4.56ng/mL)。Cheruvu等[24]研究发现,脂族化合物如地塞米松在Bruch膜和脉络膜内显著滞留,可能是由于黑色素水平较高。视网膜色素上皮(RPE)和脉络膜都含有丰富的黑色素,球旁和球后注射药物经巩膜渗透进入玻璃体内,从而弥散至前房,药物浓度峰值出现在结膜下途径之后。Weijtens等[25]评估球周注射、结膜下注射地塞米松后视网膜下液中地塞米松浓度,研究发现球周注射、结膜下注射视网膜下液中最大地塞米松浓度分别为82.2、359ng/mL。提示与球周注射相比,结膜下注射地塞米松能更有效地将药物递送到视网膜下液中。说明经结膜下途径到达眼内的药物浓度高于眼周途径,这与本研究结果一致。另有研究认为,球周注射为有创给药方式,长期给药易造成局部异物反应,引起结膜粘连,给患者带来主观不适[26],球旁、球后注射可能导致眼睑皮下出血、结膜水肿、球后出血、上睑下垂、刺破眼球等并发症[27]。我们在解剖取样时也发现部分大鼠出现眼球球壁局部血肿、球后血肿现象,但具体机制尚待进一步研究。
综上所诉,三种途径注射地塞米松对T2DM大鼠血糖的影响无明显差异,而结膜下注射地塞米松操作简单,可在短时间内达到较高的药物浓度,是一种较为方便的地塞米松给药方式。随着对巩膜、脉络膜、RPE层药物动力学认知的不断提升以及材料工程学、药物试剂的发展,眼部给药方式和新型材料得到了深入研究,期待给患者带来新的治疗希望。

