PNCK对鼻咽癌细胞增殖和凋亡作用的研究
陈光浩 方靖萱 彭素娟 严炜薇 王福海 陈承哲 陈泗川 潘建基 邱素芳
鼻咽癌是我国南方常见的头颈部恶性肿瘤之一,发病率约25~30/10万[1]。鼻咽因解剖部位深,结构复杂,恶性程度高,不易早期发现,鼻咽癌的早期诊断和治疗的研究一直是我国放射肿瘤学家们研究的重点之一。随着调强放射治疗技术的广泛应用,鼻咽癌的局部区域控制率和总生存率有所提高[2-3],但中晚期患者5年生存率仅60%~70%[4-5]。因此,阐明鼻咽癌发病机制、开发新的治疗靶点对提高晚期患者存活率十分重要。
妊娠上调的非泛素性钙调蛋白激酶(Pregnancy-upregulated nonubiquitous calmodulin kinase,PNCK)是钙调蛋白激酶I家族的独特成员,与催化结构域内的钙调蛋白激酶I最为同源。相关文献发现PNCK基因在乳腺癌和肾癌中呈特异性高表达,该基因与肿瘤细胞的增殖密切相关[6]。有报告显示与良性乳腺组织相比时,PNCK mRNA表达在人类乳腺癌亚组织中上调3~5倍,而且与细胞的增殖密切相关[7]。然而,PNCK基因在鼻咽癌中的表达和作用研究甚少,本研究旨在检测PNCK在鼻咽癌肿瘤组织中表达水平,并探究PNCK对鼻咽癌细胞增殖的影响。本研究为揭示鼻咽癌发病机制、开发肿瘤治疗新靶点提供相应的研究基础。
1 材料与方法
1.1 细胞与主要试剂
人鼻咽癌细胞株CNE-2Z保存于福建省肿瘤医院肿瘤放射生物研究所。细胞在含10%胎牛血清和1%双抗(青霉素/链霉素)的DMEM培养基中常规培养,0.25%胰蛋白酶消化传代。
1.2 PNCK基因PSCSI-GFP慢病毒载体构建
实验使用GV115载体,以PNCK基因为模板选取靶点序列:TCAGCAGCGTCTACGAGAT。在此基础上设计2个shRNA干扰序列构建载体,同时在序列前边和后边添加限制性内切酶酶切位点。在退火缓冲液内溶解单链DNA oligo干粉,将浓度为20 μM的混合液放入90℃水浴,15 min后拿出放于室温环境下自然冷却,形成双链片段,具有黏性末端。根据NEB说明书配制AgeI和EcoRI 50 μL双酶切反应体系,使GV115载体线性化。将反应体系于37℃下充分反应1 h后,将目的片段切胶回收。根据Fermentas T4 DNA Ligase说明书配制20 μL双链DNA oligo反应体系,并将其连接线性化载体,置于16℃下反应1~3 h。将连接产物转化大肠杆菌感受态细胞,然后进行阳性克隆的菌落PCR鉴定。并对Sanger进行测序测试,在LB液体培养基(含Amp)中加入序列正确的菌液,于37℃下恒温摇床内震荡培养,过夜后提取质粒。
1.3 慢病毒包装与感染
取细胞状态良好、处于对数生长期的CNE-2Z细胞,接种于6孔板中,按照2×105个/孔接种,继续培养,确保加入病毒进行感染时细菌铺板量达15%~30%。在对照组shCtrl中加入2.5 μL病毒滴度为8×108TU/mL的病毒,在实验组shPNCK中加入4 μL病毒滴度为5×108TU/mL的病毒。在荧光显微镜下观察感染后的细胞状态及感染效率。
1.4 Real-Time PCR
用Trizol法进行提取实验组shPNCK和对照组shCtrl的CNE-2Z细胞总RNA,用M-MLV将RNA反转录为cDNA。配制20 μL的体系,进行PCR扩增,反应条件为:95℃ 15 s,95℃ 5 s,60℃ 30 s,45个循环。PCR结束后,制作熔解曲线,反应条件为:95℃ 1 min;冷却至55℃,使DNA双链充分结合;从55℃开始到95℃,每增加0.5℃,保持4 s,同时读取吸光光度值,采用2-ΔΔCT法分析数据,实验至少重复两次。实验所用引物包括PNCK上游:5-TGACATCTCAGAATCAGCCAAAG-3′,下游:5′-GTGTCCGAGCAAAGTTCTTCC-3′;GAPDH上游:5′-TGACTTCAACAGCGACACCCA-3′,下游:5′-CACCCTGTTGCTGTAGCCAAA-3。
1.5 Western blot
提取实验组shPNCK和对照组shCtrl的CNE-2Z细胞总蛋白,经PBS液两次洗涤后,弃去PBS,加入适量预冷的2×Lysis Buffer,细胞刮刮下细胞转移入EP管中,冰上裂解10~15 min,取上清用BCA法测定蛋白浓度。每个上样孔上样量控制在20 μg蛋白,经10%SDS-PAGE电泳分离后,转膜至PVDF膜。置于5%脱脂牛奶内封闭处理1 h,一抗为兔抗人PNCK多克隆抗体(1∶1 000),4℃孵育过夜,漂洗后以辣根过氧化物酶标记的二抗,孵育1 h,采用ECL法曝光目的条带和内参,实验至少重复三次。
1.6 Caspase3和Caspase7活性检测
Caspase3和Caspase7活性检测采用Caspase3和Caspase7活性细胞凋亡检测试剂盒,操作步骤按照说明书进行,实验至少重复三次。
1.7 MTT法检测细胞增殖
消化、收集对照组shCtrl和实验组shPNCK的CNE-2Z细胞以100 μL/孔接种于96孔板中,分板后24~120 h加入20 μL 5 mg/mL的MTT溶液,充分反应4 h后完全吸去培养液,注意不要吸掉孔板底部的甲瓒颗粒,后加入100 μL DMSO溶解甲瓒颗粒。经2~5 min充分振荡后,上酶标仪检测OD值,实验至少重复三次。
1.8 流式细胞仪检测细胞凋亡
消化、收集对照组shCtrl和实验组shPNCK的CNE-2Z细胞,上机离心处理5 min,转速1 300 rmp,去除上清液,放入4℃预冷的适量D-Hanks液中,pH为7.2~7.4,洗涤细胞,弃去洗液,沉淀。加入1×binding buffer洗涤细胞,弃去洗液,沉淀,上机离心处理3 min,转速1 300 rmp,收集细胞。加入200 μL 1×binding buffer重悬细胞沉淀一次。加入适量Annexin V-APC染色,于室温下避光孵育10~15 min。根据细胞量,补加400~800 μL 1×binding buffer,上机检测,实验至少重复三次。
1.9 组织免疫组化检测PNCK蛋白水平
回顾性收集2012年1月—3月在福建省肿瘤医院病理确诊为首诊无转移的鼻咽癌患者原发灶的石蜡组织10例和慢性鼻咽黏膜炎的正常鼻咽黏膜上皮的石蜡组织10例。10例鼻咽癌患者中,男性8例,女性2例,中位年龄为46岁,Ⅲ期有6例,Ⅳa期4例,所有分期均按鼻咽癌第七版UICC/AJCC分期。该研究所涉及的人组织样本得到福建省肿瘤医院伦理委员会的批准,项目伦理号为:2017-051-01。鼻咽癌组织石蜡切片常规脱蜡、水化,用PBS配置新鲜的H2O2,室温封闭10 min。高温抗原修复。自然冷却至室温后,置入蒸馏水中浸泡10 min,采用10%血清封闭30 min。加入对应的一抗(1∶50,Sigma,USA)孵育过夜,TBS洗2遍,每次5 min,加入二抗室温孵育60 min。DAB染色,苏木素染核、洗涤、干燥、封片,显微镜下观察。其最终的免疫组化评判标准主要根据染色强度和阳性细胞百分比的乘积打分,阳性细胞百分数:0分:0%阳性细胞数;1分:1~25%阳性细胞数;2分:26~50%阳性细胞数;3分:51~75%阳性细胞数;4分:≥71%阳性细胞数。染色强度评分:0分:无着色;1分:较弱;2分:中等;3分:较强。然后用染色强度和阳性细胞百分比相乘,算出最后的积分,范围为0~12分。
1.10 统计学分析
采用SPSS 19.0版软件分析处理所有数据,采用单因素方差分析(One way ANOVA)比较两组及以上的样本资料,并采用Bonferroni法进行两两比较,通过重复测量方差分析计算PNCK shRNA转染对CNE-2Z细胞增殖的影响,P<0.05为差异有统计学意义。
2 结果
2.1 鼻咽癌肿瘤组织中PNCK表达水平
为了检测鼻咽癌肿瘤组织中PNCK蛋白表达水平,我们收集10例鼻咽癌患者肿瘤组织和10例慢性鼻咽黏膜炎的正常鼻咽黏膜上皮组织。免疫组织化学方法结果表明,PNCK在鼻咽癌组织中表达在细胞质和细胞核上,与正常组织相比,PNCK在肿瘤中的免疫组化积分明显较高,即PNCK蛋白在肿瘤组织中表达量明显升高(P<0.001)(图1)。
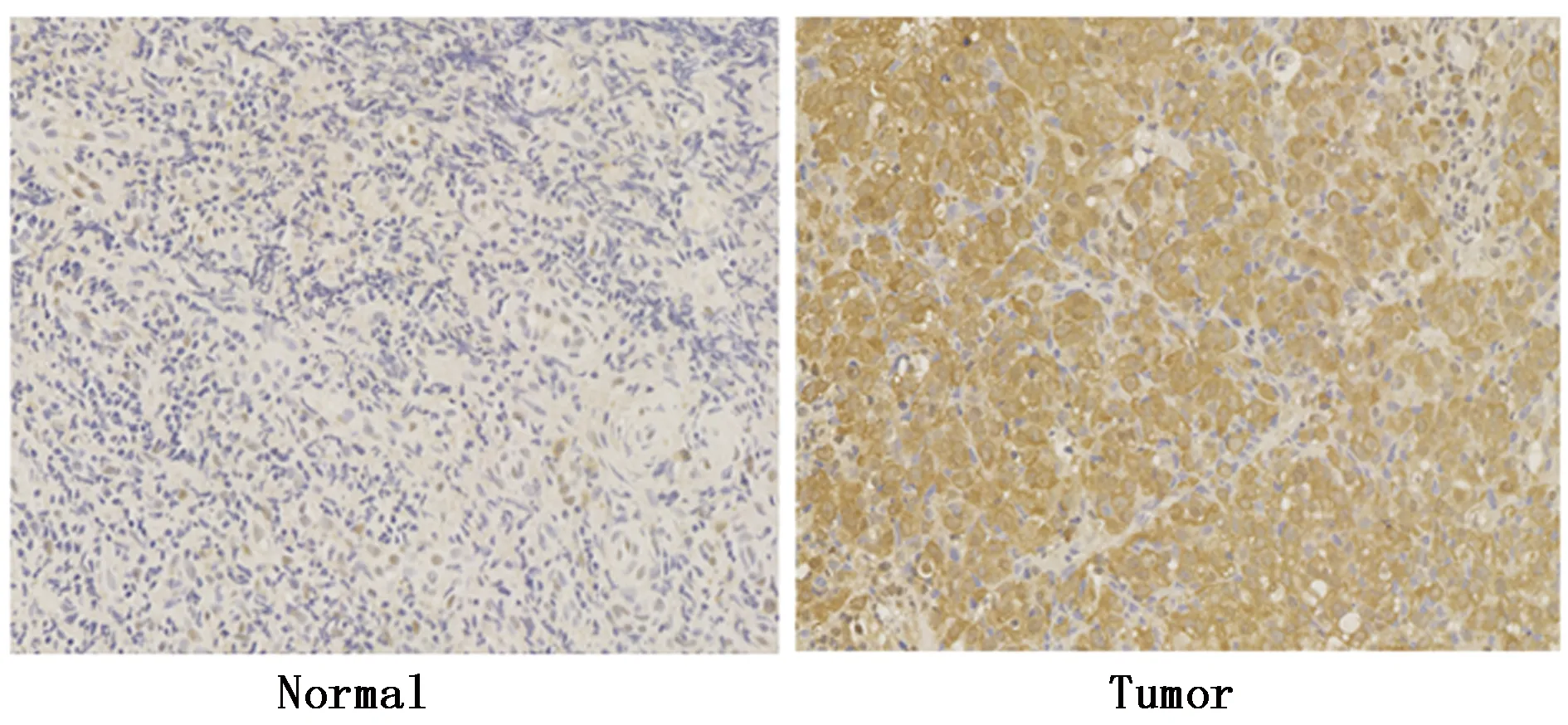
图1 鼻咽癌组织PNCK蛋白表达水平Figure 1 The expression of PNCK protein in nasopharyngeal carcinoma tissues
2.2 shRNA转染对PNCK基因表达的影响
为了干扰PNCK表达,本研究采用慢病毒感染方法将shPNCK转染至CNE-2Z细胞中。48 h后,Real time PCR验证转染效果,实验组shPNCK的CNE-2Z细胞中PNCK的表达显著下调,与对照组shCtrl相比,差异具有统计学意义(P<0.01)。Western blot结果同样说明shPNCK转染后PNCK蛋白表达明显降低,提示CNE-2Z细胞中PNCK基因在mRNA和蛋白水平的表达量受到抑制(图2)。

图2 慢病毒干扰CNE-2Z细胞中PNCK表达Figure 2 The expression of PNCK in CNE-2Z cells transferred lentivirusNote:A.The expression of PNCK at levels of mRNA;B.The expression of PNCK at levels of protein,**P<0.01,when compared with the shCtrl group.
2.3 PNCK shRNA转染对CNE-2Z细胞增殖的影响
经shRNA慢病毒感染72 h后,细胞铺于96孔板,铺板数为2 000个细胞。实验组shRNA转染后24 h及48 h的增殖抑制率与对照组无统计学差异(P>0.05),但72、96、120 h的增殖抑制率均明显高于对照组shCtrl(P<0.05)(图3)。
2.4 PNCK shRNA转染对CNE-2Z细胞凋亡的影响
shRNA慢病毒感染后72 h传代,在室温中调整细胞悬液浓度至1×104细胞/孔,并将细胞按照每孔100 μL加入96孔板中,然后分别将100 μL Caspase3/7反应液加入并共孵育2 h,然后上酶标仪检测。结果表明,与对照组shCtrl比较,实验组shRNA的CNE-2Z细胞中Caspase3和Caspase7活性升高,具有统计学意义(P<0.01)(图4)。此外,流式细胞术结果表明,与对照组相比,实验组CNE-2Z细胞凋亡率升高(P<0.01)(图5),这些结果提示PNCK基因与CNE-2Z细胞的凋亡显著相关。

图3 干扰PNCK表达后CNE-2Z细胞增殖变化Figure 3 The knocking down PNCK inhibited proliferation of CNE-2Z cellsNote:A.The curves of CNE-2Z cells between the control RNA and PNCK shRNA groups at wavelength of 490 nm;B.The fold changes of CNE-2Z cells between the control RNA and PNCK shRNA groups at wavelength of 490 nm.**P<0.01;***P<0.001,when compared with the shCtrl group.

图4 干扰PNCK表达后CNE-2Z细胞Caspase3和Caspase7活性变化Figure 4 The activity of caspase-3,7 in CNE-2Z cells after knocked-down PNCKNote:** P<0.01,when compared with the shCtrl group.

图5 干扰PNCK表达后CNE-2Z细胞凋亡率变化Figure 5 The apoptotic rates of CNE-2Z cells after knocked-down PNCK Note:** P<0.01,when compared with the shCtrl group.
3 讨论
PNCK是近年来研究癌症靶向药物方面的热点之一,它是钙调蛋白激酶I家族的独特成员,与催化结构域内的钙调蛋白激酶I最为同源,具有丝氨酸/苏氨酸激酶活性,人PNCK编码基因定位于Xq28,编码蛋白分子量为38 kDa。研究发现,PNCK在小鼠乳腺发育过程中其表达呈现时间和空间特异性,伴随着乳腺上皮细胞增殖和终末分化的减少,PNCK的表达逐渐上调,在怀孕晚期达到最高水平的表达;在乳腺中,PNCK以上皮特异性和异质性的方式表达,表明该激酶的表达可能限于特定的乳腺上皮细胞类型[7]。有研究发现,PNCK的表达与乳腺癌转基因小鼠来源的乳腺上皮细胞系中的癌基因相关:c-myc或int-2/Fgf3转基因小鼠乳腺来源细胞均表达PNCK,而neu或H-ras来源的细胞则不表达;以类似的方式,人PNCK基因仅在部分人乳腺癌细胞中表达,表明PNCK可能在乳腺发育中发挥作用,并且该激酶的表达被限制在人乳腺上皮细胞[7]。此外,与良性乳腺组织相比,PNCK基因在人乳腺癌组织中表达上调3~5倍,而且与细胞的增殖密切相关,表明PNCK可能参与乳腺癌发生发展。进一步研究发现,乳腺癌中PNCK可以通过干扰热休克蛋白Hsp90活性引起配体依赖的EGFR降解[8-9]。除此之外,学者发现肾癌患者中PNCK存在高表达;和PNCK低表达患者相比,PNCK高表达的患者总生存率较低,是肾癌不良预后的独立预测因素[10]。以上结果表明PNCK该基因与肿瘤细胞的增殖功能密切相关。
本研究选取福建省肿瘤医院活检鼻咽癌癌组织10例及鼻咽正常组织10例作为对照组,首先通过免疫组织化学、Real time PCR和Western blot方法比较PNCK基因在鼻咽癌组织和细胞中的表达情况,发现PNCK基因在鼻咽癌组织和细胞中呈高表达。本研究进一步构建敲除PNCK基因的鼻咽癌细胞株CNE-2Z细胞为对象,进行后续细胞功能实验,MTT法显示实验组(CNE-2Z)细胞增殖减缓,表明PNCK基因敲除对细胞增殖功能密切相关。
大量研究结果显示,在肿瘤病情进展及其治疗期间细胞凋亡扮演了重要角色[11-12]。本研究采用凋亡率评价靶向抑制PNCK基因表达对细胞凋亡的影响,发现shPNCK组较对照组的细胞凋亡数明显增多,凋亡率明显上升,提示PNCK与鼻咽癌细胞凋亡关系密切,推测其可能与诱导细胞凋亡的相关基因的表达相关。
综上所述,通过shRNA抑制PNCK基因表达可抑制增殖并诱导凋亡,对鼻咽癌的靶点治疗有一定价值。

