透明带激光操作对玻璃化冻融囊胚复苏及孵出动态模式的影响
薛林涛,王世凯,覃捷,李政达,周亭亭,毛献宝,张小慧,韦娉嫔,刘庆友,谭卫红*
(1.广西壮族自治区人民医院生殖医学与遗传中心,南宁 530021;2.广西大学亚热带生物资源保护与利用国家重点实验室,南宁 530004)
随着囊胚培养体系的不断完善及玻璃化冷冻技术的成功应用,玻璃化冻融囊胚移植在体外受精治疗周期中已成为一种常规技术。为了提高囊胚玻璃化冻融复苏效果及胚胎种植效率,许多研究采用在玻璃化冷冻前后对囊胚进行透明带激光操作,这主要包括冷冻前激光人工皱缩(Artificial shrinking,AS)和解冻后激光辅助孵化(Artificial hatching,AH),但是由于缺乏大规模随机临床对照试验证据支撑,囊胚透明带操作的临床应用仍然存在争议[1]。而时差胚胎培养监测技术(Time-lapse)的出现可以实现对胚胎体外发育全程进行动态监测,获取胚胎发育生理事件发生时间点和动态模式的量化数据,在胚胎发育研究方面具有独特优势[2]。本研究选择体外受精周期病人的剩余囊胚,采用随机对照试验,利用Time-lapse系统监测不同透明带激光操作方式对玻璃化冻融囊胚复苏后的孵出模式和动态发育参数的影响,探讨透明带激光操作在囊胚玻璃化冻融周期中的应用价值和安全性。
资料与方法
一、研究对象
本研究所用胚胎均来源于2017年4月至2018年6月在广西壮族自治区人民医院生殖医学与遗传中心接受体外受精治疗患者移植或冷冻后的剩余囊胚。研究所用囊胚评级方法参照Gardner囊胚分级法[3]。
囊胚入选标准为:受精方式为体外受精,且冷冻前囊胚透明带完整;受精后第6天囊胚;囊胚分期为3期和4期;囊胚内细胞团和滋养层评级均≥C级。
囊胚排除标准为:冷冻前囊胚腔发生自然皱缩;冷冻过程中除本研究分组设计的激光人工皱缩操作外,其他原因导致囊胚透明带破损者。
获所有患者知情同意并签署科研知情同意书,且通过伦理委员会批准(KYZC-2015-01)。
二、研究方法
1.试验分组:囊胚冷冻前随机分为人工皱缩组(AS组,接受激光人工皱缩后冷冻)和未人工皱缩组(NAS组,直接冷冻)两组;每组囊胚解冻后再随机分为辅助孵化组(AH组,激光辅助孵化)和未辅助孵化组(NAH组,直接培养)两个亚组。因而,本研究中囊胚共分为4组,即AS+AH组、AS+NAH组、NAS+AH组和NAS+NAH组。采用随机数字表法随机分组。
2.囊胚玻璃化冷冻及解冻:囊胚玻璃化冷冻及解冻均采用COOK玻璃化冷冻解冻试剂盒(K-SIBV/W-5000,COOK,澳大利亚)。所有试剂使用前预热平衡至37℃,具体操作过程参见文献[4]。冷冻载体为HSV封闭式载杆(025250,Cry Bio System,法国),每个载杆均放置一个囊胚。
3.囊胚激光人工皱缩及辅助孵化:囊胚透明带激光操作采用OCTAX激光破膜仪(OCTAX,MTG,德国)。囊胚冷冻前将其放置于激光专用物镜下,打开激光发射器的锁定水平位,将其放置在囊胚内细胞团对侧滋养层细胞连接处,调节激光发射时间给予单次激光打孔,而后放置于37℃、6%CO2培养箱培养10 min,待囊胚腔完全皱缩后进行玻璃化冷冻;囊胚解冻后立即进行激光辅助孵化,选择透明带间隙较大或碎片较多处作为孵化部位,激光溶解约1/4透明带,而后清洗换液移入时差培养皿继续培养。
4.囊胚时差培养监测:囊胚解冻后移入预先配制的9孔Primo Vision时差培养皿(16606,Vitrolife,丹麦),其中加入37℃、6%CO2平衡过夜的囊胚培养液,而后放入Primo Vision(Primo Vision Evo,Vitrolife,匈牙利)时差胚胎监测系统培养48 h,培养环境为37℃、6%CO2、5%O2。培养箱内预先安装好Primo Vision时差系统镜头并连接Analyzer图像分析软件,设置图像拍摄间隔频率为5 min,7个等距焦平面扫描间隔频率为60 min。
5.观察指标:采用Time-lapse监测解冻囊胚发育进程,所有动态发育参数时间点判定由同一名经验丰富的专业技术人员完成。解冻囊胚继续培养后囊胚腔重新扩张且充满透明带判定为囊胚复苏成功,该时间点判定为囊胚复张时间;囊胚细胞从透明带开始外溢判定为囊胚孵出,该时间点判定为囊胚孵出开始时间;囊胚细胞完全摆脱透明带整体从透明带中溢出判定为囊胚完全孵出,该时间点判定为囊胚完全孵出时间;囊胚细胞从透明带缺口溢出但未使缺口扩大,在透明带内外两侧形成8字型囊胚腔判定为8字型孵出;囊胚腔作为一个整体从透明带缺口呈U型溢出判定为U型孵出;囊胚培养过程中成腔囊胚腔液自然释放皱缩成无腔囊胚判定为囊腔回缩,一次囊腔皱缩并重新扩张周期判定为一次囊腔回缩。具体见图1。

A:皱缩囊胚;B:复张囊胚;C:激光人工皱缩囊胚(红色箭头示透明带开孔);D:8字型孵出囊胚;E:激光辅助孵化皱缩囊胚(绿色箭头示透明带开孔);F:囊胚开始孵出;G:U型孵出囊胚;H:完全孵出囊胚
三、统计学处理
结 果
本研究共纳入212个囊胚,根据分组方法随机分为AS+AH组、AS+NAH组、NAS+AH组、NAS+NAH组共计4个亚组,每组各53个囊胚。3期囊胚占比分别为5.66%(3/53)、9.43%(5/53)、5.66%(3/53)、9.43%(5/53),组间差异无统计学意义(P>0.05)。
一、透明带激光操作对玻璃化冻融囊胚复苏效率及孵出模式的影响
AS+AH组及AS+NAH组囊胚解冻后复苏率显著高于NAS+AH组及NAS+NAH组(P<0.05),而AS+AH组与AS+NAH组、NAS+AH组与NAS+NAH组亚组间囊胚解冻后复苏率无显著差异(P>0.05);NAS+NAH组的孵出率显著低于其余3组(P<0.05)。在孵出模式的对比中,与AS+AH组相比,AS+NAH组和NAS+NAH组的完全孵出率及U型孵出率均显著下降,而8字型孵出率显著升高(P均<0.05),但NAS+AH组各指标与之无统计学差异(P>0.05);NAS+AH和NAS+NAH组在孵出率、完全孵出率及U型孵出率上有显著差异,后者较前者显著下降(P<0.05)(表1)。
二、透明带激光操作对玻璃化冻融囊胚孵出动态参数的影响
4组囊胚解冻后复张时间无显著差异(P>0.05);NAS+NAH组囊胚孵出开始时间显著晚于其他3组(P<0.05);AS+NAH组及NAS+NAH组囊胚完全孵出时间显著晚于AS+AH组与NAS+AH组(P<0.05);AS+AH组与NAS+AH组囊腔回缩次数显著少于AS+NAH组及NAS+NAH组(P<0.05)(表2)。
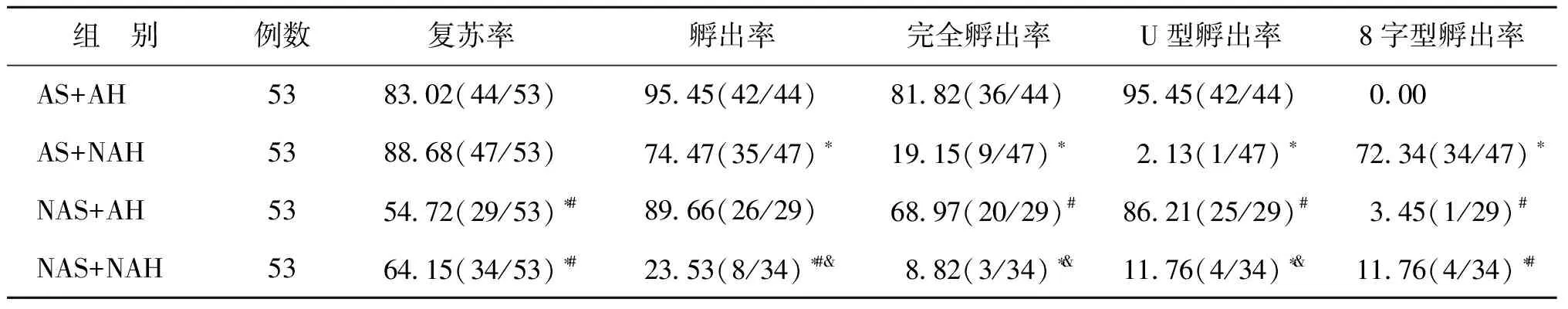
表1 透明带激光操作对玻璃化冻融囊胚复苏及孵出模式的影响(%)
注:与AS+AH组比较,*P<0.05;与AS+NAH比较,#P<0.05;与NAS+AH组比较,&P<0.05

表2 透明带激光操作对玻璃化冻融囊胚发育及孵出动态参数的影响(-±s)
注:与NAS+NAH组比较,*P<0.05;与AS+NAH组比较,#P<0.05
讨 论
玻璃化冷冻是目前囊胚冻存的常规技术,其通过高浓度的冷冻保护剂使胚胎细胞充分脱水,在快速降温过程中细胞内水分子由液相直接转变为固态玻璃相,从而避免冷冻过程中冰晶形成所造成的细胞损伤。玻璃化冷冻技术在临床的成功应用显著提高了囊胚冻融的效率。但是也有研究提出,囊胚腔液的存在导致囊胚冷冻过程中无法充分脱水,其残留的水分子致使降温过程中冰晶形成,是冻融囊胚细胞损伤的主要风险[5],而采用人工皱缩方式在囊胚冷冻前释放腔内液体,可显著提高囊胚玻璃化冻融的临床效率[6],同时由于激光脉冲操作简单快速,激光人工皱缩在临床上应用最为广泛[7]。本研究通过随机对照试验比较了激光人工皱缩对囊胚玻璃化冻融复苏效果的影响,结果显示冷冻前进行激光人工皱缩的囊胚冻融后复苏率显著高于未皱缩囊胚(83.02% vs.54.72%,P=0.003;88.68% vs.64.15%,P=0.005);同时,对于解冻后未行辅助孵化的囊胚,人工皱缩组的囊胚孵出开始时间显著早于未皱缩组[(445.86±423.62) vs.(732.75±448.45)min,P=0.026),囊胚孵出率也显著高于未皱缩组(74.47% vs.23.53%,x2=20.55,P<0.001),这说明囊胚冷冻前通过人工皱缩方式使囊胚腔液充分释放,有助于最大程度减少胚胎内残存水分子,降低玻璃化冻融过程中冰晶形成的风险,提高冻融囊胚发育潜力。
透明带是卵母细胞外周由糖蛋白构成的嗜酸性膜,其在早期胚胎发育过程中起到营养通道和保护屏障的重要作用,但是囊胚形成后适时从透明带中孵出是胚胎宫内种植的关键生理事件,早期研究发现胚胎冷冻过程会造成透明带硬化从而导致囊胚孵出困难[8],而人工辅助孵化可以降低囊胚孵出能量消耗阈值,从而有利于囊胚完成孵出,但是目前人工辅助孵化在临床中的应用仍存争议。有研究认为解冻囊胚进行人工辅助孵化可以获得更高的临床妊娠率[9],尤其对于形态评级较低或者受精后第6天形成的囊胚,辅助孵化能够显著提高其种植效率[10],同时也有研究认为辅助孵化无助于解冻囊胚移植周期临床结局改善,美国生殖医学协会关于辅助孵化在辅助生殖周期应用的共识仅将其列为C级证据[11],中华医学会生殖医学分会人类体外受精-胚胎移植实验室操作专家共识也不推荐所有移植胚胎进行辅助孵出[12]。究其原因,目前关于辅助孵化是否适宜主要依据的是临床试验数据,而影响胚胎种植的混杂因素众多,需要大样本量设计严格的试验以明确单个因素的真实影响,而目前尚缺乏相关研究结果报道;同时,由于临床试验研究中的研究指标多为临床妊娠率及种植率等,而无法对囊胚宫腔内移植后的发育过程进行追踪及量化分析。因此,有研究提出应用Time-lapse对囊胚解冻后体外的发育进程进行动态追踪,可以获取囊胚发育及孵化相关的更为详细直观的实验数据[13],在研究透明带操作对囊胚发育影响方面更具优势。Goto等[14]通过Time-lapse监测小鼠囊胚体外发育发现,透明带辅助孵化的小鼠囊胚孵出时间显著早于透明带完整囊胚;Ueno等[15]研究发现采用激光部分去除或者完全去除透明带的人体外受精周期解冻囊胚,其完全孵出率显著高于透明带完整囊胚,同时囊胚在纤连蛋白涂层培养皿中的体外粘附实验结果显示,完全去除透明带的囊胚发生粘附时间和细胞增殖扩展速率显著快于透明带部分去除或透明带完整囊胚。本研究结果也显示解冻囊胚进行激光辅助孵化后囊胚孵出率和完全孵出率显著提高,同时囊胚的孵出开始时间和完全孵出时间也显著早于未辅助孵化囊胚;另外还发现辅助孵化囊胚的囊腔回缩次数显著少于未辅助孵化囊胚,这说明透明带辅助孵化降低了囊胚孵出所需要的能量阈值,提高了囊胚孵出的速度和效率,有利于囊胚顺利摆脱透明带束缚从而进入胚胎植入阶段。
囊胚透明带操作虽然在提高冷冻复苏和孵出效率上具有优势,但是也存在一定风险。目前临床最具争议的是单卵双胎的发生,尤其对于冷冻前激光人工皱缩囊胚,激光在透明带上的细小开孔会人为制造囊胚孵出突破点,理论上会导致囊胚8字型孵出模式风险增加,而囊胚8字型孵出过程中内细胞团易受到硬化透明带嵌顿发生内细胞团分离,这是单卵双胎形成的最主要机制[16]。本研究通过Time-lapse监测解冻囊胚孵出的动态模式结果也显示,冷冻前激光人工皱缩的囊胚如果解冻后不进行人工辅助孵化,囊胚8字型孵出率显著增高,这也证实了以上假设;同时本研究结果也提示解冻后透明带辅助孵化能够显著改变囊胚孵出模式,辅助孵化组的囊胚8字型孵出率显著下降,囊胚孵出模式主要呈U型孵出。另外本研究也发现8字型孵出囊胚的完全孵出率显著下降,Time-lapse动态监测视频显示该类型囊胚细胞大多从透明带开孔溢出,而通过囊胚腔回缩复张使透明带变薄和开孔增大的能力显著减弱,从而导致囊胚无法完全孵出,尤其对于质量较差或冻融过程细胞受损的囊胚,发生此类风险的机率更高,而此类囊胚在与子宫内膜识别黏附过程中由于透明带的影响势必降低种植能力。因此,解冻囊胚特别是冷冻前人工皱缩囊胚进行辅助孵化有利于囊胚正常孵出。
综上所述,激光人工皱缩能够提高囊胚玻璃化冻融复苏效率,但是人工皱缩导致的透明带开孔增加了解冻囊胚孵出异常的风险,而激光辅助孵化可以改善囊胚孵出效率,有助于囊胚正常孵出,因此激光人工皱缩联合激光辅助孵化可以常规应用于囊胚玻璃化冻融周期,在改善囊胚复苏及孵出结局上具有一定价值。

