细叶远志皂苷对Aβ25-35诱导的SH-SY5Y细胞线粒体损伤的保护作用
王琳,金桂芳,余河汉,陆晓华,尤付玲,杨红
(广东药科大学生命科学与生物制药学院,广东 广州 510006)
阿尔茨海默病(Alzheimer’s disease,AD)是最常见的引起痴呆的神经退行性疾病。目前全世界约有5 000万人患有痴呆症,预计到2050年这一数字将达到1.52亿[1]。2018年痴呆症的总估计费用在2018年为1万亿美元,预计这一数字到2030年将翻一番[1]。AD的特征在于几种病理特征,包括老年斑,神经原纤维缠结和参与学习和记忆的脑区神经元丢失[2]。AD是一种多因素疾病,并且已经提出了不同的假设来解释AD发病机理。其中淀粉样蛋白级联假说自20世纪90年代提出以来已成为主要的一个学说[3]。研究发现线粒体功能障碍与AD相关,AD患者及小鼠常表现出线粒体功能障碍,同时,β-淀粉样蛋白(β-amyloid protein,Aβ)诱导产生过量的活性氧自由基 (reactive oxygen species,ROS)和Ca2+导致线粒体功能障碍,神经元能量代谢紊乱,导致神经元退化,是AD早期特征,并且在疾病的发生发展中起重要作用[4-6]。线粒体自噬调控蛋白PTEN-induced putative kinase 1 (PINK1)和帕金森蛋白2 (Parkin)监测线粒体的功能状态,在正常的线粒体中,PINK1会被线粒体相关酶以及蛋白连续降解,但在功能损伤尤其是膜电位下降的线粒体中,PINK1转位被抑制,使其在线粒体外膜累积,PINK1与外膜转运酶形成复合物,发生磷酸化[7]。磷酸化的PINK1磷酸化Parkin,促进Parkin从胞浆移位到受损的线粒体,介导线粒体自噬的发生[7]。
远志始载于《神农本草经》,为远志科植物远志PolygalatenuifoliaWilld.的干燥根,具有安神益智、改善认知缺陷、提高记忆力、抗抑郁等作用[8]。细叶远志皂苷是远志的主要活性成分,其能改善AD鼠记忆障碍[9-10],减少AD模型细胞中Aβ的分泌[11]。本研究旨在探讨细叶远志皂苷(Tenuifolin,Ten)对Aβ25-35诱导的SH-SY5Y细胞损伤的保护作用及线粒体功能的潜在联系。
1 材料与方法
1.1 材料
SH-SY5Y细胞(广东省生物活性药物研究重点实验室提供);Ten(成都普菲德生物技术有限公司);Aβ25-35 (Sigma公司);MTT(广州翔博生物科技有限公司);Parkin-siRNA (上海吉玛制药技术有限公司);caspase-3活性检测试剂盒、caspase-9活性检测试剂盒(碧云天生物技术有限公司);引物(生工生物工程股份有限公司);PrimeScriptTMRT Master Mix(Perfect Real Time)、SYBR® Premix Ex TaqTM(Tli RNaseH Plus)(TaKaRa公司);LC3B抗体(Abcam公司,ab48394);Rabbit anti-β-actin、Goat anti-rabbit IgG (γ-chain specific) (博士德公司);环胞霉素A(CsA,生工生物工程股份有限公司);ELx800酶标仪 (Biotek);Axio Observer A1荧光倒置显微镜 (Zeiss);CFX ConnectTM实时荧光定量PCR (Real-time PCR) 检测系统(美国伯乐公司);GeneGnome XRQ型凝胶成像系统(美国伯乐公司)。
1.2 Aβ25-35准备
用1.8 mL重蒸水将1 mg Aβ25-35溶解成浓度为500 μmol/L的母液,于37 ℃下孵育7 d以形成聚集形式的Aβ25-35,-20 ℃冷冻保存备测,测量前用培养基稀释成实验所需浓度。
1.3 siRNA制备
将合成的Parkin-siRNA和Negative control(NC)siRNA粉末用附送的DEPC水溶解,配置成20 μmol/L的样品储存液,分装-20 ℃保存。用培养基稀释适量体积的Parkin-siRNA,配制成含20 nmol/L Parkin-siRNA溶液的培养基。
1.4 细胞培养
SH-SY5Y细胞在含有10%(φ)的胎牛血清,100 U/mL青霉素和100 μg/mL链霉素的DMEM高糖培养液中,37 ℃、5%(φ) CO2条件下常规培养。每2~3天0.25%胰酶消化传代1次,取对数生长期的细胞进行实验。
1.5 MTT检测细胞活力
取对数生长期的SH-SY5Y细胞,以6×103/孔接种于96孔细胞培养板中,并且每组设置5个复孔,常规培养。24 h后加入Ten终浓度分别为0、25、50、100、200 μmol/L处理2 h,再加入终浓度为20 μmol/L的Aβ25-35处理24 h,然后加入5 mg/mL MTT工作液,10 μL/孔,37 ℃孵育4 h后吸弃培养液,并在各孔内加入150 μL DMSO,放置摇床上低速摇晃10 min,使结晶充分溶解,使用酶标仪测490 nm波长下各孔的吸光度(A)。实验重复3次,根据测得的A值计算细胞存活率。细胞存活率=(A实验组-A空白组)/(A对照组-A空白组)×100%。
1.6 caspase-3和caspase-9酶活力检测
SH-SY5Y细胞用Ten终浓度50 μmol/L处理2 h,再加入终浓度为20 μmol/L的Aβ25-35处理24 h。细胞收集后用PBS洗涤,加入裂解液后冰浴15 min,4 ℃ 12 000g离心10 min后取上清液,用Bradford蛋白浓度测定试剂盒测定蛋白浓度。按照caspase-3和caspase-9活性检测试剂盒设置反应体系。加入检测缓冲液、待测样品和Ac-DEVD-pNA(2 mmol/L)混匀,37 ℃孵育1~2 h,用酶标仪测定405 nm波长下的吸光度值,caspase-3和caspase-9酶活力以各实验组的吸光度与对照组细胞的吸光度之比值表示(A比值)。
1.7 RT-qPCR分析
SH-SY5Y细胞用Ten终浓度为50 μmol/L和Parkin-siRNA终浓度20 nmol/L处理2 h,再加入终浓度为20 μmol/L的Aβ25-35处理24 h。用Trizol提取细胞中的总RNA,取2 μL样品用用微量紫外/可见分光光度计测A260/280及RNA浓度。按照TaKaRa的PrimeScriptTMRT Master Mix(Perfect Real Time)试剂盒说明书进行逆转录反应以得到cDNA。然后,取cDNA按照SYBR® Premix Ex TaqTM(Tli RNaseH Plus)试剂盒说明书,在CFX Connect荧光定量PCR仪上进行Real Time PCR反应。
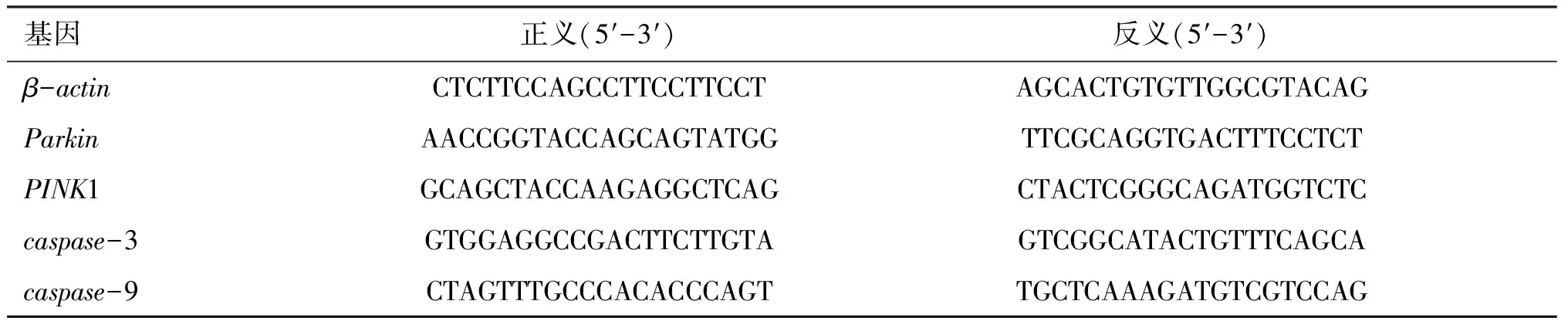
表1 引物序列Table 1 Primer sequences
1.8 Western blot检测细胞Cyt C及LC3蛋白水平
SH-SY5Y细胞用Ten终浓度50 μmol/L处理2 h,用CsA终浓度5 μmol/L处理2 h,再加入终浓度为20 μmol/L的Aβ25-35处理。培养24 h后用RIPA裂解液(含1 mmol/L PMSF)提取总蛋白,4 ℃,12 000g离心10 min,取上清,BCA蛋白检测试剂盒测蛋白浓度,制备电泳样品,用5%浓缩胶,12%分离胶,80 V 30 min,120 V 60 min SDS-PAGE电泳样品,200 mA湿转1 h,5%脱脂奶粉室温封闭1 h,4 ℃分别孵育Cyt C、LC3B抗体过夜,TBST洗膜3次,每次10 min,二抗室温孵育1 h,TBST洗膜3次,每次10 min。ECL化学反光显影,曝光,扫描。
1.9 统计学分析
所有实验数据用均数±标准差表示,采用统计学软件SPSS 20.0进行单因素方差分析及t检验,P<0.05为差异有统计学意义。
2 结果
2.1 Ten对Aβ25-35诱导损伤的SH-SY5Y细胞活力的影响
结果表明,Aβ模型组SH-SY5Y细胞存活率明显降低,不同浓度(25~200 μmol/L)Ten+Aβ组细胞活力显著高于Aβ模型组(图1)。
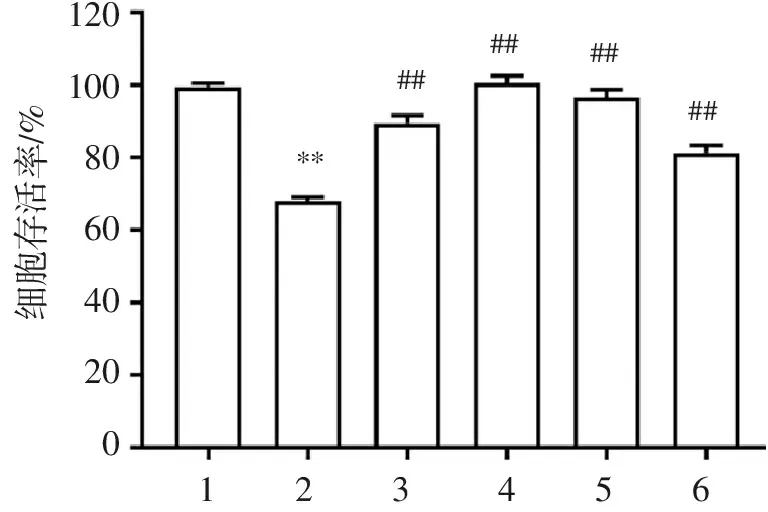
120100806040200**########细胞存活率/%123456
1. control; 2. Aβ(20 μmol/L); 3. Ten (25 μmol/L)+Aβ (20 μmol/L); 4. Ten (50 μmol/L)+Aβ(20 μmol/L); 5. Ten(100 μmol/L)+Aβ(20 μmol/L); 6. Ten (200 μmol/L)+Aβ (20 μmol/L)。与control比较:**P<0.01;与Aβ组比较:##P<0.01。
图1Ten对Aβ25-35诱导损伤的SH-SY5Y细胞活力的影响
2.2 Ten对Aβ25-35诱导的caspase-3和caspase-9酶活力及mRNA表达的影响
结果显示,与对照组相比,Aβ模型组显著增加caspase-3和caspase-9酶活力和mRNA表达水平;与Aβ模型组相比,Ten和siRNA明显抑制了Aβ诱导的caspase-3和caspase-9酶活力和mRNA表达水平(图2)。
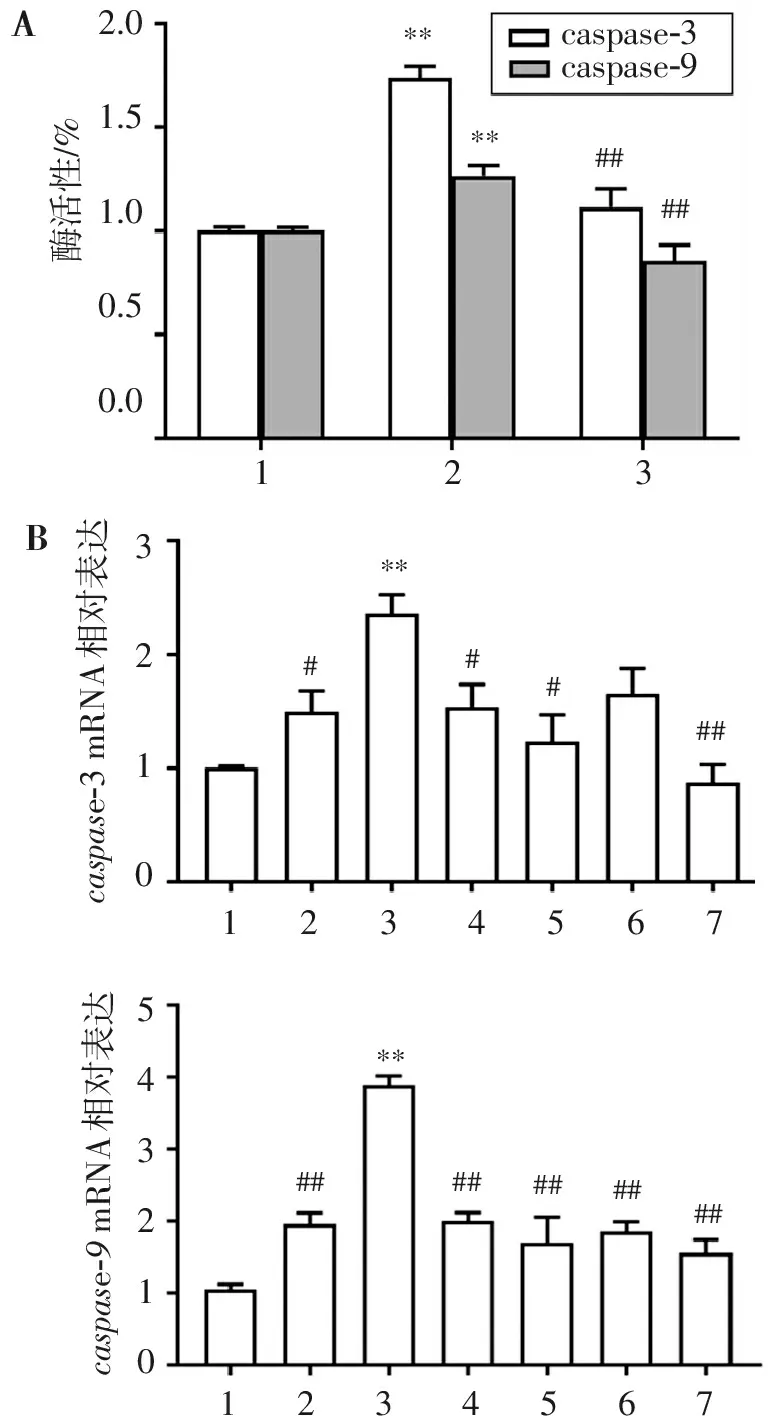
123caspase-3caspase-9****####酶活性/%2.01.51.00.50.01234567caspase-3mRNA相对表达3210#####**1234567543210##########**ABcaspase-9mRNA相对表达
A. caspase-3和caspase-9酶活力结果(1. control; 2. Aβ 20 μmol/L; 3. Ten 50 μmol/L+Aβ 20 μmol/L); B.caspase-3和caspase-9 基因表达水平直方图(1. control; 2. Ten 50 μmol/L; 3. Aβ 20 μmol/L; 4. Ten 50 μmol/L+Aβ 20 μmol/L; 5. siRNA 20 nmol/L; 6. siRNA 20 nmol/L+Aβ 20 μmol/L; 7. Ten 50 μmol/L+siRNA 20 nmol/L+Aβ 20 μmol/L)。与control比较:**P<0.01;与Aβ组比较:#P<0.05,##P<0.01。
图2Ten和siRNA对Aβ25-35诱导SH-SY5Y细胞caspase-3和caspase-9酶活力及mRNA的影响
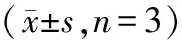
2.3 Ten对Aβ25-35诱导的SH-SY5Y细胞Cyt C蛋白水平的影响
CsA可通过阻断线粒体通透性转换孔,调节线粒体功能。图3结果表明,与对照组比,Aβ模型组胞质Cyt C水平显著增加;与Aβ模型组比,Ten+Aβ、 CsA+Aβ和Ten+CsA+Aβ组胞质Cyt C水平明显减少。结果表明,Ten和CsA能明显抑制Aβ诱导的Cyt C的释放。

12345672.01.51.00.50.0相对蛋白表达量1234567Cytcβ-actinBA##########**
A.Cyt C蛋白的Western blot结果显影图; B. Cyt C蛋白表达水平直方图;1. control; 2. Ten (50 μmol/L); 3. Aβ(20 μmol/L); 4. Ten (50 μmol/L)+Aβ(20 μmol/L); 5. CsA (5 μmol/L); 6. CsA (5 μmol/L)+Aβ (20 μmol/L); 7. Ten (50 μmol/L)+CsA (5 μmol/L)+Aβ (20 μmol/L)。与control组比较:**P<0.01;与Aβ组比较:##P<0.01。
图3Ten和CsA对Aβ25-35诱导SH-SY5Y细胞Cyt C蛋白表达的影响
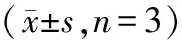
2.4 Ten对Aβ25-35诱导的PINK1和Parkin mRNA表达水平的影响
结果显示,与对照组相比,Aβ模型组能显著增加PINK1和Parkin mRNA的表达水平;与Aβ模型组相比,Ten和siRNA组明显抑制了Aβ诱导PINK1和Parkin mRNA的表达水平(图4)。结果表明,Ten和siRNA能明显降低Aβ诱导的PINK1和Parkin mRNA表达水平。
2.5 Ten对Aβ25-35诱导自噬标志性蛋白LC3表达水平的影响
图5 Western blot检测LC3 II/I结果显示,与对照组相比,Aβ模型组LC3 II/I比值显著增加,与Aβ模型组相比,Ten和CsA组明显抑制Aβ诱导的LC3 II/I的增加。LC3 II/I是自噬的标志物之一,结果表明,Aβ诱导自噬增加,且Ten和CsA能抑制Aβ诱导的自噬增加。

1234567PINK1mRNA表达1.51.00.50.03.02.52.01.51.00.50.01234567########*#####**BAParkinmRNA表达
A.PINK1 mRNA表达水平直方图;B. Parkin mRNA表达水平直方图;1. control; 2. Ten (50 μmol/L); 3. Aβ (20 μmol/L); 4. Ten (50 μmol/L)+Aβ (20 μmol/L); 5. siRNA (20 nmol/L); 6. siRNA (20 nmol/L)+Aβ (20 μmol/L); 7. Ten (50 μmol/L)+siRNA (20 nmol/L)+Aβ (20 μmol/L)。与control组比较:*P<0.05,**P<0.01;与Aβ组比较:#P<0.05,##P<0.01。
图4Ten和siRNA对Aβ25-35诱导SH-SY5Y细胞PINK1和Parkin mRNA的影响
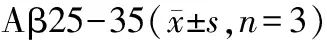
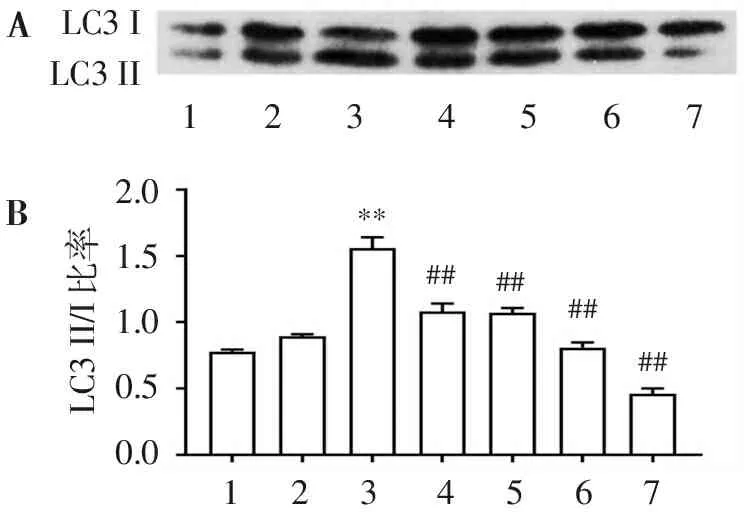
BALC3ILC3II12345672.01.51.00.50.0LC3II/I比率1234567########**
A. LC3 II/I蛋白的Western blot结果显影图; B. LC3-II/I蛋白表达水平直方图;1. control; 2. Ten (50 μmol/L); 3. Aβ (20 μmol/L); 4. Ten (50 μmol/L)+Aβ (20 μmol/L); 5. CsA(5 μmol/L); 6. CsA (5 μmol/L)+Aβ (20 μmol/L); 7. Ten (50 μmol/L)+CsA (5 μmol/L)+Aβ (20 μmol/L)。与control组比较:**P<0.01;与Aβ组比较:##P<0.01。
图5Ten和CsA对Aβ25-35诱导SH-SY5Y细胞LC3蛋白表达的影响
4 讨论
原发性老年痴呆症又称AD,是慢性进行性中枢神经系统变性导致的神经系统退行性疾病。线粒体功能障碍是AD病人脑部早期出现的病理特征之一[12],研究表明[13-17],AD患者及动物模型的细胞线粒体存在电子传递链损伤、线粒体DNA突变等,与氧化应激、Aβ沉积等病理改变相互促进,加剧AD病理损伤。Aβ可诱导神经细胞线粒体损伤致使线粒体膜电位(Δψm)下降,通透性转运孔开放,使位于线粒体内膜间隙的Cytc等释放至胞浆中,并在dATP 存在下与凋亡蛋白酶活化因子1结合形成多聚体,激活caspase-9,继而活化下游效应器caspase-3,启动caspase 的级联反应,进而导致细胞凋亡[18-19]。本研究显示,Aβ模型组细胞活力下降,同时胞浆Cyt C蛋白水平增加,caspase-3和caspase-9酶活力及mRNA的表达水平升高,而Ten处理后,细胞活力增加,同时明显抑制了Aβ诱导的Cyt C释放,降低了caspase-3和caspase-9酶活力及mRNA的表达水平,提高了SH-SY5Y细胞的活力。结果表明Ten能通过改善Aβ25-35诱导后线粒体功能损伤,发挥神经保护作用。
线粒体功能正常时,由于膜电压的抑制,PINK1被迅速降解,当线粒体膜电位去极化后,PINK1才以电压依赖的方式在线粒体外膜上稳定表达[20]。PINK1通过其激酶活性磷酸化Parkin,使Parkin定位于膜电位下降的线粒体[21],PINK1和Parkin共同监测线粒体的功能状态[22],启动线粒体自噬。CsA通过阻断线粒体通透性转换孔,调节线粒体功能及细胞存亡[23]。本研究显示,用Parkin siRNA 干扰Parkin基因表达,发现Aβ模型组PINK1和Parkin的mRNA表达水平增加,而Ten和Parkin siRNA组显著抑制了Aβ诱导的PINK1和Parkin的mRNA表达水平,Parkin siRNA组也明显下调了Aβ25-35刺激引起的caspase-9 mRNA的表达,Ten和CsA组明显抑制Aβ25-35诱导的Cyt C和LC3-II/I的表达水平增加,提示Ten具有与CsA相似的作用,减轻线粒体损伤。
本研究结果显示,Ten对Aβ25-35诱导的SH-SY5Y细胞线粒体损伤具有明显的保护作用。Ten为多途径、多靶点作用的药物,是治疗AD的潜在药物

