共振瑞利散射法和分光光度法快速测定3种细菌悬液的浓度
曹凯欣,邱佩佩,贺锦灿,邹志辉,白研,毋福海
(广东药科大学公共卫生学院,广东 广州 510310)
在药品、食品等微生物实验中,标准细菌悬液的制备是最基本的工作,快速确定细菌悬液浓度能提高微生物实验中实验评估及结果分析效率,而且能为细菌的分离鉴定及细菌药敏试验提供更好的数据支撑。目前,细菌悬液浓度的测定方法主要为比浊法[1-2]和平皿计数法[3-4],但比浊法用到的比浊仪在实验室中并不普及,标准比浊管的使用不方便,平皿计数法的操作复杂、耗时长,严重影响实验的进度及效率。
共振瑞利散射(resonance Rayleigh scattering,RRS)技术是20世纪90年代发展起来的光谱分析技术[5],具有快速、灵敏度高等优点,在药物、生物、环境等多个学科领域的分析研究中具有重要的应用[6-7]。已有研究报道,金黄色葡萄球菌和大肠埃氏菌能产生相似的RRS信号[8-9],RRS法也用于细菌的间接鉴别[10],但用RRS法检测细菌悬液浓度鲜见报道。
分光光度法是通过检测物质在被特定波长的光照射下的吸收强度,并对该物质进行定性和定量分析的方法[11-12]。分光光度法具有仪器简单、操作简便等优点。细菌悬液具有一定的浊度,对光具有一定的吸收,因此可以通过测定细菌悬液在某个波长下的吸光度值反映细菌悬液的浓度[13]。
食源性致病菌是一类以食品为传播媒介的致病性细菌,也是引起食源性疾病和食物中毒的主要原因。致病菌所引起的食源性疾病暴发案例占大多数,是食品安全的重大隐患,建立食源性致病菌的快速分析方法具有重要意义,而食源性致病菌悬液的快速计数是提高实际样品中细菌检测速度的前提。副溶血性弧菌、金黄色葡萄球菌和沙门氏菌是3种典型的食源性致病菌,也是《中国药典》常见的检定细菌。本研究针对常规细菌计数方法的不便,以副溶血性弧菌、金黄色葡萄球菌和沙门氏菌为例,考察细菌浓度与RRS值、吸光度值的关系,建立快速测定细菌悬液的RRS法和分光光度法,并对2种方法的优缺点进行比较,为细菌悬液的实际应用提供依据。
1 仪器与试剂
LRH-250生化培养箱(上海一恒科技有限公司);VM-03RU迷你涡旋混匀器(苏州捷美电子有限公司);WGZ-XT细菌浊度仪(杭州齐威仪器有限公司);F-2500荧光分光光度计(日本日立公司);U-3010紫外可见分光光度计(日本日立公司);721-100分光光度计(上海第三分析仪器厂)。
营养琼脂培养基(批号1066111,广东环凯微生物科技有限公司);NaCl(99.5%,广州化学试剂厂);生理盐水(0.9% NaCl水溶液,使用前灭菌处理);副溶血性弧菌(Vibrioparahaemolyticus)[ATCC17802],金黄色葡萄球菌(Staphylococcusaureus)[ATCC6538],沙门氏菌(Salmonella)[CMCC (B) 50071],菌种均购自广东省微生物研究所。所有供试菌经过增菌培养和选择性培养基分离培养后进行涂片染色镜检,在此基础上,副溶血性弧菌再结合耐盐试验和移种MIU培养基进行生化反应鉴定,金黄色葡萄球菌通过血浆凝固酶试验和血平板上形成明显的β溶血环进行鉴定,沙门氏菌则通过克氏双糖(KIA)复合试验和A~F群O多价血清凝集试验进行鉴定。
2 方法
2.1 细菌悬液的制备
不同浊度的细菌悬液[13]:接种副溶血性弧菌,金黄色葡萄球菌与沙门氏菌的新鲜培养物至斜面培养基(营养琼脂培养基+3% NaCl制得),于37 ℃生化培养箱内培养24 h,用生理盐水将3种细菌的斜面培养物配成麦氏浊度为0.4、0.5、0.6、0.7、0.8的细菌悬液。
系列浓度的细菌悬液[13]:将3种细菌培养物用生理盐水制成的初始细菌悬液,用平皿计数,并进行1∶2、1∶4、1∶8、1∶16、1∶32、1∶64、1∶128的倍比稀释,制成系列浓度的细菌悬液。
2.2 RSS法测定细菌悬液浓度
以生理盐水为空白对照液,依次在F-2500型荧光分光光度计上以λex=λem的模式进行同步扫描,在30 min内完成测定,记录470 nm处[8]空白试剂的RRS强度I0和细菌悬液的RRS强度IRRS,并计算变化量ΔIRRS(ΔIRRS=IRRS-I0)。
2.3 分光光度法测定细菌悬液浓度
分别取不同麦氏浊度及不同浓度的3种细菌的菌悬液,以生理盐水为空白对照液,依次测定在650 nm波长处的吸光度[13]。
3 结果
3.1 RSS法测定3种细菌悬液浓度
3.1.1 3种细菌的共振散射光谱 用生理盐水将副溶血性弧菌、金黄色葡萄球菌和沙门氏菌的斜面培养物制成初始菌悬液,以生理盐水为空白对照液,在F-2500型荧光分光光度计上以λex=λem的模式同步扫描RRS光谱,结果见图1。可见,3种细菌悬液均能产生RRS信号,RRS光谱具有一定的区别,在470 nm处均产生1个较强的RRS峰。将副溶血性弧菌、金黄色葡萄球菌和沙门氏菌的悬液放置不同时间(0、10、20、30、40、50、60 min),检测470 nm处的RRS值随放置时间的变化情况,结果表明:当放置时间在30 min内时,3种细菌悬液在470 nm处的RRS值变化率(与0 min比较)分别为-6.4%~1.7%、-4.1%~3.1%、-5.8%~2.3%;超过30 min时,RRS值显著下降,下降率超过15%。因此,制备的细菌悬液需控制在30 min内完成测定。

70006000500040003000200010000IRRS470nmVibrioparahaemolyticusStaphylococcusaureusSalmonella300400500600λ/nm
图13种细菌悬液的RRS谱图
Figure1RRS spectra of three kinds of bacterial suspension
3.1.2 菌悬液散射值与麦氏浊度的关系 取不同麦氏浊度的副溶血性弧菌、金黄色葡萄球菌、沙门氏菌菌悬液,以生理盐水为空白对照液,在F-2500型荧光分光光度计上以λex=λem的模式同步扫描RRS光谱。以麦氏浊度为横坐标,以470 nm处的RRS差值ΔIRRS为纵坐标、麦氏浊度(c)为横坐标作图,结果见图2。可见,麦氏浊度在0.4~0.8范围时,3种细菌悬液的麦氏浊度与散射值变化量存在良好的线性关系,线性回归方程分别为ΔI=1 610c+1 500.6、ΔI=1 684c+1 280.0、ΔI=1 273c+1 443.4,相关系数r值分别为0.990 9、0.990 8、0.984 5;副溶血性弧菌、金黄色葡萄球菌的斜率接近,而沙门氏菌的斜率略低。
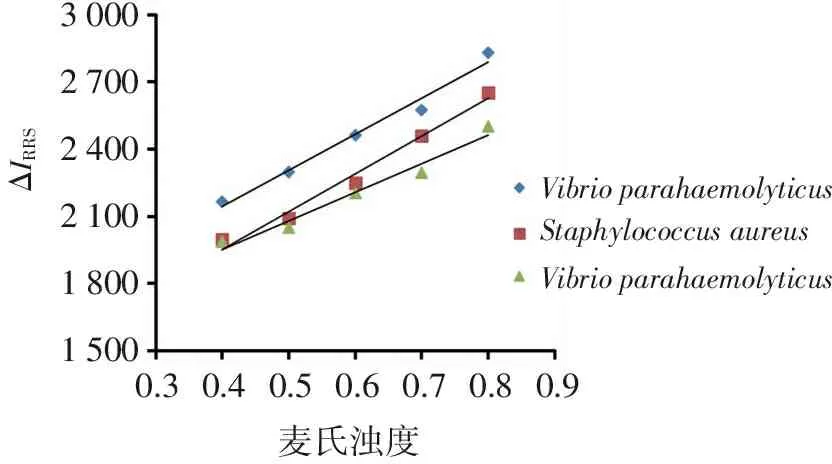
300027002400210018001500ΔIRRS0.30.40.50.60.70.80.9麦氏浊度VibrioparahaemolyticusStaphylococcusaureusVibrioparahaemolyticus
图23种细菌悬液的散射值变化量与麦氏浊度的线性关系图
Figure2The linear graph between the variation of scattering value and McGrady turbidity of three kinds of bacterial suspension
3.1.3 细菌悬液浓度与散射值的关系 按“2.1”项下的方法配制系列浓度的细菌悬液,以生理盐水为空白对照液,测定不同稀释度菌液的RRS光谱,结果见图3a、3c、3e所示;再分别记录470 nm处的RRS值,以细菌悬液浓度为横坐标、470 nm处的RRS差值ΔIRRS为纵坐标作图,结果见图3b、3d、3f所示。从图3可见,副溶血性弧菌、金黄色葡萄球菌、沙门氏菌的菌悬液浓度(c)分别在0.040×107~1.3×107、0.17×108~5.5×108、0.15×108~4.9×108cfu/mL范围内与470 nm处的散射值变化量(ΔIRRS)呈良好的线性关系,线性回归方程分别为ΔIRRS=4 655.8c+181.11、ΔIRRS=1 798.6c+370.28、ΔIRRS=1 440.1c+234.92,相关系数r值分别为0.999 8、0.998 7、0.999 4;金黄色葡萄球菌和沙门氏菌的斜率相近,而副溶血性弧菌的斜率比前两者大;通过计算,检出限分别为2.6×104、9.5×105、2.1×106cfu/mL。
3.2 分光光度法测定3种细菌悬液浓度
3.2.1 3种细菌悬液的紫外-可见吸收光谱 副溶血性弧菌、金黄色葡萄球菌和沙门氏菌的紫外-可见光谱见图4所示。可见,3种细菌的紫外-可见光谱相似,在紫外区均具有1个强吸收峰,而在可见区无吸收峰。
3.2.2 3种细菌悬液吸光度与麦氏浊度的关系 取不同麦氏浊度的副溶血性弧菌、金黄色葡萄球菌、沙门氏菌菌悬液,以生理盐水为空白对照液,按照《中国药典》二部附录的紫外可见分光光度法,测定650 nm波长处吸光度。以麦氏浊度(c)为横坐标、吸光度(A)为纵坐标作图,结果显示:在麦氏浊度为0.4~0.8的范围内,3种细菌悬液的麦氏浊度与吸光度均存在良好的线性关系,回归方程分别为A=0.423c+0.054、A=0.555c-0.046、A=0.514c+0.001,相关系数r值分别为0.991 5、0.992 0、0.996 5;不同细菌的回归方程的斜率有所不同。
3.2.3 细菌悬液吸光度与浓度的关系 按“2.1”项下方法配制系列浓度的细菌悬液,以生理盐水为空白对照液,测定不同稀释度菌液在650 nm处的吸光度。以细菌悬液浓度为横坐标、吸光度为纵坐标,拟合线性曲线,结果见表1。可见,副溶血性弧菌、金黄色葡萄球菌、沙门氏菌3种细菌的菌悬液的浓度分别在0.27×107~8.7×107、0.30×108~9.7×108、0.34×108~11×108cfu/mL范围内与吸光度呈较好的线性关系,相关系数r值分别为0.999 6、0.999 8、0.999 8;金黄色葡萄球菌与沙门氏菌的斜率相近,副溶血性弧菌的斜率略高;通过进一步计算,检出限分别为0.10×106、7.5×106、8.5×106cfu/mL。
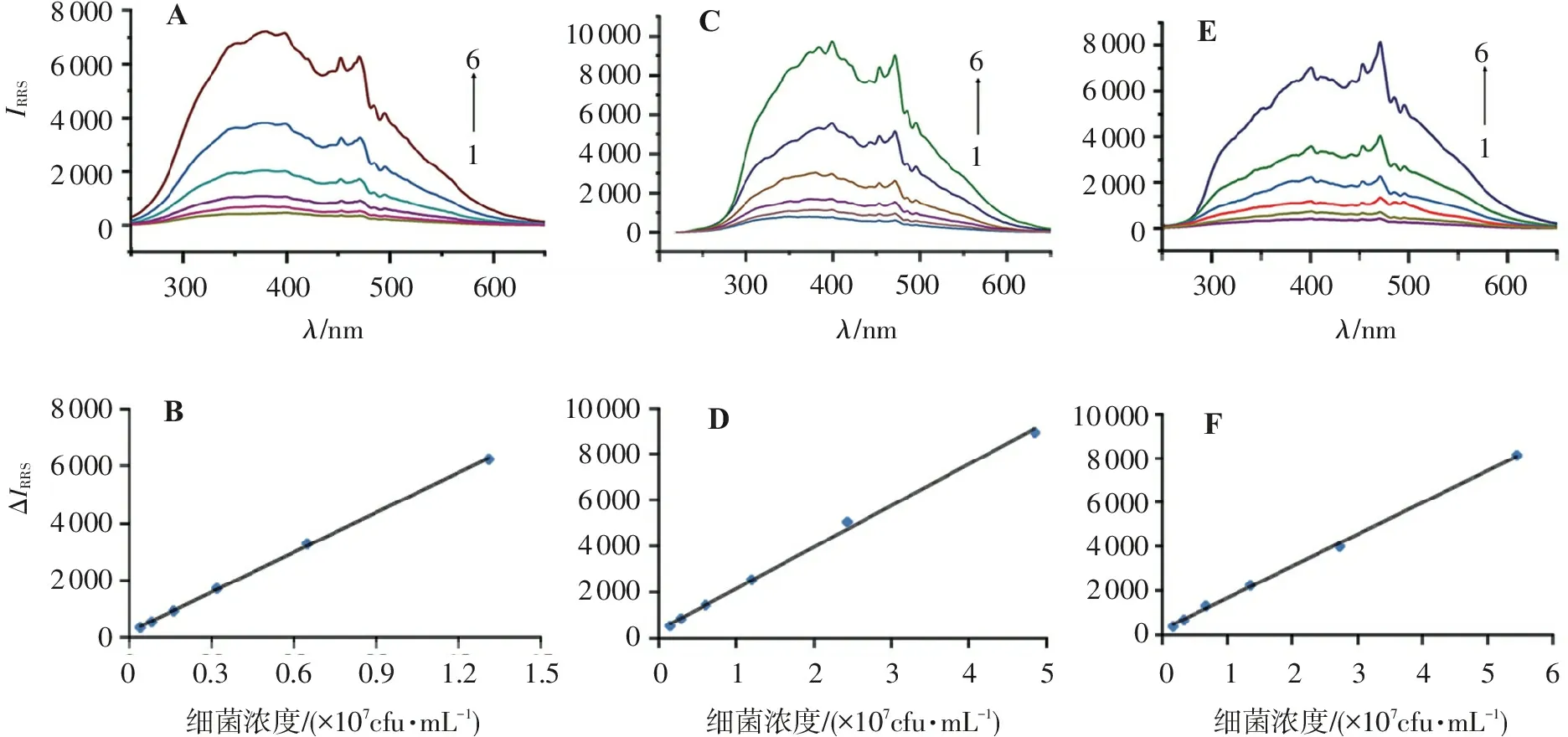
61616180006000400020000AB80006000400020000300400500600λ/nm0.30.60.91.21.50细菌浓度/(?107cfu?mL-1)10000800060004000200001000080006000400020000800060004000200001000080006000400020000D300400500600λ/nm300400500600λ/nm0123450123456CEFIRRSΔIRRS细菌浓度/(?107cfu?mL-1)细菌浓度/(?107cfu?mL-1)
A.不同浓度下副溶血性弧菌的RRS谱图(1~6分别为0.040×107,0.080×107,0.16×107,0.32×107,0.65×107,1.3×107cfu/mL); B.副溶血性弧菌的浓度与RRS谱图470 nm处强度的线性关系图; C.不同浓度下金黄色葡萄球菌的RRS谱图(1~6分别为0.17×108,0.34×108,0.68×108,1.4×108,2.7×108,5.5×108cfu/mL); D.金黄色葡萄球菌的浓度与RRS谱图470 nm处强度的线性关系图; E.不同浓度下沙门氏菌的RRS谱图(1~6分别为0.15×108,0.30×108,0.61×108,1.2×108,2.4×108,4.9×108cfu/mL); F.沙门氏菌的浓度与RRS谱图470 nm处强度的线性关系图。
图3不同浓度下3种细菌悬液的RRS图及线性关系图(470 nm)
Figure3RRS spectra of three kinds of bacterial suspension with different concentrations and the linear relationship (470 nm)

VibrioparahaemolyticusStaphylococcusaureusSalmonella3.52.82.11.40.70.0300400500600700800λ/nmA
图43种细菌悬液的紫外吸收光谱图
Figure4The absorption spectra of three kinds of bacterial suspension
3.3 平皿计数法、RRS法和分光光度法测定细菌悬液浓度的结果比较
为了验证方法的准确性,将RRS法和分光光度法(标准曲线法)应用于麦氏浊度为0.5的细菌悬液浓度的测定,并与平皿计数法进行比较,结果见表2。可见,以平皿计数法为参考,RRS法的相对误差为-6.3%~9.2%,分光光度法的相对误差为-6.7%~7.8%,2种方法的相对误差均在±10%以内,说明RRS法、分光光度法与平皿计数法结果的符合度较高。

表1 分光光度法测定3种细菌悬液的方法特性Table 1 The analytical performance of determination of three bacterial suspension by spectrophotometry

表2 3种方法测定3种细菌悬液浓度Table 2 Determination of three kinds of bacterial suspension with three different methods (n=3)
4 讨论
本文以副溶血性弧菌、金黄色葡萄球菌和沙门氏菌为例,建立了快速测定3种细菌悬液的RRS法和吸光光度法。RRS法测定细菌悬液表面携带的电荷且存在界面能带,在470 nm入射光激发下,一部分细菌菌体的界面分子吸收光子及发生能量转移而产生散射光,从而产生一定强度的RRS信号[9]。RRS信号随着细菌悬液浓度的增大而增强,在一定范围内两者间呈现线性相关性,因此可以通过测定特定波长(如470 nm)处细菌悬液的散射值确定其浓度。该方法检出限低,菌悬液在1×104cfu/mL以上即可检出;但RRS法的测定结果受测定时间的影响较大,需在30 min内测定完毕。在一定范围内,细菌悬液的浓度与吸光度值之间存在良好的线性关系,因此可以通过测定的吸光度值确定细菌悬液浓度,该方法操作简便、快速、稳定,但灵敏度较RRS法低。用分光光度法测定细菌悬液浓度时,菌落总数宜在105~108cfu/mL之间,否则会偏离朗伯—比尔定律,导致结果不准确。此外,细菌死亡可能导致浊度增加,从而引起吸光度增加[14],产生假阳性结果。为了排除该假阳性,在分析前可以先取一部分菌液进行美蓝(或刚果红、中性红等无毒染料)染色[15],分辨细菌是活菌还是死菌,再进行后续分析。
总之,RRS法和吸光光度法可用于细菌悬液的快速测定,为药品、食品等微生物实验技术人员提供便捷、普适性的检测技术,具有一定的实用性。

