阿帕替尼治疗25例晚期非小细胞肺癌的疗效、安全性和生存分析
冯宇,胡兴胜,刘雨桃,林琳,邢镨元,郝学志,王燕,李峻岭,石远凯
国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院内科,北京 100021
目前针对晚期无敏感基因突变的非小细胞肺癌(non-small cell lung cancer,NSCLC)患者,含铂两药联合化疗仍是一线标准治疗方案。存在表皮生长因子受体(epidermal growth factor receptor,EGFR)敏感基因突变的NSCLC患者,推荐EGFR-酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)作为一线治疗,一线治疗进展后,二线化疗的反应率较低(7%~9%),患者的中位无进展生存期(progression free survival,PFS)及总生存期(overall survival,OS)均较短(分别为2~3个月及5~8个月)[1-2]。若基因检测结果提示一线EGFR-TKI靶向治疗NSCLC进展后存在EGFRT790M耐药突变,二线应用奥希替尼的客观反应率为71%,中位PFS为10.1个月[3]。三线及三线以上尚无标准治疗方案,因此针对这部分晚期NSCLC患者,需要探索出可行有效的治疗方法。
肿瘤血管生成为增殖的肿瘤细胞提供氧气和营养物质,导致了恶性肿瘤的复发、增殖及转移[4]。基于这一理论,抗血管生成治疗理论上可以达到抗肿瘤的目的。在临床实践中,已经有很多临床研究证实了一线化疗联合抗血管生成药物能显著延长晚期NSCLC患者的PFS和OS,且耐受性良好,这些抗血管生成药物包括贝伐珠单抗、雷莫芦单抗、恩度等[5-7]。阿帕替尼是一种新型口服小分子抗血管生成药物,通过特异性抑制血管内皮细胞生长因子受体 2(vascular endothelial growth factor receptor 2,VEGFR2)的酪氨酸激酶活性,从而达到抑制肿瘤血管生成、生长及转移的效果,发挥抗肿瘤作用[8]。阿帕替尼最初在胃癌治疗中取得成效,因此2014年在中国批准上市用于治疗晚期胃癌,随后在乳腺癌、肺癌、肝癌等恶性肿瘤中亦发现了应用前景,但是尚未批准用于除胃癌以外的其他恶性肿瘤[9]。虽然目前关于阿帕替尼治疗晚期肺癌的临床研究极少,但在实际临床工作中,晚期肺癌患者在一线或多线治疗进展后应用阿帕替尼的例子并不罕见。本研究分析单药阿帕替尼用于二线及二线以上治疗晚期NSCLC患者的疗效及安全性,现报道如下。
1 资料与方法
1.1 一般资料
选择2016年3月至2018年2月于中国医学科学院肿瘤医院就诊的NSCLC患者。纳入标准:①年龄为18~80岁;②经病理学检查确诊为NSCLC;③临床分期为ⅢB~Ⅳ期且至少一线治疗后进展;④美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体能状态评分为0~2分;⑤至少有1个可测量的靶病灶;⑥一线或一线以上的化疗药物应用≥2个周期,治疗方案应用至疾病进展(progressive disease,PD);⑦若患者发生EGFR敏感突变,应用EGFR-TKI直至PD;⑧PD后单药应用阿帕替尼,且阿帕替尼服用时间≥2个月。本研究共纳入25例NSCLC患者,其中阿帕替尼作为二线治疗的患者8例(32.0%),阿帕替尼作为二线以上治疗的患者17例(68.0%)。18例患者治疗前有明确的基因检测结果,基因突变阴性者8例(44.4%),阳性者10例(55.6%),基因突变阳性者均为EGFR突变且均接受过EGFR-TKI治疗并且最终进展。
1.2 治疗方法
临床医师根据患者的身体状况选择阿帕替尼的初始剂量,并根据患者在阿帕替尼治疗期间的耐受程度调节用药剂量。阿帕替尼的每日用药剂量不低于250 mg且不高于750 mg。患者应用阿帕替尼直至PD或出现不可耐受的不良反应。
1.3 近期疗效评价
在阿帕替尼治疗开始之前应用计算机断层扫描(CT)、磁共振成像(MRI)、正电子发射断层显像(positron emission tomography,PET)-CT和(或)骨扫描评估肿瘤病灶并作为疗效评价的基线水平,开始阿帕替尼治疗后每隔1个月或2个月评价肿瘤病灶的变化情况。根据实体瘤疗效评价标准(response evaluation criteria in solid tumor,RECIST)1.1版[10]进行疗效评价,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和PD。客观缓解率(objective response rate,ORR)=(CR+PR)例数/总例数×100%,疾病控制率(disease control rate,DCR)=(CR+PR+SD)例数/总例数×100%。
1.4 不良反应评价
根据常见不良反应事件评价标准(common terminology criteria for adverse event,CTCAE)4.0版[11]对不良反应进行评价,分为1~4级。
1.5 随访
采用门诊、电话等方式对所有患者进行随访,随访截止时间为2018年4月。PFS定义为自患者治疗开始至明确为PD的时间。
1.6 统计学分析
采用SPSS 22.0软件对数据进行统计学分析。计数资料以例数和率(%)表示;采用Kaplan-Meier法绘制生存曲线,组间比较采用Log-rank检验;采用Cox回归模型分析影响患者预后的因素。以P<0.05为差异有统计学意义。
2 结果
2.1 疗效评价及生存情况
25例患者在应用阿帕替尼治疗期间均至少进行过1次影像学评估,所有患者疗效均可评价,无CR病例,PR 7例,SD 15例,PD 3例。单药阿帕替尼治疗后患者的ORR为28.0%(7/25),DCR为88.0%(22/25)。截至末次随访日期,25例患者的中位PFS为6.0个月(95%CI:4.8~7.2),其中4例患者的疾病尚未进展,这4例患者截至末次随访日期的PFS分别为9、11、12、22个月(图1)。
2.2 晚期NSCLC患者PFS 影响因素的分析
Log-rank检验结果显示,阿帕替尼作为二线和二线以上方案治疗晚期NSCLC患者的中位PFS存在边缘统计学差异(10.0个月vs5.0个月,P=0.050)(图2)。鉴于数据处于边缘状态,因此应用Cox回归模型进一步分析,结果显示,阿帕替尼治疗线数是晚期NSCLC患者PFS的独立影响因素(P<0.01)。Log-rank检验结果显示,不同性别、年龄、吸烟史、临床分期、病理类型、EGFR突变状态、高血压发生情况及ECOG评分的晚期NSCLC患者的中位PFS比较,差异均无统计学意义(P>0.05);Cox回归分析结果显示,性别、吸烟史、临床分期、病理类型是晚期NSCLC患者PFS的独立影响因素(P<0.05)(表1、表2)。
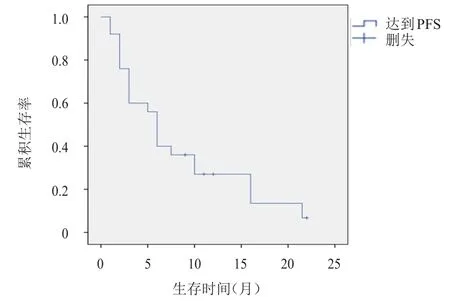
图1 25例晚期NSCLC 患者的无进展生存曲线
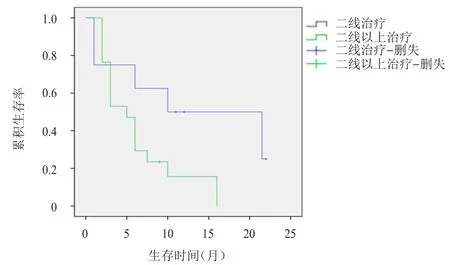
图2 阿帕替尼作为二线(n=8)及二线以上(n=17)方案治疗晚期NSCLC 患者的无进展生存曲线

表1 25例晚期NSCLC患者PFS影响因素的单因素分析
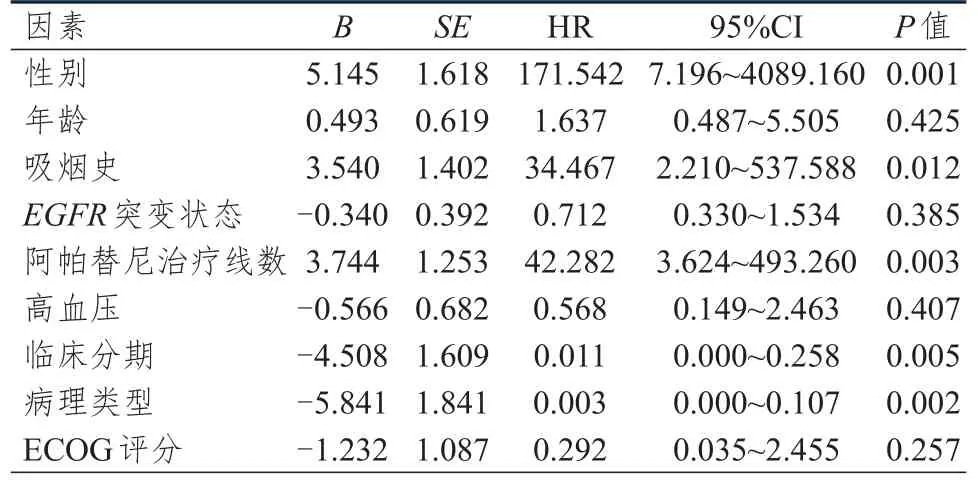
表2 25例晚期NSCLC患者PFS影响因素的多因素分析
2.3 剂量调整
25例患者中,11例患者调整了阿帕替尼的剂量,其中8例初始剂量为250 mg的患者进行了剂量上调,调至每日500~750 mg,剂量上调后未发生因剂量上调导致的不可耐受的不良反应;3例初始剂量为500 mg的患者因不可耐受的不良反应将剂量下调至250 mg,剂量下调的原因主要包括高血压、咽喉疼痛、手足皮肤反应、口腔黏膜炎。
2.4 不良反应发生情况
25例患者中,高血压、手足皮肤反应及腹泻的发生率均较高(>30.0%),发生高血压的患者甚至达到半数以上(52.0%),而乏力、口腔黏膜炎、呕吐及咽喉疼痛的发生率均较低(<20.0%)。25例患者中,8例(32.0%)患者发生了较严重的不良反应(3级),但未发现4级不良反应的发生,全部患者未发生因不良反应事件而中断治疗的情况,当出现较严重的不良反应时,通过下调阿帕替尼剂量以及对症治疗后均可耐受。(表3)
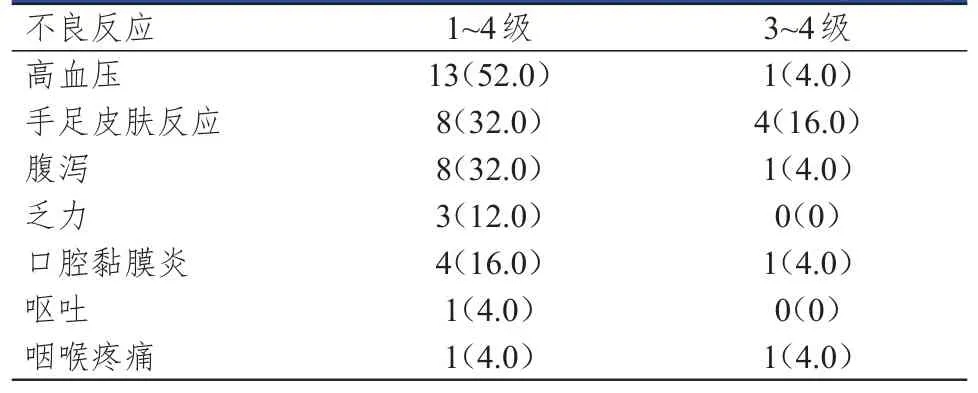
表3 25例晚期NSCLC患者的不良反应发生情况[n(%)]
3 讨论
血管内皮生长因子(vascular endothelial growth factor,VEGF)及血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)在多种肿瘤血管内皮及淋巴管中高度表达,为肿瘤治疗提供了新的靶点。陈秋生等[12]收集了NSCLC组织标本共50例,并随机选择20例NSCLC癌旁组织,通过免疫组织化学染色法观察VEGF的表达情况,并计算其阳性率,结果发现VEGF在肺鳞癌及肺腺癌组织中的阳性表达率分别为80.0%、91.6%,均高于癌旁组织的30.0%,且VEGF在肺腺癌、Ⅲ~Ⅳ期以及有淋巴结转移患者中的表达水平均高于肺鳞癌、Ⅰ~Ⅱ期以及无淋巴结转移的患者,差异均有统计学意义(P<0.05)。此结果一方面提示VEGF表达水平升高可增加NSCLC侵袭和转移的风险,另一方面则提示对于晚期NSCLC患者,无论是鳞状细胞癌还是非鳞状细胞癌,抗血管生成治疗理论上均可使患者获益,那么实际情况如何呢?
目前临床上批准的治疗肺癌的抗血管生成药物主要包括针对VEGF的单克隆抗体贝伐珠单抗和重组人血管内皮抑素恩度。在E4599研究中,非鳞状NSCLC患者一线应用紫杉醇+卡铂联合贝伐珠单抗(联合组)或紫杉醇+卡铂(单纯化疗组)治疗,结果显示,联合组患者的PFS和OS获益明显,联合组和单纯化疗组患者的中位PFS分别为6.4个月和 4.8 个月(HR=0.65,95%CI:0.54~0.78,P<0.001),中位OS分别为12.3个月和10.3个月(HR=0.80,95%CI:0.86~0.94,P=0.013),客观缓解率分别为27%和10%[13]。另一项Ⅲ期临床研究分析长春瑞滨+顺铂联合恩度(联合组)和长春瑞滨+顺铂(单纯化疗组)治疗NSCLC的疗效,结果显示,联合组患者的中位PFS明显高于单纯化疗组(6.3个月vs3.6个月,P<0.001)[7]。
阿帕替尼可高度选择性抑制VEGFR2的酪氨酸激酶活性,与VEGFR2结合后,阻断了VEGF与VEGFR2相结合引起的VEGFR2的自体磷酸化,从而抑制相关信号转导,达到抑制血管生成的目的[14]。Song等[15]研究回顾性分析了42例经一线或者二线治疗进展后的NSCLC患者应用单药阿帕替尼的疗效,结果发现,4例患者应用单药阿帕替尼后达到了PR,22例患者达到了SD,疾病反应率为9.5%,DCR为61.9%,中位PFS和OS分别为4.2个月和6.0个月,说明阿帕替尼用于一线或多线治疗进展后的晚期NSCLC患者仍有较好的疗效。
本研究通过分析25例NSCLC患者经一线或多线治疗进展后单用阿帕替尼治疗的疗效与安全性,结果发现,患者的中位PFS高达6.0个月,明显长于目前关于应用单药阿帕替尼的一些回顾性研究的结果(中位PFS分别为4.2个月[15]和3.0个月[16])。这也许得益于入选本研究的晚期NSCLC患者ECOG评分普遍较高[1例(4%)患者ECOG评分为2分,24(96%)患者ECOG评分为0~1分]。由于患者的体能状态评分过于集中,无法得出体能状态对生存预后的影响,未来可考虑纳入更多不同体能状态的NSCLC患者对该研究加以补充,分析体能状态评分的高低对阿帕替尼疗效的影响,以进一步指导临床治疗。
25例患者在应用阿帕替尼治疗期间均至少进行过1次影像学评估,所有患者疗效均可评价,其中无CR病例,PR 7例,SD 15例,PD 3例,ORR为28.0%,DCR为88.0%。另有研究显示,晚期NSCLC患者一线化疗进展后应用多西他赛后的ORR为8.8%,DCR为55.2%;应用培美曲塞后的ORR为9.1%,DCR为54.9%[2]。可见单药阿帕替尼用于一线或多线治疗进展后的NSCLC患者与化疗相比,疗效较好。
本研究的单因素分析结果表明阿帕替尼作为二线治疗可能较二线以上治疗具有延长晚期NSCLC患者中位PFS的趋势,鉴于数据处于边缘状态(P=0.050),因此应用Cox回归模型进一步对PFS进行分析,结果发现,阿帕替尼治疗线数是晚期NSCLC患者PFS的独立影响因素(P<0.01)。表明越早应用阿帕替尼,患者的PFS获益越大,但该结果与Wu等[17]的研究结果相悖(P=0.106),可能是由于其的研究将阿帕替尼用于晚期NSCLC五线治疗作为分界点进行比较,而本研究以阿帕替尼用于晚期NSCLC二线治疗作为分界点进行比较。未来可纳入更多此类研究或通过扩大样本量证明阿帕替尼应用的时间早晚对患者生存预后的影响。
本研究中阿帕替尼引起的不良反应主要包括高血压、口腔黏膜炎、手足皮肤反应、乏力、呕吐、咽喉疼痛以及腹泻,但多为轻中度,可以耐受,不可耐受者可通过下调剂量及应用对症辅助药物来控制症状。因此,阿帕替尼具有良好的安全性。
阿帕替尼是抗肿瘤血管生成药物,本研究分析阿帕替尼治疗NSCLC患者的临床疗效,发现不同个体间的疗效差异较大,这提示或许存在针对阿帕替尼的一些基因或分子标志物,若能找出最适合阿帕替尼的人群,对精准治疗意义重大。驱动家族成员5B-转染重排(kinesin family member 5B-rearranged during transfection,KIF5B-RET)融合基因是在NSCLC中新发现的致癌突变基因。Lin等[18]研究发现,在KIF5B-RET融合基因阳性的人肺癌A549细胞中,磷酸化的非受体酪氨酸激酶(phosphor-sarcoma,p-Src)及磷酸化的胞外信号调节激酶(phosphor-extracellular signal regulated kinase,p-ERK)表达显著上调,分别将ERK基因抑制剂PD98059和Src基因抑制剂达沙替尼(Dasatinib)应用于KIF5B-RET融合基因阳性的A549细胞,结果显示达沙替尼组显著抑制了A549细胞的迁移与侵袭,提示p-Src或许是KIF5B-RET融合基因调节肿瘤细胞迁移与侵袭的下游通路。在上述结论的前提下,将阿帕替尼应用于KIF5B-RET融合基因阳性的A549细胞,与空白对照组比较,阿帕替尼组通过抑制KIF5B-RET的磷酸化来抑制转染重排(rearranged during transfection,RET)融合基因的表达(同时伴有p-Src的抑制),从而发挥抗肿瘤作用。提示阿帕替尼或许对具有KIF5B-RET驱动基因的肿瘤疗效更好,未来可考虑纳入更多这方面的研究。
综上所述,阿帕替尼单药用于一线及多线治疗进展后的晚期NSCLC疗效确切且安全性较好,但本研究存在局限性,本研究为回顾性研究且样本量较小,随访时间较短,无法对单药阿帕替尼应用于晚期NSCLC做出完整而系统的评价,因此需要进一步延长随访时间。目前阿帕替尼在临床上仍然是经验性治疗,未来需要着重分析对阿帕替尼治疗反应较好的人群,找出人群的共性,更好地指导临床。
——评《卵巢恶性肿瘤诊疗手册》

