沉默HMGA2表达对人结肠癌HCT116细胞增殖及侵袭能力的影响△
徐广甍,张海娜,姜丹,张丽梅,丁相福
吉林大学第二医院1结直肠外科,2康复医学科,3甲状腺外科,长春 130022
结直肠癌是全世界范围内最常见的恶性肿瘤之一。尽管近年来治疗技术取得了巨大的进展,仍无法降低其发病率及病死率,发病人数及死亡人数呈增长趋势[1]。恶性肿瘤的发生、发展过程中,各种抑癌基因的突变及致癌基因的激活,是其重要的启动及促进因素,并贯穿肿瘤进展的全程。致癌基因在正常组织中呈低表达或不表达,在肿瘤组织中则呈过表达,在恶性肿瘤发生发展过程中具有重要的促进作用。如能寻找出对肿瘤起重要调控作用的致癌基因,并对其表达进行有效调控,将有效抑制肿瘤的进展。所以,寻找并验证在肿瘤进展过程中起重要调控作用的分子标志物,为恶性肿瘤发现新的诊断标志物及治疗靶点,是目前肿瘤分子生物学研究的热点。
高迁移率族蛋白A2(high mobility group AT-hook 2,HMGA2)蛋白属于结构转录因子,其本身不具有转录调节的能力,但是可以通过其自身特有的AT钩结构与被调节基因DNA上的AT富集区域相结合,或直接参与某些转录因子的作用,通过改变这些转录因子的DNA构象,增强或抑制其转录活性。大量的研究显示HMGA2对胚胎发育、细胞增殖、糖尿病、肥胖症、身高调节等生理过程具有重要作用,也与肿瘤的发生发展关系密切[2-8]。最近的研究证据显示HMGA2蛋白在一系列上皮来源恶性肿瘤中均存在表达上调,随其表达程度的升高,明显影响恶性肿瘤患者的临床特征及预后。进一步的肿瘤分子生物学研究显示,HMGA2在肿瘤的进展过程,如细胞增殖及周期调整、上皮-间充质转化、维持肿瘤干细胞功能等一系列事件中,均显示出调控作用,在多种肿瘤进程中扮演了重要角色,可能成为新的特异性诊断标志物及抗肿瘤药物治疗靶点[9-19]。研究显示,结肠癌组织中存在HMGA2的过表达,并且与患者临床特征及预后相关,因此认为HMGA2是一个潜在的重要的结肠癌肿瘤标志物[20-21]。但是,关于其具体机制仍需进一步研究确认。
为鉴定HMGA2基因对结肠癌细胞生物学特性的影响,本研究成功构建针对HMGA2基因的干扰表达载体,并将其转染HCT116细胞后构建稳定转染细胞株。通过沉默结肠癌HCT116细胞中HMGA2的表达,在细胞水平检测其对HCT116细胞增殖及侵袭能力的影响,为进一步明确HMGA2功能并为其机制研究提供理论依据,现报道如下。
1 材料与方法
1.1 细胞与材料
人结肠癌细胞系HCT116购自中国医学科学院上海细胞库。HMGA2抗体购自美国Abcam公司,Matrigel胶购自美国Sigma公司,Transwell小室购自美国Corning公司,标准蛋白、电化学发光(electrochemiluminescence,ECL)反应检测试剂盒、Cell Counting Kit-8试剂盒均购自上海碧云天生物技术有限公司,胎牛血清(fetal bovine serum,FBS)、DMEM培养基均购自美国Gibco公司,Lipofectamine 2000转染试剂购自美国Invitrogen公司。
1.2 细胞培养
HCT116细胞贴壁生长于含10%FBS、青霉素(100 μg/ml)、链霉素(100 μg/ml)的 DMEM 培养基中,在37℃、5%CO2及饱和湿度的培养箱中进行传代培养。
1.3 HMGA2短发夹RNA(short hairpin RNA,shRNA)表达载体的构建
根据前期试验筛选验证出有效的小干扰RNA(small interfering RNA,siRNA)干扰序列:正义链序列,5'-GAAATGGCCACAACAAGTTGT-3';反义链序列,5'-ACAACTTGTTGTGGCCATTTC-3'。设计出1对编码HMGA2shRNA序列的互补单链DNA寡核苷酸序列,合成并构建pGP-U6/GFP/Neo/HMGA2RNAi重组质粒(上海吉玛生物技术有限公司)。阳性重组质粒经测序鉴定与构建序列相符,阴性对照质粒由上海吉玛生物科技有限公司提供,经blast验证与HMGA2基因序列无同源性。
1.4 重组质粒转染及稳定转染细胞株的筛选
取处于对数生长期的HCT116细胞,消化、收集后接种于6孔板中,每孔各接种1×105个细胞,置于37℃、5%CO2及饱和湿度培养箱中培养。24 h后,应用Lipofectamine 2000转染试剂进行重组质粒及阴性质粒转染。转染48 h后,应用荧光显微镜观察确认转染效率后,添加含G418(400 μg/ml)的DMEM培养基进行筛选阳性克隆并扩增传代,构建稳定转染细胞株。按实验需要,将未转染细胞、转染阴性对照质粒细胞及转染HMGA2shRNA质粒细胞分别命名为CON组、NC组、KD组。
1.5 反转录聚合酶链反应及蛋白质印迹法检测HMGA2mRNA 及蛋白表达水平
分别提取各组细胞总RNA,进行反转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)。先合成cDNA,再进行聚合酶链反应(polymerase chain reaction,PCR),扩增产物行琼脂糖凝胶电泳进行检测。HMGA2引物序列:上游引物 ,5'-AAGTTGTTCAGAAGAAGCCTGCTCA-3';下游引物,5'-TGGAAAGACCATGGCAATACAGAAT-3';长度174 bp。GAPDH引物序列:上游引物,5'-GCACCGTCAAGGCTGAGAAC-3';下游引物,5'-TGGTGAAGACGCCAGTGGA-3';长度 138 bp。应用凝胶成像分析系统分析结果,HMGA2mRNA相对表达水平以HMGA2条带灰度值与同组GAPDH条带灰度值的比值表示。
分别提取各组细胞的总蛋白,采用标准曲线法对蛋白浓度进行测定,并行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),转膜后以5%脱脂牛奶室温下封闭l h,加入一抗(HMGA2抗体1∶200稀释,GAPDH抗体1∶2000稀释)在4℃条件下过夜。弃一抗,硝酸纤维素膜以l×Tris缓冲生理盐水(tris buffered saline,TBS)(高盐)清洗 3次,每次10 min;再加入二抗(1∶1000稀释),室温条件下作用2 h。弃二抗后,NC膜以l×TBS清洗3次,每次10 min;按照ECL说明书进行曝光处理。应用Quantity One软件进行灰度分析处理,HMGA2蛋白相对表达量以HMGA2灰度值与同组GAPDH灰度值的比值表示。
1.6 CCK-8法检测细胞增殖能力
分别消化、收集各组细胞,离心5min(1000r/min),制备单细胞悬液,细胞密度调至1×104/ml。各组分别取100 μl加至96孔板中,设定实验分组并标记,每组设6个平行孔。培养板置于培养箱(37℃、5%CO2、饱和湿度),24、48、72、96、120 h后分别取出,向各待测孔中加入10 μl CCK-8溶液,置于37℃下孵育1 h,以酶标仪进行490 nm处吸光度值测定。
1.7 平板克隆形成实验检测细胞增殖能力
分别消化、收集各组细胞并制备单细胞悬液,计数并判定细胞活力,各取1000个细胞加入到含有37℃预温培养液的6孔板中,使细胞分散均匀,设3个平行复孔。培养板置于培养箱(37℃、5%CO2、饱和湿度)中培养,14天后取出。各组细胞磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗2次,多聚甲醛溶液固定15 min;弃除固定液后再应用PBS溶液冲洗2次,适量Giemsa染液染色10 min,自来水缓慢冲洗后,室温下干燥。在显微镜下分别对各组细胞中包含细胞数大于50的克隆计数。
1.8 侵袭实验检测细胞体外侵袭能力
以稀释Matrigel胶均匀包被上室膜上表面,制备Transwell小室模型备用。消化、收集各组细胞并制备单细胞悬液,计数并调整细胞密度至2.5×106/ml。下室加入 500 μl含 20%FBS 培养液,上室加入200 μl单细胞悬液,将上室嵌入到下室,各组均设3个复孔。处理后的小室装置置于培养箱(37℃、5%CO2、饱和湿度)中培养24 h后,取出固定染色。在倒置显微镜低倍镜视野下,对各滤膜随机选取3个视野,对穿膜细胞计数,计算每个滤膜的平均细胞数。
1.9 统计学分析
采用SPSS 13.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,两组比较采用两独立样本t检验,多组比较采用方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 HMGA2mRNA 及蛋白相对表达量的比较
KD组细胞HMGA2mRNA及蛋白相对表达量均低于CON组及NC组细胞,差异均有统计学意义(P<0.05)。结果显示通过siRNA可稳定沉默HMGA2表达,可进行后续细胞学相关研究。(表1)
表1 3组细胞HMGA2 mRNA及蛋白相对表达量的比较(±s)

表1 3组细胞HMGA2 mRNA及蛋白相对表达量的比较(±s)
注:*与KD组比较,P<0.05
组别CON组NC组KD组F值P值HMGA2 mRNA 0.95±0.11*1.01±0.13*0.35±0.11 29.17<0.01 HMGA2蛋白0.97±0.11*1.03±0.15*0.21±0.13 36.51<0.01
2.2 CCK-8法检测细胞增殖能力结果
通过CCK-8法检测各组细胞的增殖能力,结果显示,与CON组及NC组相比,KD组细胞增殖能力受到抑制,不同时间点KD组细胞吸光度值均低于CON组及NC组细胞,差异均有统计学意义(P<0.05)。(表2)
表2 不同时间点各组细胞吸光度值的比较(±s)

表2 不同时间点各组细胞吸光度值的比较(±s)
注:*与KD组比较,P<0.05
组别CON组NC组KD组F值P值24 h 0.23±0.02*0.18±0.01*0.17±0.01 15.19<0.01 48 h 0.26±0.02*0.23±0.02*0.18±0.02 14.35<0.01 72 h 0.32±0.03*0.22±0.02*0.21±0.01 18.57<0.01 96 h 0.43±0.03*0.38±0.02*0.23±0.02 62.86<0.01 120 h 0.53±0.04*0.49±0.03*0.26±0.02 62.85<0.01
2.3 平板克隆形成实验检测结果
对各组细胞的有效克隆(包含细胞数目大于50)分别计数,CON组及NC组细胞克隆数分别为(243.2±27.6)、(208.9±37.1)个,均多于 KD 组的(139.0±15.6)个,差异均有统计学意义(t=5.69、3.01,P<0.05);CON组与NC组比较,差异无统计学意义(t=1.29,P>0.05)。(图1)
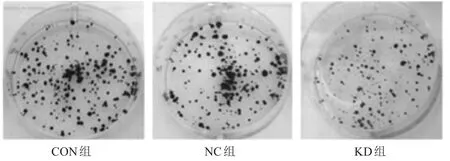
图1 CON组、NC组、KD 组细胞平板克隆形成实验结果
2.4 侵袭实验检测细胞侵袭能力结果
通过显微镜对各组细胞穿膜情况进行检测,CON组及NC组穿膜细胞数分别为(143.18±19.87)、(126.64±26.10)个,均多于 KD 组细胞的(69.53±7.24)个,差异均有统计学意义(t=6.03、3.65,P<0.05);CON组与NC组比较,差异无统计学意义(t=0.87,P>0.05)。(图2)

图2 CON组、NC组、KD 组细胞侵袭实验检测结果(Gimesa染色,×100)
3 讨论
HMGA2属于结构转录因子家族成员,自身并不具备转录活性调节功能,但可通过其自身的特有结构改变所作用基因的转录活性,而作用基因如为参与肿瘤信号通路关键基因,HMGA2的作用可对肿瘤的发生及发展起到巨大作用[2-8]。以往研究显示,HMGA2作为致癌基因,对恶性肿瘤细胞的增殖、侵袭等生物学行为均具有重要调控作用,对恶性肿瘤的发生、发展具有重要影响[12,16-17,19-22]。但在结直肠癌的以往研究中,HMGA2对肿瘤生物学行为的影响,包括对肿瘤增殖及侵袭能力的具体调控,仍缺乏全面系统的研究。本研究成功构建了HMGA2shRNA重组质粒表达载体,转染人结肠癌HCT116细胞,构建稳定转染细胞株,成功沉默了HMGA2的表达,通过一系列体外细胞实验,系统地对HMGA2在结肠癌细胞的肿瘤生物学行为进行研究,进一步明确HMGA2在结肠癌细胞增殖及侵袭过程中所起的作用。
为研究HMGA2对结肠癌细胞增殖能力的影响,本研究分别采用两种实验方法对HMGA2干扰前后细胞增殖的变化进行检测。CCK-8法检测结果显示,沉默HMGA2表达后结肠癌细胞的增殖能力明显受到抑制。平板克隆形成实验主要用于对细胞增殖能力的检测,接种后的肿瘤细胞并不能均形成有效克隆,但形成有效克隆的细胞均具有较强的增殖能力,间接反映出肿瘤的增殖能力强弱。本实验结果显示沉默HMGA2表达后,KD组细胞不论在有效克隆的尺寸上,还是在有效克隆数量上,均小于CON组及NC组,显示其增殖能力减弱。两种实验结果均提示沉默HMGA2表达明显抑制了HCT116细胞的增殖能力。
侵袭能力是评价恶性肿瘤生物学行为强弱的重要指标。侵袭能力的强弱决定了肿瘤突破原发部位向外周组织浸润并播散及转移的能力,涉及复杂的生物学机制。目前主要通过构建Transwell小室模型评价肿瘤侵袭能力的强弱,其原理为恶性肿瘤细胞突破原发部位向外周侵袭过程中,需要先突破细胞的外基质膜,而Transwell小室模型通过包被基质胶,体外模拟了该过程。通过该实验可以看出沉默HMGA2基因表达后,穿透基质胶的穿膜细胞数减少,而CON组与NC组相比,透膜细胞数并未显示出差异。通过对结果进行比较,提示沉默HMGA2表达可显著抑制HCT116细胞的侵袭能力。
本研究通过体外实验,对HMGA2在结肠癌细胞中的恶性生物学行为,包括增殖及侵袭能力进行了系统的研究。实验结果提示HMGA2表达在结肠癌发生、发展过程中,对细胞增殖、侵袭能力起到明显的促进作用。这些实验结果为深入研究HMGA2对结肠癌的调控机制提供了理论基础,同时也提示HMGA2可能作为结肠癌治疗干预的靶点,值得进一步深入研究。

