沙地生境下苜蓿生理生化特性对低温的响应及与抗寒性的关系
朱爱民,张玉霞,王显国,刘庭玉,丛百明,王 鑫,候文慧
(1. 内蒙古民族大学农学院,内蒙古 通辽 028041;2. 内蒙古农业大学草原与资源环境学院,内蒙古 呼和浩特 010010;3. 中国农业大学动物科技学院, 北京 100083)
紫花苜蓿(Medicago sativa)是一种品质高、抗性强的多年生豆科牧草[1],在我国畜牧业产业中占据重要地位[2-3]。近年来随着我国农业产业结构的调整及畜牧业的快速发展,各省份紫花苜蓿的种植面积也在不断扩大,内蒙古自治区提出到2020年结合其他种类饲草发展65万hm2[4]饲草地。科尔沁沙地冬季气温低、降雪少,紫花苜蓿普遍存在着越冬率低的问题[5-6]。研究表明,阿鲁科尔沁旗除2013年因上年积雪大苜蓿越冬较好外,其他年份均有不同程度的越冬问题[7-8],2014和2016年苜蓿越冬不足50%,给苜蓿种植企业及个人带来重大经济损失,因此,研究紫花苜蓿越冬期的抗寒机理非常重要。
杀霜日(the frost killing period)是指气温首次降至-2 ℃的日期[9-10],朱爱民等[11-12]研究表明杀霜日前后刈割与未刈割苜蓿根颈中渗透调节物质变化差异显著。为适应逐渐降低的温度变化,苜蓿根系会发生复杂的生理生化变化以抵御寒冷胁迫。简令成[13]和Smith[14]研究表明,低温胁迫会提高植物体内的可溶性糖含量。Delauney和Verma[15]研究表明植物体内游离脯氨酸含量是一种重要的渗透调节物质,植物组织细胞内游离脯氨酸含量对维持原生质与环境的渗透平衡具有重要作用。杜永吉等[16]研究表明可溶性蛋白含量与苜蓿抗寒性呈显著正相关关系。南丽丽等[17]研究结果表明,苜蓿根颈中可溶性蛋白质、脯氨酸、可溶性糖均随着温度降低而增加,随着温度的升高而减少的趋势变化。
国内外有关苜蓿抗寒性与根颈抗氧化酶活性方面的研究资料[18-19]很多,研究表明紫花苜蓿抗寒能力大小一定程度上与其越冬期根系中相关保护酶活性有关[20-21]。植物受到低温胁迫时,细胞内的活性氧分子会大量积累,当积累量达到一定量时,膜脂出现过氧化或脱脂化反应,此外会引起磷脂游离和细胞膜的结构破坏等症状,从而使细胞功能丧失。在此过程中超氧化物歧化酶(SOD)和过氧化物酶(POD)等同工酶能起到一定的抑制过氧化的作用[22-23],可以减轻活性氧分子对细胞的损害,但当低温胁迫超过一定范围时,各种同工酶的活性会显著降低,难以达到抑制作用[24]。冯昌军等[25]和邓雪柯等[26]研究表明,当苜蓿受到低温胁迫时植株体内SOD酶活性会明显提高以消除细胞内产生的自由基的伤害。陶雅等[27]通过对3个紫花苜蓿品种根部丙二醛(MDA)含量动态变化进行分析,结果表明温度下降初期各苜蓿品种根部积累大量的MDA,而后MDA含量降低,随着温度的升高,MDA含量又开始逐渐升高。
电导法是判断植物抗逆性强弱最常用的方法之一。曹红星等[28]研究表明,相对电导率与胁迫温度呈负相关关系,并由此鉴定不同品种植物的抗寒性及致死温度。关于电导法在判断植物抗寒性上应用的报道很多,如小麦(Triticum aestivum)、玉米 (Zea mays)、花菜 ( Brassica oleracea)、黄瓜(Cucumis sativus)、苹果 (Malus)以及茶 (Camellia sinensis)等其他植物[29]。窦玉梅等[30]研究表明,抗寒性弱的苜蓿品种的细胞膜透性大,而抗寒性强的苜蓿品种细胞膜透性小。近年来在阿鲁科尔沁旗种植的苜蓿品种多数为进口苜蓿品种,其种子用量大、价格昂贵,抗寒能力较差,因此选育高抗寒的国产苜蓿品种至关重要。本研究中8个苜蓿品种均是国产苜蓿品种,具有较高的研究和利用价值。本研究通过对杀霜日前后苜蓿根颈中生理生化指标的测定,并采用电导法配合Logistic回归方程计算苜蓿半致死温度,分析苜蓿根系生理生化指标与半致死温度的相关关系,筛选抗寒指标,探究苜蓿抗寒的生理生化机制,为沙地苜蓿选育高抗寒性品种提供理论基础。
1 材料与方法
1.1 试验区自然概况
试验地在内蒙古自治区赤峰市阿鲁科尔沁旗草源合作社公司,地理位置为 116°21′ - 120°58′ E,41°17′ - 45°24′ N,温带半干旱大陆性气候。年平均气温 0~6 ℃,≥ 10 ℃ 年积温 3 000~3 200 ℃·d,无霜期140~150 d,年平均降水量350~400 mm,蒸发量约为降水量的5倍,年平均风速3~4.4 m·s-1。
1.2 供试材料
供试材料见表1所列。
1.3 试验方法
1.3.1 大田试验设计
大田小区布局及管理:采用随机区组设计,每个苜蓿品种重复种植3个小区,8个品种共设置24个小区,小区试验面积20 m2(5 m × 4 m),每个小区之间设有50 cm过道。2016年8月4日以播种量为 22.5 kg·hm-2播种,试验田正常管理。于2016年杀霜日前(10月1日)和杀霜日后(10月15日)挖取长势一致的苜蓿根系,测定根颈中相关生理生化指标,并取植株顶部(上部)叶片和基部(下部)叶片测定叶绿素和类胡萝卜素含量。
1.3.2 低温处理试验设计
实验室低温处理:11月20号取样,每小区取长势一致的苜蓿越冬器官(根系)若干[29],低温处理目标温度分别为-10、-15、-20、-25、-30和-35 ℃,处理时间为6 h。试验步骤参照朱爱民等[29]苜蓿低温处理试验。
1.4 生理生化指标及根颈电导率测定
游离氨基酸含量采用茚三酮染色法测定[31-33];游离脯氨酸含量使用茚三酮法测定;可溶性蛋白含量采用考马斯亮蓝法测定;可溶性糖含量和淀粉含量采用蒽酮比色法测定;丙二醛含量采用硫代巴比妥酸法测定;超氧化物歧化酶活性采用氮蓝四唑法测定;过氧化氢酶活性采用紫外吸收法测定;过氧化物酶活性采用愈创木酚法测定;叶片叶绿素和类胡萝卜素含量采用80%丙酮浸提法测定。
相对电导率测定参照邹琦等[32]的方法。将各低温胁迫下的相对电导率值拟合Logistic方程[34-35],并计算半致死温度(LT50)。

表1 紫花苜蓿品种及来源Table 1 Alfalfa varieties and sources
1.5 数据分析
使用Microsoft Excel软件对试验数据进行处理,并做图和制作表格。采用SPSS17.0软拟合Logistic方程,并进行方差显著性及相关性分析。
2 结果
2.1 沙地苜蓿低温锻炼期叶片中叶绿素及类胡萝卜素含量变化
2.1.1 沙地苜蓿低温锻炼期上部叶片中叶绿素及类胡萝卜素含量变化
10月1日测定8个沙地苜蓿品种上部叶片中叶绿素a和叶绿素b含量均低于10月15日测定的苜蓿上部叶片中叶绿素a和叶绿素b含量,其中农菁1号苜蓿上部叶片中叶绿素a和叶绿素b含量增加幅度最大,分别增加0.65和0.29 mg·g-1(表2)。
10月1日测定表明,农菁8号苜蓿上部叶片中叶绿素a含量最高,达到0.75 mg·g-1,显著高于其他苜蓿品种(P < 0.05),农菁1号苜蓿上部叶片中叶绿素a含量显著低于其他苜蓿品种(P < 0.05);苜蓿上部叶片中叶绿素b含量和叶绿素最高的均是农菁8号品种。农菁8号和草原3号苜蓿上部叶片中类胡萝卜素含量较高,分别为0.31和0.28 mg·g-1(表2)。

表2 苜蓿上部叶片中叶绿素和类胡萝卜素含量变化Table 2 Changes of chlorophyll and carotenoid content in the upper leaves of alfalfa mg·g-1
10月15日测定表明,苜蓿上部叶片中叶绿素a含量较高的品种是农菁8号、农菁1号、公农1号和草原3号,叶绿素b含量较高的品种是农菁8号、农菁1号和农菁8号;草原2号苜蓿上部叶片中叶绿素含量最低。苜蓿上部叶片中类胡萝卜素含量最低的是东苜1号品种,为0.21 mg·g-1,但与其他品种相比无差异显著性(P > 0.05)(表2)。
2.1.2 沙地苜蓿低温锻炼期下部叶片中叶绿素及类胡萝卜素含量变化
10月15日测定沙地苜蓿下部叶片中叶绿素a含量和叶绿素b含量均高于10月1日测定的叶绿素a和叶绿素b含量,其中龙牧801苜蓿下部叶片中叶绿素a和叶绿素b含量增加最多,分别增加0.48和0.29 mg·g-1。10月1日测定沙地苜蓿下部叶片中类胡萝卜素含量较10月15日测定高(表3)。
10月1日测定农菁8号苜蓿下部叶片中叶绿素a含量最高,达到0.73 mg·g-1,显著高于其他苜蓿下部叶片中叶绿素a含量(P < 0.05),农菁1号苜蓿下部叶片中叶绿素a含量最低,为0.40 mg·g-1。10月15号测定龙牧801苜蓿下部叶片中叶绿素a含量最高,达到1.02 mg·g-1,叶绿素b含量较高的是龙牧801和农菁8号苜蓿。10月15日测定苜蓿下部叶片中叶绿素含量较低的品种是草原2号和草原3号,显著低于其他苜蓿品种(P < 0.05)。苜蓿下部叶片中类胡萝卜素含量最高的是龙牧801,为0.24 mg·g-1,东苜1号、草原2号和农菁1号苜蓿下部叶片中类胡萝卜素含量较低(表3)。
2.2 沙地苜蓿低温锻炼期根颈渗透调节物质变化
2.2.1 沙地苜蓿低温锻炼期根颈中可溶性糖含量的变化
如图1所示,10月1日测定8个苜蓿品种根颈中可溶性糖含量均显著高于10月15日测定苜蓿根颈中可溶性糖含量(P < 0.05),说明此时间段苜蓿根颈中可溶性糖含量降低,其中东苜1号和公农1号苜蓿根颈中可溶性糖含量降低量较大,分别降低 91.99 和 82.88 mg·g-1。

图1 苜蓿根颈中可溶性糖含量变化Figure 1 Change of soluble sugar content in root neck of alfalfa
不同时期测定8个苜蓿品种根颈中可溶性糖含量不同。公农1号、东苜1号和草原2号根颈中可溶性糖含量在10月1日测定较高,分别为185.24、180.75和 180.00 mg·g-1。10月 15日测定草原 2号和公农1号苜蓿根颈中可溶性糖含量较高。
2.2.2 沙地苜蓿低温锻炼期根颈中淀粉含量的变化
如图2所示,除肇东、东苜1号和农菁8号外,10月1日测定其他苜蓿品种根颈中淀粉含量均显著高于10月15日测定的淀粉含量(P < 0.05),其中增加幅度较大的品种是龙牧801和草原2号,分别增加24.14 和19.59 mg·g-1。10月1日测定仅肇东苜蓿根颈中淀粉含量较10月15日测定的淀粉含量少,但差异未达到显著水平(P > 0.05)。

图2 苜蓿根颈中淀粉含量变化Figure 2 Change of starch content in root neck of alfalfa
8个苜蓿品种间根颈中淀粉含量不同。10月1日测定苜蓿根颈中淀粉含量较高的是草原2号和龙牧801品种,分别为86.49和76.22 mg·g-1,肇东苜蓿根颈中淀粉含量最低,为57.24 mg·g-1。10月15日测定农菁8号、肇东和农菁1号苜蓿根颈中淀粉含量较高,分别为67.14、59.07和55.42 mg·g-1,根颈中含量最低的是草原3号苜蓿,为44.07 mg·g-1。
2.2.3 沙地苜蓿低温锻炼期根颈中游离氨基酸含量的变化
根据图3可知,沙地苜蓿低温锻炼期根颈中游离氨基酸含量变化趋势不同。10月1日测定龙牧801、肇东、草原3号、公农1号和农菁8号苜蓿品种根颈中游离氨基酸含量高于10月15日测定的根颈中游离氨基酸含量,但仅公农1号达到差异显著水平(P < 0.05)。10月1日测定草原2号和农菁1号苜蓿根颈中游离氨基酸含量显著低于10月15日测定的根颈中游离氨基酸含量(P < 0.05)。

图3 苜蓿根颈中游离氨基酸含量变化Figure 3 Change of free amino acid content in root neck of alfalfa
不同时期测定8个苜蓿品种根颈中游离氨基酸含量不同,肇东和公农1号苜蓿根颈中游离氨基酸含量10月1日测定较高,分别为2.03和2.02 mg·g-1。10月15日测定草原2号苜蓿根颈中游离氨基酸含量最高,较根颈中游离氨基酸含量最低的农菁1号苜蓿高 0.24 mg·g-1。
2.2.4 沙地苜蓿低温锻炼期根颈中可溶性蛋白含量的变化
根据图4可知,10月1日测定龙牧801、东苜1号、公农1号、农菁1号和农菁8号苜蓿根颈中可溶性蛋白含量显著高于10月15日测定的可溶性蛋白含量(P < 0.05)。10月1日测定苜蓿根颈中可溶性蛋白含量较高的品种是公农1号、农菁8号和农菁1号苜蓿。10月15日测定苜蓿根颈中可溶性蛋白含量最高的是农菁8号苜蓿,达到17.23 mg·g-1,较含量最低的东苜1号苜蓿高3.16 mg·g-1。
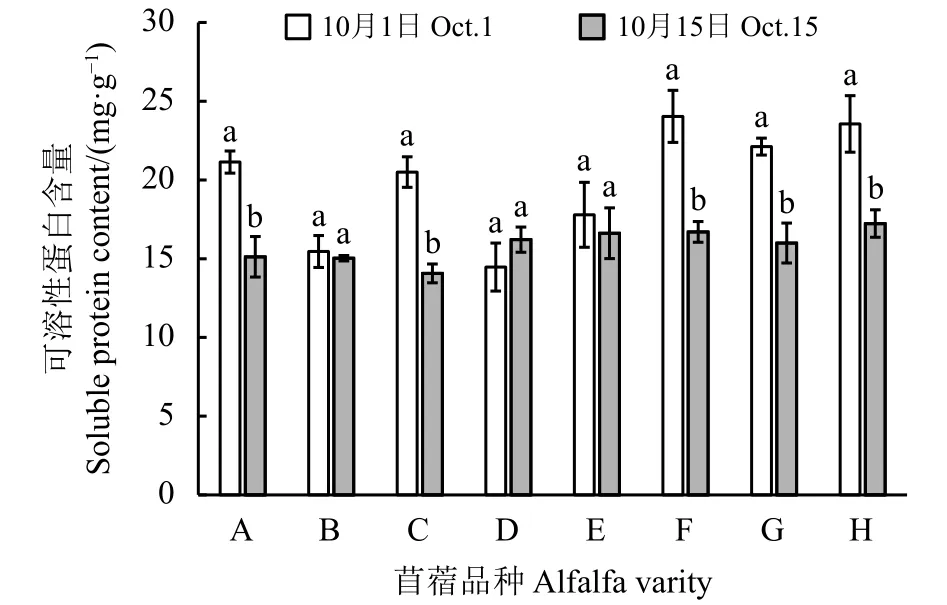
图4 苜蓿根颈中可溶性蛋白含量变化Figure 4 Change of soluble protein content in root neck of alfalfa
2.2.5 沙地苜蓿低温锻炼期根颈中C/N变化
根据图5可知,除农菁8号外,10月1日测定其他苜蓿品种根颈中C/N均高于10月15日测定的C/N,其中龙牧801、肇东、东苜1号、草原2号、草原3号和公农1号苜蓿两次测定根颈中C/N达到差异显著水平 (P < 0.05)。
不同时期测定8个苜蓿品种根颈中C/N变化不同。草原2号和东苜1号苜蓿10月1日测定根颈中C/N相对较大,分别达12.00和11.13,C/N相对较低的苜蓿品种是农菁1号和农菁8号,分别是7.91和7.37。10月15日测定东苜1号苜蓿根颈中C/N最高,为9.53,较最低的草原3号苜蓿高3.03。

图5 苜蓿根颈中C/N变化Figure 5 C/N changes in the root and neck of alfalfa
2.2.6 不同时期测定苜蓿根颈中游离脯氨酸含量的变化
如图6所示,两次测定苜蓿根颈中游离脯氨酸含量变化无明显规律,10月1日测定龙牧801、肇东、草原2号、公农1号、农菁1号和农菁8号苜蓿根颈中游离氨基酸含量低于10月15日测定的根颈中游离氨基酸含量,但仅肇东苜蓿根颈中游离脯氨酸含量两次测定达到差异显著水平(P < 0.05)。10月1日测定草原3号苜蓿根颈中游离脯氨酸含量显著高于10月15日测定的根颈中游离脯氨酸含量 (P < 0.05)。

图6 苜蓿根颈中游离脯氨酸含量变化Figure 6 Change of free proline content in root neck of alfalfa
不同时期测定8个苜蓿品种根颈中游离脯氨酸含量变化不同。东苜1号苜蓿10月1日测定根颈中游离脯氨酸含量最高,为118.5 μg·g-1,较根颈中游离脯氨酸含量最低的草原2号高44.2 μg·g-1。10月15测定苜蓿根颈中游离脯氨酸含量较高的苜蓿品种是肇东、东苜1号和龙牧801品种,游离脯氨酸含量较低的是草原2号和草原3号品种。
2.3 不同苜蓿品种低温锻炼期根颈抗氧化酶活性变化
2.3.1 沙地苜蓿低温锻炼期根颈中SOD活性的变化
如图7所示,10月15日测定8个苜蓿品种根颈中SOD活性明显高于10月1日测定的SOD活性,除农菁8号外,其他苜蓿品种两次测定根颈中SOD活性差异均达到显著水平(P < 0.05),其中肇东苜蓿10月1日测定苜蓿根颈中SOD活性较10月15日测定的SOD活性增加量最大,增加299.4 U·g-1。

图7 苜蓿根颈中SOD活性变化Figure 7 Change of SOD activity in root neck of alfalfa
10月1日测定苜蓿根颈中SOD活性最高的是龙牧801品种,达到517.2 U·g-1,肇东苜蓿根颈中SOD活性最低,为287.8 U·g-1。10月15日测定不同苜蓿品种间根颈中SOD活性差异较小,其中苜蓿根颈中SOD活性最大的农菁1号品种较根颈中SOD活性最低的农菁8号品种高49.7 U·g-1。
2.3.2 沙地苜蓿低温锻炼期根颈中CAT活性的变化
根据图8所示,10月1日测定龙牧801、肇东和草原3号苜蓿根颈中CAT活性高于10月15日测定的苜蓿根颈中CAT活性,但均未达到差异显著性水平(P < 0.05)。10月1日测定东苜1号、草原2号、公农1号、农菁1号和农菁8号苜蓿根颈中CAT活性低于10月15日测定的CAT活性,其中东苜1号、草原2号和农菁1号品种差异达到差异显著水平 (P < 0.05)。
10月1日测定苜蓿根颈中CAT活性较高的苜蓿品种是公农1号、东苜1号和龙牧801。10月15日测定东苜1号和草原2号苜蓿根颈中CAT活性较强,草原3号苜蓿根颈中CAT活性最弱。

图8 苜蓿根颈中CAT活性变化Figure 8 Change of CAT activity in root neck of alfalfa
2.3.3 沙地苜蓿低温锻炼期根颈中POD活性的变化
根据图9所示,8个苜蓿品种根颈中POD活性10月15日测定均高于10月1日测定,除公农1号外,其他苜蓿品种根颈中POD活性差异均达到差异显著水平(P < 0.05)。其中农菁1号苜蓿根颈中POD活性两次测定差异最大,达498.1 U·(min·g)-1。
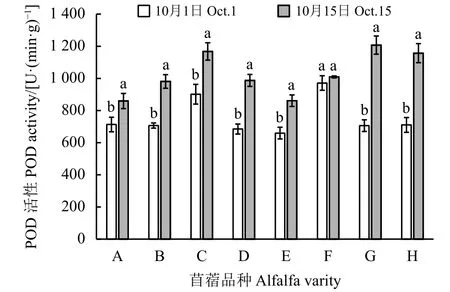
图9 苜蓿根颈中POD活性变化Figure 9 Change of POD activity in root neck of alfalfa
10月1日测定公农1号苜蓿根颈中POD活性最 大,达 971.1 U·(min·g)-1,其 次 是东苜 1 号 苜蓿。10月15日测定东苜1号、农菁1号和农菁8号苜蓿根颈中POD活性较大,龙牧801和草原3号苜蓿根颈中POD活性较小。
2.3.4 沙地苜蓿低温锻炼期根颈中MDA含量的变化
根据图10所示,10月1日测定8个苜蓿品种根颈中MDA含量均显著高于10月15日测定的根颈中MDA含量(P < 0.05),其中肇东、东苜1号和龙牧801苜蓿两次测定根颈中MDA含量差异较大,分别相差 51.8、42.9 和 40.0 nmol·mL-1。

图10 苜蓿根颈中MDA含量变化Figure 10 Change of MDA content in root and neck of alfalfa
10月1日测定农菁8号苜蓿根颈中MDA含量最高,达108.5 nmol·mL-1,较MDA含量最低的东苜1号苜蓿高19.2 nmol·mL-1。10月15日测定苜蓿根颈中MDA含量较低的品种为东苜1号和肇东苜蓿,较高的是农菁8号和农菁1号品种。
2.4 电导法协同Logistic回归方程对8个紫花苜蓿品种半数致死温度分析
表4为根据苜蓿根颈电解质渗出率求得logistic回归方程,8个苜蓿品种半数致死温度范围为-19.45 ℃至-13.11 ℃,其中草原3号半致死温度最低,农菁8号半致死温度最高;8个苜蓿品种抗寒性排序为草原 3 号 > 东苜 1 号 > 农菁 1 号 > 公农1 号 > 肇东 > 龙牧 801 > 草原 2 号 > 农菁 8 号。
2.5 苜蓿半致死温度与各生理生化指标相关性
如表5所示,苜蓿半致死温度与初秋苜蓿根颈中可溶性糖量和游离脯氨酸含量呈显著负相关关系(P < 0.05),与苜蓿根颈中MDA含量呈显著正相关关系(P < 0.05)。此外,苜蓿根颈中的可溶性蛋白含量与CAT活性和POD活性呈显著正相关关系(P < 0.05),与 C/N 呈显著负相关关系 (P > 0.05),而苜蓿根颈中的可溶性糖含量与游离脯氨酸含量呈极显著正相关关系(P < 0.01)。
3 讨论与结论
诸多研究表明[10,36-37],低温胁迫下苜蓿根和根颈中可溶性糖、可溶性蛋白和游离氨基酸含量增加。本研究表明随季节性温度降低沙地苜蓿根颈中可溶性蛋白含量增加显著,此研究结果与前人研究结果一致。与前人研究结果不同,10月1日测定苜蓿根颈中可溶性糖含量均显著低于10月15日测定,推断原因是10月1日后白天气温大于5 ℃,苜蓿地上部枝条继续生长,消耗根颈中的能源物质,根颈中可溶性糖含量降低,导致两次测定结果差异较大。脯氨酸含量是一种衡量苜蓿抗寒性的重要生理生化指标[21]。本研究表明10月1日测定肇东根颈中游离氨基酸含量显著低于10月15日测定的根颈中游离氨基酸含量(P < 0.05),而10月1日测定东苜1号苜蓿根颈中游离脯氨酸含量显著高于10月15日测定的根颈中游离脯氨酸含量(P <0.05),其他苜蓿品种间两次测定结果无差异显著性(P > 0.05),说明在低温锻炼期苜蓿根颈中游离脯氨酸含量变化不明显,此温度条件下不足以使苜蓿根和根颈受到伤害,因此不会形成为适应低温苜蓿根颈显著增加游离脯氨酸的反应。杨秀娟[38]研究表明随季节温度的降低,苜蓿叶绿素含量降低,光合能力下降。Wise和Naylor[39]研究表明植物受到低温胁迫后,其叶片中叶绿素的含量会减少,进而产生光抑制,导致光合作用降低。本研究与此研究结果不同,本研究中随季节性降温苜蓿叶片中叶绿素含量显著增加,推断由于温度降低后苜蓿叶片逐渐失水,导致叶片中色素的积累量增加,从而测得苜蓿叶片中叶绿素含量呈增加的变化趋势,同时两次测定公农1号和农菁8号苜蓿叶片中叶绿素含量均较高。

表4 低温胁迫下苜蓿根颈相对电导率拟合回归方程及半数致死温度(LT50)Table 4 Fitting regression equation of relative conductivity of alfalfa root neck under low temperature stress and LT50
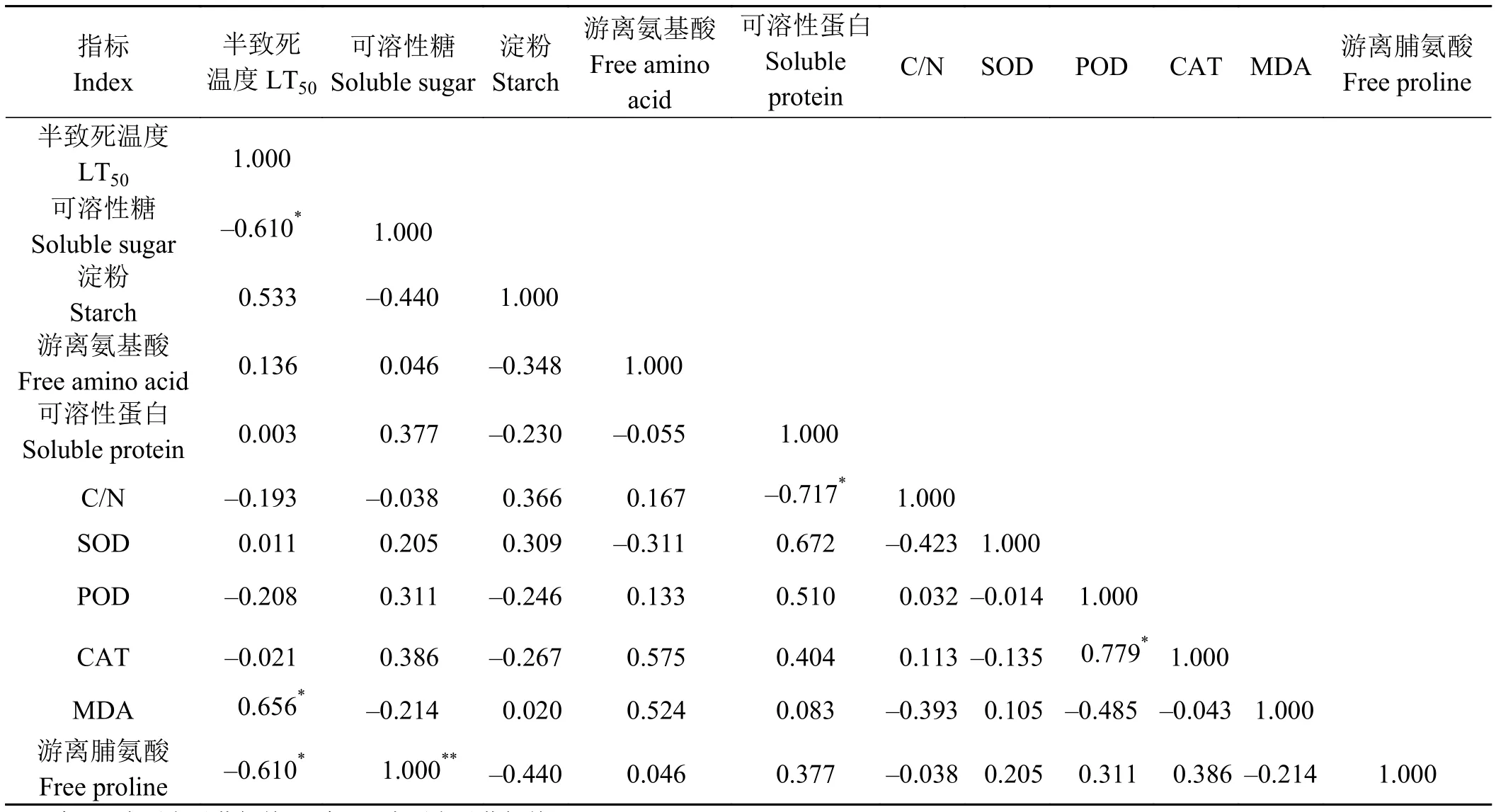
表5 苜蓿半致死温度与各生理生化指标相关性Table 5 Correlation between half lethal temperature and physiological and biochemical indexes of alfalfa
罗新义等[22]研究表明,苜蓿根颈中SOD保护酶已形成一定的耐寒机制,低温胁迫下苜蓿根颈会通过增强细胞内SOD活性使活性氧代谢处于平衡状态。邓雪柯等[26]和朱爱民等[11]研究亦表明,低温胁迫下苜蓿根颈中的SOD活性会明显增加。可见,苜蓿根颈SOD的高活性有利于苜蓿细胞膜的稳定,从而提高苜蓿的抗寒性。本研究与此结果相同,本研究发现低温锻炼期随季节性温度降低8个苜蓿品种根颈中SOD、POD活性明显升高,CAT活性变化无统一规律。其中10月1日测定苜蓿根颈中SOD活性最高的是龙牧801品种,推断龙牧801品种适应低温能力强。10月1日测定8个苜蓿品种根颈中MDA含量均显著高于10月15日测定的根颈中MDA含量(P < 0.05),原因与苜蓿根颈中POD和SOD活性增强有关。
Lyons[40]认为,当植物受到低温伤害时,细胞的质膜透性会发生较大的改变,电解质会有不同程度的外渗,抗寒性较强的细胞或受害轻的不仅渗透性小,而且渗透性的变化可以逆转,易于恢复正常。反之,抗寒性弱的细胞或受害重者,不能恢复正常,甚至造成伤害或死亡,因此相对电导率可作为抗寒性的生理指标。本研究中,电导法协同Logistic回归方程表明,草原3号抗寒性最强,其次是东苜1号苜蓿品种,而草原2号和农菁8号品种抗寒性分别排在较后;苜蓿半致死温度与初秋苜蓿根颈中可溶性糖量和游离脯氨酸含量呈显著负相关关系(P < 0.05),与苜蓿根颈中MDA含量呈显著正相关关系(P < 0.05),即苜蓿根颈中可溶性糖含量越高则半致死温度越低,游离脯氨酸含量越高半致死温度越低,苜蓿抗寒性越高;根颈中MDA含量越高半数致死温度越高,抗寒性越弱。本研究结果与Khedr和Karmouch[37]、韩瑞宏等[41]、张勇等[42]研究结果相同。
综上所述,苜蓿根颈中可溶性糖含量、游离脯氨酸含量和MDA含量可作为苜蓿抗寒性指标。植物根颈中可溶性糖含量种类众多,在感受低温后哪些类型可溶性糖含量增加,以及引起该类型糖含量增加的分子机制如何,仍需要进一步研究。分析越冬前期苜蓿根颈中渗透调节物质含量及抗氧化酶活性的变化有助于进一步了解苜蓿的越冬机制,为后期选育高抗寒品种及植物抗寒性基因提供理论基础。电导法拟合Logistic方程表明8个紫花苜蓿品种抗寒性强弱排序为:草原3号 > 东苜 1 号 > 农菁 1 号 > 公农 1 号 > 肇东 > 龙牧 801 >草原2号 > 农菁8号。建议科尔沁地区选择种植抗寒性强的草原3号和东苜1号苜蓿品种。

