硝普钠对红掌愈伤形成及植株再生的影响
李水根,李秀芬,李记开,朱建军
(上海市农业科学院林木果树研究所,上海201403)
红掌(Anthurium andraeanum)为天南星科(Araceae)花烛属(Anthurium Schott)多年生草本花卉,原产于南美洲的热带雨林。红掌佛焰苞颜色鲜艳,花型优美,具有较高的观赏价值,通常用于鲜切花、盘花和花坛造景[1]。组织培养方法是红掌种苗进行规模化生产的主要途径,其中愈伤发生的间接不定芽再生途径是目前最为高效稳定的红掌组培快繁技术手段,同时也是进行遗传转化的理想受体系统[2]。然而红掌胚性愈伤的发生能力受到基因型的影响,且再生周期较长,严重影响红掌分子育种的进程。胚性愈伤的生长状态直接影响不定芽的分化能力,提高红掌胚性愈伤的发生频率和质量,可以降低红掌组培快繁的生产成本,对于红掌的种苗生产具有重要意义。
红掌胚性愈伤的发生受到外植体、培养基、植物生长调节剂等因素的影响。Perik[3]最早开展红掌的组织培养研究,采用叶片进行离体培养获得了胚性愈伤,并最终成功诱导植株再生。此后,研究人员开展了大量的研究工作,发现红掌的叶片、叶柄、佛焰苞、合子胚和花粉均可以作为外植体诱导胚性愈伤的发生[4-5]。诱导愈伤发生的植物激素一般采用细胞分裂素 6-BA[6-9],配合使用生长素 2,4-D[6-7,9]或NAA[8,10]。单独使用6-BA或 TDZ[11-12]也能诱导愈伤组织的发生。诱导的愈伤组织类型多样[13],有致密颗粒状和松散易碎状,它们具有不同的分化潜能。有研究发现,细胞分裂素6-BA可以有效诱导红掌愈伤分化形成不定芽[6]。不定芽的发生起源于愈伤组织的表面,将愈伤进行表面划痕和再次切割后,能有效提高不定芽的分化频率[13]。红掌在丛生芽增殖时期就有不定根同步发生,而且较容易形成气生根。虽然红掌生根较容易[5],但不定根的数量较少,不定根的数量和质量直接影响植株后期移栽的成活率。
一氧化氮(NO)作为一种气体分子,在植物体内广泛存在。Shen等[14]研究发现,NO调控植物愈伤的发生和不定芽再生。硝普钠(SNP)作为NO的供体化学物质,被广泛应用于植物研究中。SNP处理可以提高山药愈伤组织发生和植株再生的频率[15],促进樱桃砧木不定芽的增殖和生根[16]。本试验开展SNP处理对红掌愈伤诱导、不定芽再生和植株生根的研究,以期提高红掌的植株再生频率和组培苗质量。
1 材料与方法
1.1 试验材料
以红掌‘阿拉巴马’的幼嫩叶片为外植体,通过愈伤诱导的间接器官发生途径,建立红掌不定芽再生体系。将红掌植株剪成带有单个芽的茎段,转接到新的增殖培养基上,每个月继代一次,实现不定芽的继代培养。
为了诱导胚性愈伤组织发生,以上述继代培养的植株叶片为外植体,将叶片横向剪成两半,叶背面朝下接种于愈伤诱导培养基上。约2个月后愈伤从叶片伤口处发生,将愈伤转接于不定芽分化培养基上,继续培养2个月左右,不定芽从胚性愈伤上诱导发生。将大于1 cm的不定芽从愈伤组织上切下,转接于生根培养基上,约1个月后植株基部可诱导不定根发生。
1.2 培养基及培养条件
红掌不定芽增殖培养基以Pierik medium[3]为基本培养基,同时添加0.5 mg/L 6-糠基氨基嘌呤(KT)和0.05 mg/L萘乙酸(NAA),培养温度为(25±2)℃,光照强度为2 000—3 000 lx,光照周期为16 h光照∶8 h黑暗。
愈伤诱导培养基以Pierik medium为基本培养基,同时添加0.5 mg/L噻苯隆(TDZ)、30 g/L蔗糖、2.8 g/L结冷胶,培养温度为(25±2)℃,暗培养。不定芽分化培养基以1/2 MS为基本培养基,同时添加0.5 mg/L 6-苄氨基嘌呤(6-BA)、25 g/L蔗糖、6.5 g/L琼脂粉。生根培养基以1/2 MS为基本培养基,同时添加0.2 mg/L吲哚丁酸(IBA)、0.4 g/L活性炭、25 g/L蔗糖、6.5 g/L琼脂粉。不定芽分化培养和植株生根培养的温度均为(25±2)℃,光照强度为2 000—3 000 lx,光照周期为16 h光照∶8 h黑暗。
在红掌愈伤诱导、不定芽分化和植株生根的过程中添加不同浓度的SNP。将SNP粉末配制成母液浓度为0.2 mol/L的水溶液,过滤灭菌后分装于棕色离心管中,保存于-20℃备用。愈伤诱导、不定芽分化以及植株生根的培养基组分和培养条件与上述相同。将培养基高温高压(121℃,103—107 kPa)灭菌20 min后,冷却至60℃,添加SNP母液,使愈伤诱导培养基、不定芽分化培养基和植株生根培养基中所含SNP的浓度梯度分别为0μmol/L、10μmol/L、20μmol/L、40μmol/L、80μmol/L。将愈伤诱导培养基分装于直径为9 cm的培养皿中,每个处理10皿,每皿接种12个外植体。将不定芽分化培养基分装于罐头瓶中,每个处理接种10瓶,每瓶接种5块愈伤组织。将植株生根培养基分装于罐头瓶中,每个处理接种6瓶,每瓶接种5棵植株。
1.3 数据统计
将叶片外植体转接到愈伤诱导培养基上,培养2个月后统计每个培养皿中的愈伤发生率和愈伤鲜重。愈伤发生率=(发生愈伤的外植体数量/接种的外植体数量)×100%。将愈伤组织转接到不定芽分化培养基上,培养2个月后,统计每瓶中不定芽诱导率以及每块愈伤组织诱导不定芽的数量。不定芽诱导率=(发生不定芽的愈伤数量/接种的愈伤数量)×100%。将不定芽剪下后转接于生根培养基上,培养1个月后统计每棵植株不定根的数量和长度。采用DPS软件进行统计学分析,方差分析采用Duncan多重比较,P≤0.05表示差异显著。
2 结果与分析
2.1 不同浓度SNP处理对红掌叶片愈伤诱导的影响
以继代培养的红掌植株叶片为外植体,将叶片从中间剪成两半,接种到愈伤诱导培养基约2个月后,白色致密型愈伤组织从叶片伤口处发生,同时在叶柄伤口处也有部分愈伤组织发生(图1)。在添加不同浓度的SNP培养基上,愈伤的发生具有一定程度的差异。其中,在添加20μmol/L SNP的愈伤诱导培养基上,叶片愈伤的诱导率和鲜重均最高,显著高于对照。当SNP浓度为40μmol/L时,愈伤的诱导率和鲜重比对照显著增加,但是外植体伤口处出现黄化,最后部分叶片发生褐化凋亡。当SNP浓度为80μmol/L时,愈伤的诱导率和鲜重均受到了严重的抑制(表1),外植体的黄化现象更为明显。试验表明,适宜浓度的SNP可促进红掌叶片胚性愈伤组织的形成,高浓度的SNP处理则抑制愈伤组织的发生。

图1 SNP对红掌叶片愈伤诱导的影响Fig.1 Effects of SNP on callus induction of A.andraeanum leaf
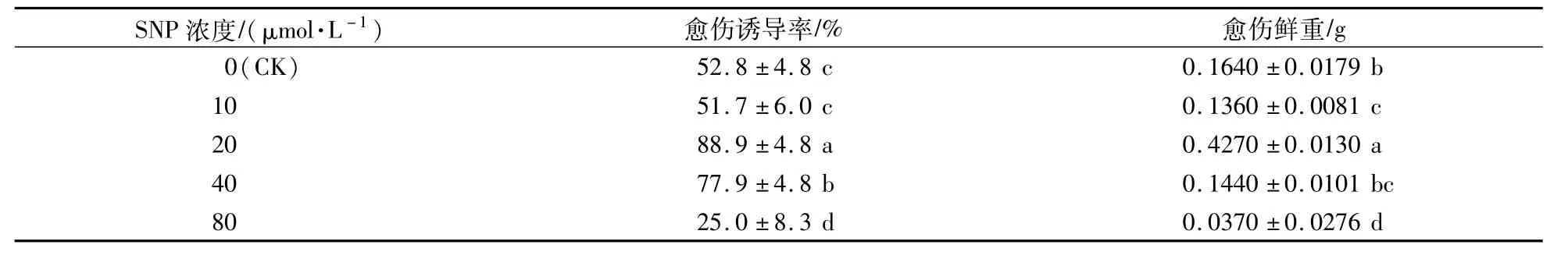
表1 SNP对红掌叶片愈伤诱导率和鲜重的影响Table 1 Effects of SNP on callus induction rate and fresh weight of A.andraeanum leaf
2.2 不同浓度SNP处理对不定芽分化的影响
将愈伤组织从叶片伤口处切下,转接于不定芽分化培养基上,并置于光照下培养。愈伤组织由白色逐渐转为绿色,红色芽点从愈伤的表面产生,不定芽逐渐伸长,展开叶片,在不定芽的基部伴有气生根发生(图2)。两个月后,愈伤表面形成丛生芽。对愈伤的分化率统计后发现,添加20μmol/L SNP的培养基上,愈伤的分化率达到了100%,但与其他处理差异不显著(表2)。对不定芽的诱导数量统计后发现,在添加40μmol/L SNP的培养基上,不定芽的诱导数量最多,而80μmol/L SNP处理则抑制了不定芽的发生(表2)。试验表明,添加SNP不能有效提高红掌愈伤的分化率,但可以增加不定芽的数量。
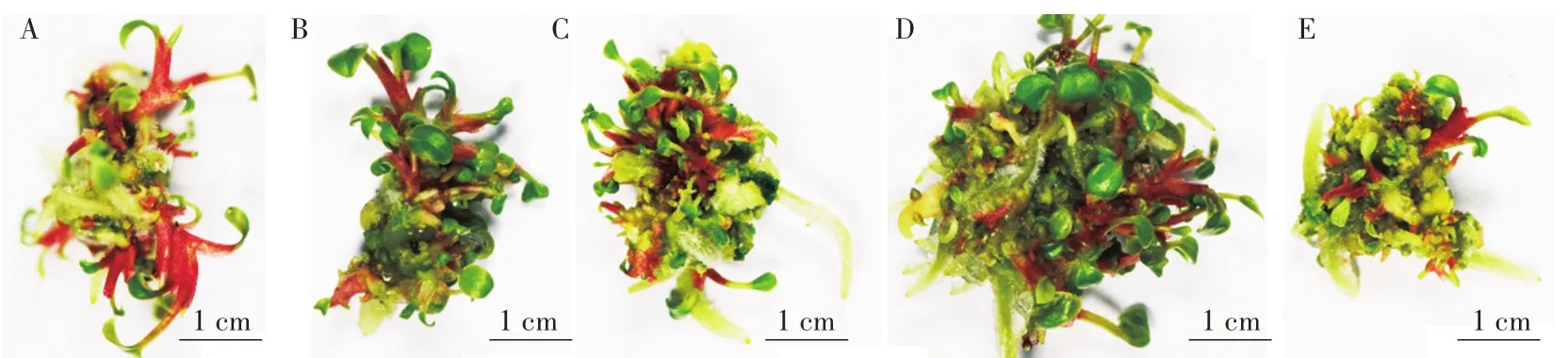
图2 不同浓度SNP处理对红掌愈伤不定芽分化的影响Fig.2 Effects of different SNP concentration on shoots differentiation of A.andraeanum
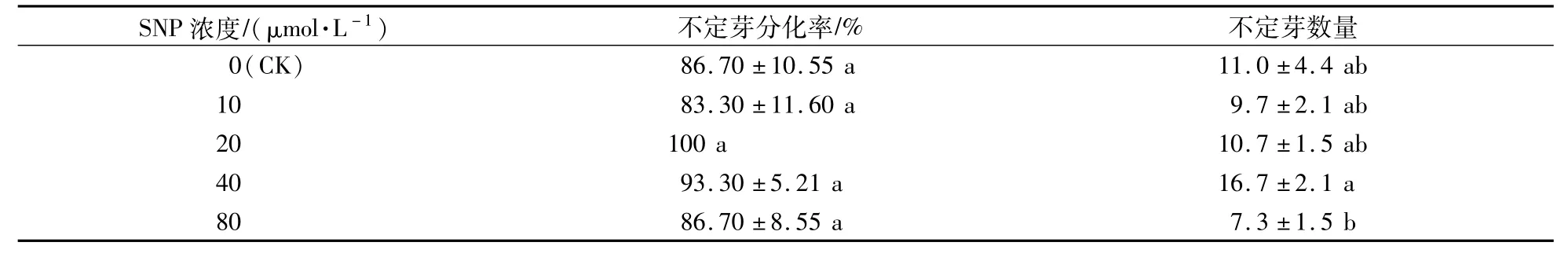
表2 SNP对不定芽分化率和不定芽数量的影响Table 2 Effects of SNP on differentiation rate and number of shoots
2.3 不同浓度SNP处理对植株生根的影响
将不定芽从愈伤组织上切下,然后转接到生根培养基上,植株基部产生根源基并伸长形成不定根,植株生长良好(图3)。一个月后统计植株的生根情况,添加不同浓度的SNP均能提高红掌植株的不定根数量,在添加20μmol/L SNP的生根培养基上,不定根的数量最多,且与对照差异显著。添加不同浓度的SNP对根长均没有显著影响(表3)。试验表明,SNP处理可以提高不定根的发生数量,但对不定根的长度无显著影响。

图3 不同浓度SNP处理对植株生根的影响Fig.3 Effects of different SNP concentration on Anthurium andraeanum rooting
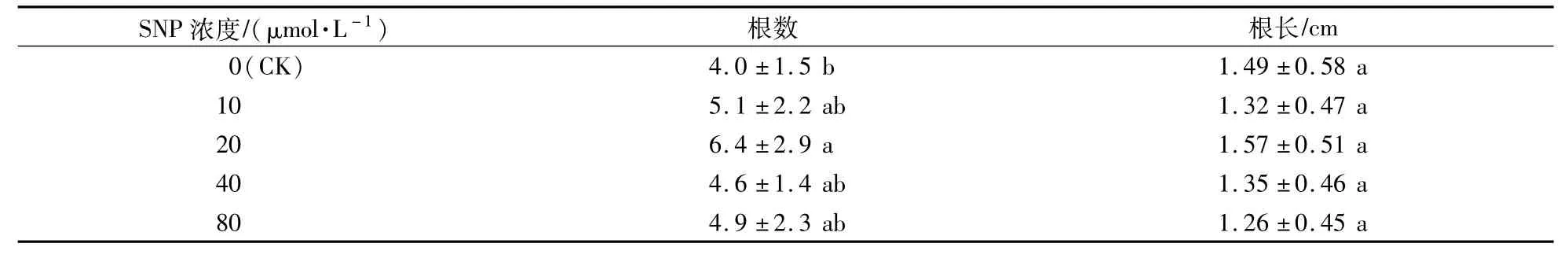
表3 SNP对植株生根数量和根长的影响Table 3 Effects of SNP on number and length of roots
3 讨论
在红掌愈伤诱导培养基中添加20μmol/L和40μmol/L的SNP均能显著提高叶片的愈伤发生频率,且添加20μmol/L的SNP使愈伤的鲜重显著高于对照;而在添加80μmol/L的SNP愈伤诱导培养基上,愈伤的发生频率和鲜重均受到了明显的抑制。Xu等[15]研究发现,SNP可以不同程度地促进山药(Dioscorea opposita)愈伤组织的发生频率,其中40μmol/L SNP处理的愈伤发生频率最高。Sarropoulou等[16]研究发现,适宜浓度的SNP处理可以提高樱桃叶片诱导的愈伤组织鲜重。Han等[17]研究发现,50μmol/L以上浓度的SNP可以抑制湖北海棠(Malus hupehensis)根诱导过程中愈伤组织的发生。因此,适宜浓度的SNP处理可以促进植物愈伤组织的发生。NO参与植物体细胞脱分化的调控过程[14],SNP促进植物愈伤组织发生的机制可能是通过提高外植体的NO含量,诱导胚性愈伤组织的发生。
本研究表明,在红掌不定芽分化培养基中添加不同浓度的SNP,不定芽的分化频率没有得到显著提高,但是添加40μmol/L SNP可使不定芽的数量显著提高。在其他植物中的研究同样表明SNP具有促进愈伤分化的作用。Han等[17]研究发现,30μmol/L SNP处理使湖北海棠不定芽的再生频率和数量均显著提高。Kalra等[18]研究发现,SNP可促进大叶合欢(Albizzia lebbeck)不定芽的再生数量,与本研究一致。推测SNP是通过增加愈伤中的拟分生组织个数[19]来提高不定芽的再生数量。
本研究表明,添加不同浓度的SNP可以提高红掌不定根的发生数量,但对根长的影响不显著。50μmol/L SNP处理使樱桃组培苗[16]的生根数得到提高,且不同基因型间差异显著。25μmol/L SNP处理对白菜侧根的长度没有影响,但显著提高了侧根的数量[20],这与本研究结果相似。SNP促进植物生根的机制可能是通过提高植株基部细胞内的NO浓度,诱导植物内源生长素IAA的合成,并促进根源基的发生。

