序贯性子宫动脉超声、光电容积脉搏波联合血清学指标检测对妊娠高血压、子痫前期的诊断价值研究
刘婷婷, 王娟妮, 吴晓玲, 张卫华, 赵乃蒙
(西安交通大学第二附属医院妇产科, 西安 710004)
妊娠期高血压疾病(Hypertensive disorders complicating pregnancy, HDCP)是一类特发于妊娠期的疾病,我国发生率约为10%,显著高于欧美国家[1]。HDCP以全身小血管痉挛、血管阻力增加、血管内皮细胞损伤为主要病理特征[2],根据病程及发病特点的不同,HDCP可分为妊娠期高血压(Gestational hypertension, GH)、子痫前期(Preeclampsia, PE)、子痫、慢性高血压并发子痫前期和妊娠合并慢性高血压五大类[3]。其中,PE是HDCP的一种严重状态,对母婴健康影响极大[4]。早预防、早诊断、早治疗对PE的防治尤为重要。有报道指出,子癫前期组的子宫动脉血流明显高于正常妊娠组,能够预测早发型子癫前期[5]。但是,在正常组的孕妇中也出现了子宫动脉血流参数较高的现象,因此其只能作为一项辅助指标,并不能作为诊断指标[6]。同时,也有研究表明胎盘生长因子(Placental growth factor, PLGF)、可溶性Endoglin(sEng)与孕妇PE的发生也有一定的相关性,但是准确性和特异性较差[7]。有研究表明,将子宫动脉血流参数和血清学联合应用诊断PE,其灵敏度和特异性高达86.21%和95.67%[8]。本研究以233例孕妇为研究对象,探讨序贯性子宫动脉超声、PPG检查联合PLGF、sEng检测对GH、PE的临床诊断价值。
1 研究对象与方法
1.1 研究对象选取2016年1月-2018年4月在西安交通大学第二附属医院建卡的233例孕早期妇女为研究对象。纳入标准:(1)孕周11~16周;(2)年龄20~40岁;(3)单胎妊娠;(4)初产妇;(5)知情同意。排除标准:(1)妊娠过程中血压异常;(2)合并存在高血压、肝肾病史、造血系统疾病等病史;(3)随访过程中失访或资料不齐全;(4)有PE家族史。根据《妊娠期高血压疾病诊治指南》中关于GH与PE的诊断标准,将孕妇分为正常对照组、GH组、PE组。3组孕妇的基线资料,包括年龄、身高、孕前体质量、体质指数(BMI)等无明显差异(P>0.05),具有可比性。
1.2 研究方法采集符合纳入标准的早孕妇女的基线资料及病史,并收集收缩期和舒张期双侧序贯性子宫动脉多普勒的阻力指数(RI)、搏动指数(PI)值,双侧食指光电容积脉搏波(PPG)参数的RI′值;随访记录孕妇血压及蛋白尿等指标至孕20~24周。再次采集前述提及的RI、PI及RI′值;随访记录时间和指标也同前。门诊采集静脉血5 mL,检测PLGF与sEng。采用ELISA法检测血清PLGF、sEng水平。随访至产后6周,追踪最终的妊娠结局,统计分析序贯性子宫动脉超声及血清学指标与GH、PE发病的相关性。
1.3 序贯性子宫动脉超声及PPG检测采用飞利浦超声诊断仪进行检查,探头频率2.5~5 MHz。嘱孕妇适度充盈膀胱,取仰卧位,在左右腹股沟处向中线斜打,定位髂外动脉后再向中轴方向移动,在子宫动脉、髂外动脉交叉处的上方放置取样窗,保持取样线与血流方向一致,连续获取3个以上形态一致的稳定血流频谱图像,系统自动测量RI、PI。根据检测时间点的不同,分别记录为RI1:11~16周子宫动脉RI值;RI2:孕20~24周子宫动脉RI值;PI1:孕11~16周子宫动脉PI值;PI2:孕20~24周子宫动脉PI值。结束序贯性子宫动脉超声检测后,利用夹指式血流参数检测仪,嘱孕妇自然延伸右臂,先测量右手食指数据,手掌自然松弛放置于桌面,保持与心脏高度齐平,至少采集3 min血流波形图,保证图形数量不少于200个,左手同此。根据检测时间点的不同,分别记录为RI′1:孕11~16周PPG参数RI′值;RI′2:孕20~24周PPG参数RI′值。
1.4 血清PLGF、sEng检测采用酶联免疫吸附试验检测孕妇血液样品中PLGF、sEng水平。以包被待测抗体的微孔板为载体,依次加入样品、标准品、辣根过氧化物酶(HRP)比较的抗体,温育后洗板,底物TMB显色。利用酶标仪在450 nm波长下测定吸光度,绘制标准曲线,计算浓度。
2 结果
2.1 3组孕妇序贯性子宫动脉超声指标及血清学指标比较3组孕妇的RI1、PI1、RI2、PI2、RI′1、RI′2、PLGF、sEng差异具有统计学意义(P<0.05);与对照组相比,GH组孕妇的RI1、PI1、RI2、PI2、RI′1、RI′2水平明显较高,PLGF/sEng值明显较低(P<0.05);与GH组相比,PE组RI2、PI2水平更高,PLGF、PLGF/sEng值较低(P>0.05)。见表1。
表1 3组孕妇子宫动脉超声指标及血清学指标比较
注:a: 正常对照组与GH组比较; b: GH组与PE组比较; c: 正常对照组与PE组比较; RI1:孕11~16周子宫动脉RI值; RI2:孕20~24周子宫动脉RI值;PI1:孕11~16周子宫动脉PI值;PI2:孕20~24周子宫动脉PI值; RI′1:孕11~16周PPG参数RI′值;RI′2:孕20~24周PPG参数RI′值; PLGF:胎盘生长因子;sEng:可溶性Endoglin。
2.2 序贯性子宫动脉超声、PPG指标单独及联合预测妊娠期高血压的ROC曲线特征RI1、PI1、RI2、PI2、RI′1、RI′2单独预测妊娠期高血压的AUC分别为0.720、0.704、0.732、0.826、0.816、0.775,PI2与RI′1单独检测的预测效能较高。随着指标联合的数量增多,AUC及灵敏度、特异度也逐渐升高。当6项指标全部联合诊断时,AUC最高可达0.889,灵敏度为85.8%、特异度为90.5%。结果见表2、图1。
2.3 序贯性子宫动脉超声、PPG指标单独及联合预测PE的ROC曲线特征RI1、PI1、RI2、PI2、RI′1、RI′2单独预测PE的AUC分别为0.795、0.816、0.813、0.915、0.911、0.849,PI2与RI′1单独检测的预测效能较高。随着指标联合的数量增多,AUC及灵敏度、特异度也逐渐升高。当6项指标全部联合诊断时,AUC最高可达0.931,灵敏度为87.6%、特异度为93.2%。结果见表3、图2。

表2 子宫动脉超声、PPG指标单独及联合预测妊娠期高血压的ROC曲线特征



图1 序贯性子宫动脉超声、PPG指标单独及联合预测妊娠期高血压的ROC曲线图

表3 序贯性子宫动脉超声、PPG指标单独及联合预测PE的ROC曲线特征

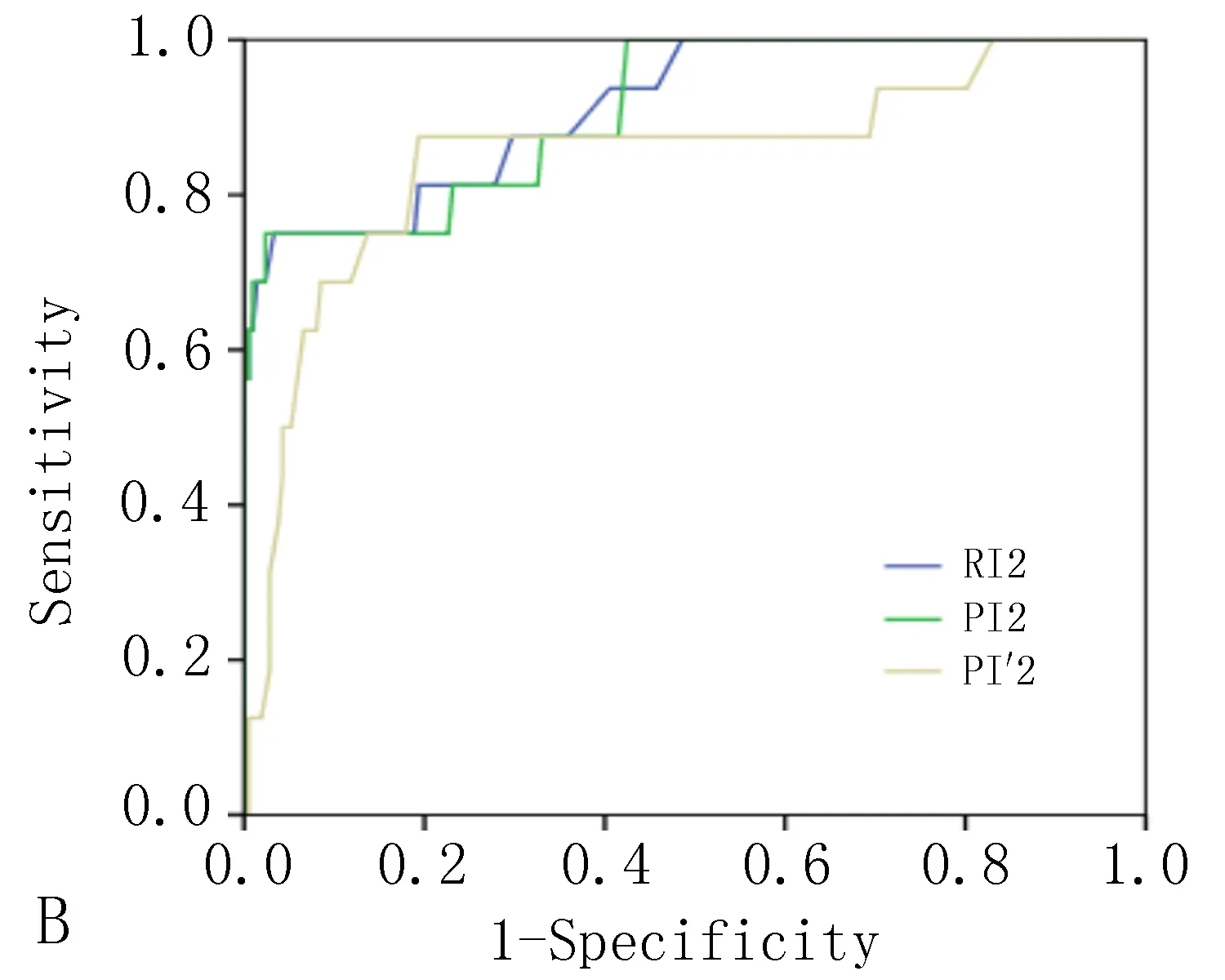

图2 序贯性子宫动脉超声、PPG指标单独及联合预测PE的ROC曲线图
2.4 血清学指标单独及联合超声指标预测妊娠期高血压的ROC曲线特征PLGF、sEng、PLGF/sEng单独预测妊娠期高血压的AUC分别为0.655、0.679、0.698,诊断效能较低;PLGF/sEng联合RI1、PI1的AUC为0.764,达中度效能;联合RI2、PI2时AUC为0.861,诊断效能进一步提高。PLGF/sEng联合全部超声指标时,AUC最高可达0.893,灵敏度为78.8%、特异度为80.5%。结果见表4、图3。

表4 血清学指标单独及联合预测妊娠期高血压的ROC曲线特征


图3 血清学指标单独及联合预测妊娠期高血压的ROC曲线图
2.5 血清学指标单独及联合预测PE的ROCPLGF、sEng、PLGF/sEng单独预测PE的AUC分别为0.808、0.830、0.838,均达中度诊断效能。PLGF/sEng联合RI1、PI1的AUC为0.867,诊断效能未明显提高,联合RI2、PI2时AUC为0.933,达高度诊断效能。PLGF/sEng联合全部超声指标时,AUC最高可达0.963,灵敏度为75.0%、特异度为98.2%,诊断效能已十分可靠。见表5、图4。

表5 血清学指标单独及联合预测PE的ROC曲线特征

图4 血清学指标单独及联合预测PE的ROC曲线图
3 讨论
早期识别高危人群、积极干预是改善子痫前期孕妇妊娠结局的必要前提,然而,子痫前期发生具有明显的异质性,在目前的技术条件下,没有任何一种单一指标可有效预测子痫前期的发生,研究者们开始尝试将各种高危因素及有效检查进行联合,包括临床高危因素筛选、多普勒超声、血液学指标和基因检测等,以期为子痫前期的早期诊断提供更多依据。本研究结合本地区实际,选取了近年来较为公认的子宫动脉超声、PPG以及PLGF、sEng检测,探讨联合检查对GH、PE的诊断价值。
子痫前期可导致孕妇子宫螺旋小动脉高阻力,胎盘供血相对不足,这是子宫动脉超声多普勒用于子痫前期诊断的病理生理基础[9]。其中,RI和PI是诊断效能较高的两项指标。本研究发现,与正常对照组相比,GH组孕妇的RI1、PI1、RI2、PI2、RI′1、RI′2水平明显较高,与GH组相比,PE组RI2、PI2水平更高。PE导致宫动脉阻力升高可分为两个阶段:(1)代偿期:早期时,母体可代偿性提高子宫动脉压力,来抵消部分因螺旋动脉高压力导致的母胎血液交流不足。(2)代偿机制失衡后,胎盘出现损伤,一系列因子被异常释放,血管内皮细胞受损,导致全身小血管阻力增高。本研究进一步利用ROC曲线检验超声造影的诊断效能,结果发现随着联合指标的数量增多,AUC及灵敏度、特异度也逐渐升高。当动脉超声6项指标全部联合诊断时,对GH诊断的AUC最高可达0.889;对PE诊断的AUC最高可达0.931。说明与孕早期超声多普勒相比,孕中期的检查结果更为可靠。联合RI、PI可明显提高诊断效能,且RI2联合PI2的诊断效能更高,该结果提示临床应以RI2、PI2的结果为主要参考。本研究中,对同一孕妇双侧的RI、PI进行比较,结果发现并无明显差异。Napolitano等[10]的研究也发现,最低、平均、最高的RI和PI值在预测子痫前期中并无明显差异。但Poon等[11]报道称,双侧子宫动脉检测较低的一侧更有诊断意义,这就需要更大样本量的临床试验进行进一步的验证。
已有多种血清因子被应用于PE的早期诊断,检测的主要环节包括胎盘缺血损伤、异常的炎症反应、血管内皮损伤等[12]。本研究主要立足于血管内皮生成失衡这一环节,选取了PLGF、sEng作为血清学指标。PIGF在胎盘中丰富表达, PIGF主要生物学功能包括诱导血管内皮细胞增殖、迁移和激活,促使胎盘血管的生成, 在妊娠胎盘的形成和发育中起重要作用,若分泌异常可与其他妊娠并发症发生密切的关系。sEng可经胎盘分泌,释放入血,可阻止转化生长因子(TGF)β1与细胞膜上TGF-βR结合,阻断TGF-β1的信号传导,进一步抑制血管形成,同时也抑制一氧化氮合酶的激活,对一氧化氮合酶的血管舒张起到抑制作用,引起血管内皮损伤,导致子痫前期发生。本研究结果发现,与对照组相比,GH组、PE组PLGF/sEng值较低,与GH组相比,PE组的PLGF、PLGF/sEng值明显较低。这表明随着病情的加重,血管内皮损伤也逐渐加重。进一步对其诊断效能进行检验后发现,PLGF、sEng、PLGF/sEng单独预测GH、PE的AUC均在0.8左右,达中度诊断效能。PLGF/sEng联合RI2、PI2时,对GH诊断的AUC达到0.861,诊断效得到进一步提高。若PLGF/sEng联合全部的超声指标时,对GH、PE诊断的AUC可达0.9左右,已达到了很高的诊断效能。
子痫以孕妇子宫螺旋小动脉高阻力、胎盘供血相对不足、母体血管内皮损伤为特征,若检测单一指标,如只检测子宫动脉血流参数或血清学指标,则准确性不高,因为非子痫孕妇有可能在上述指标中出现异常。若将早、中期子宫动脉超声、光电容积脉搏波检查序贯性联合孕中期PLGF/sEng检测,既能提示孕妇的动脉血管存在阻力,又能提示血管内皮受到损伤,能够排除单一因素的干扰或者误诊,有效提高GH、PE预测的准确性,值得临床推广。但本研究为单中心研究,样本量有限,今后可在多中心的基础上,实施更大样本量的研究,对PE进行更细的亚型分层,或能得出更具说服力的结论。

