紫草素抗阿尔兹海默病的效果研究
陈 鹏 李 龙
山东第一医科大学(山东省医学科学院),山东 泰安 271016
阿尔兹海默病(Alzheimer's disease,AD)是一种影响大脑皮层和海马区的不可逆的、渐进的和持续的神经退行性疾病,也是最常见的痴呆类型,占所有痴呆病例的50%~60%[1]。目前,全世界有3500多万人患有AD,随着全球人口老龄化,这一数字仍在不断增加,给患者的家庭以及社会带来重大的经济和社会负担[2]。大多数AD患者在早期会出现短期记忆丧失和认知功能减退等情况,随着病情的进展,可能出现更严重的症状,如人格改变、冷漠和语言问题等[3]。目前,关于AD的治疗大多以西药为主,但是这些治疗起不到根治的效果,只能在短时间内缓解患者的症状,同时还会产生一系列的副作用、抗药性和耐药性等问题[4]。中医作为我国几千年来传承下来的珍贵文化遗产,在治疗AD等一些老年疾病方面,有着十分悠久的历史和丰富的经验[5]。紫草素(shikonin,SK)是泰山紫草的提取物之一,具有抗肿瘤、抗炎、抗病毒以及改善微循环和减轻组织水肿等作用[6]。为此,本次研究选取PC12细胞系为研究对象,在Aβ25-35的诱导下构建AD细胞模型,以研究SK抗阿尔兹海默病的作用效果。
1 材料与方法
1.1 材料
PC12细胞购于中国科学院上海生命科学研究细胞资源中心,SK购于中国生物制品检定所,Aβ25-35和二甲亚砜(DMSO)购于美国Sigma公司,DMEM高糖培养基和胰蛋白酶购于美国Hyclone公司,胎牛血清(FBS)购于美国Gibco公司。所用试剂盒如下:AnnexinV-FITC/PI凋亡试剂盒购于美国BD公司,MTT试剂盒、线粒体膜电位检测试剂盒和ROS检测试剂盒均购于上海碧云天生物技术有限公司。所用仪器如下:多功能酶标仪(SYNERGY4,美国伯腾公司);流式细胞仪(FACSCalibur,美国BD公司)。
1.2 方法
1.2.1SK预保护及AD细胞模型的构建 使用含有10%胎牛血清(FBS)、100 IU/mL青霉素和100 μg/mL链霉素的DMEM高糖培养基在37℃,5%CO2的培养箱中对PC12细胞株进行培养。24 h后,向细胞中加入浓度为0、5、20和40 μmol/L的SK,保温箱中预保护24 h,再加入浓度为20 μmol/L的Aβ25-35进行AD细胞模型的构建,继续共培养48 h。
1.2.2细胞活性的检测 本次实验根据SK处理浓度的不同分为对照组、低剂量组、中剂量组和高剂量组。待上述细胞培养结束后,弃去旧培养基,向每个孔内加入浓度为5 mg/mL的MTT溶液20 μL。另取100 μL培养液置于孔内作为空白组(无细胞)。之后在培养箱中孵育4 h。培养结束后,弃去上清液,加入200 μL DMSO溶解液于其中,然后将其放于振荡器上振荡10 min以溶解萃取底部结晶。待结晶完全溶解后,使用酶标仪检测其在490 nm处的OD值,重复3次,取平均值。
1.2.3细胞凋亡的检测 细胞分组同上,将各组细胞的旧培养基弃去,使用PBS进行洗涤(3次)。加入不含EDTA的胰蛋白酶对贴壁细胞进行消化,吸出胰蛋白酶消化液,加入完全培养基终止消化。收集细胞悬液,于离心机离心5 min(1000 r/min),舍弃上清液,收集细胞并用PBS重新悬浮,离心5 min(1000 r/min)。弃去上清液后加入Binding Buffer并将其转移至流式管中,加入5 μLAnnexinV-FITC,混匀后于室温和避光的条件下孵化15 min,上机前5 min加入5 μL PI进行染色,使用流式细胞仪对细胞的凋亡进行检测,重复3次,取平均值。
1.2.4线粒体MMP的测定 细胞分组同上,将各组细胞的旧培养基弃去,使用PBS进行洗涤3次后加入JC-1染色液,置于37℃,5%CO2保温箱中培养20 min。培养完成后,离心弃去上清液,加入JC-1染色缓冲液对细胞进行洗涤(2次),加入JC-1染色缓冲溶液300 μL重悬细胞并转移至流式管中,使用流式细胞仪对线粒体的MMP进行检测,重复3次,取平均值。
1.2.5细胞内ROS含量的测定 细胞分组同上,将各组细胞的旧培养基弃去,使用PBS进行洗涤3次后加入10 μM的DCFH-DA,置于37℃,5%CO2保温箱内黑暗中染色15 min。培养完成后,离心弃去上清液,用PBS对细胞进行洗涤(2次),加入Binding Buffer重悬细胞并将其转移至流式管中,使用流式细胞仪对细胞内ROS的含量进行检测,重复3次,取平均值。
1.3 统计学分析
2 结 果
2.1 SK对AD细胞活力的影响
如表1和图1所示,与对照组相比,加入SK预保护后的各组AD细胞的生存率明显升高(P<0.05),并且呈现出剂量依赖性。低剂量组、中剂量组和高剂量组间的差异具有统计学意义(P<0.05)。由此可知,SK可以显著提高AD细胞的存活能力。
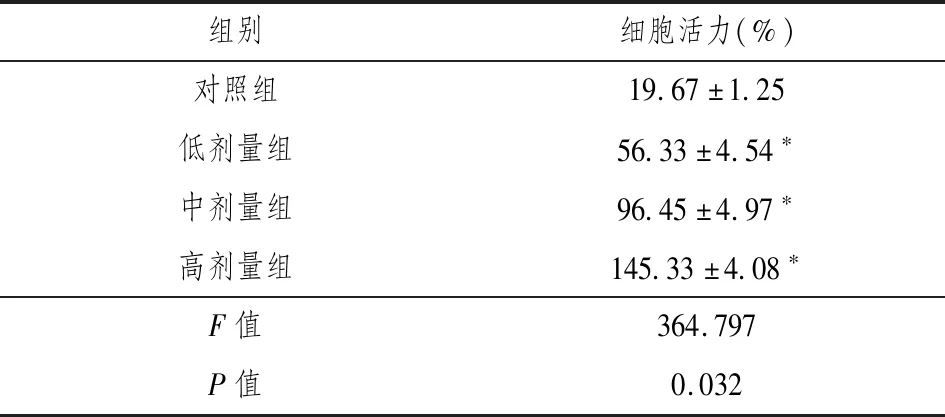
表1 SK对AD细胞活力的影响
注:与对照组相比,*P<0.05。
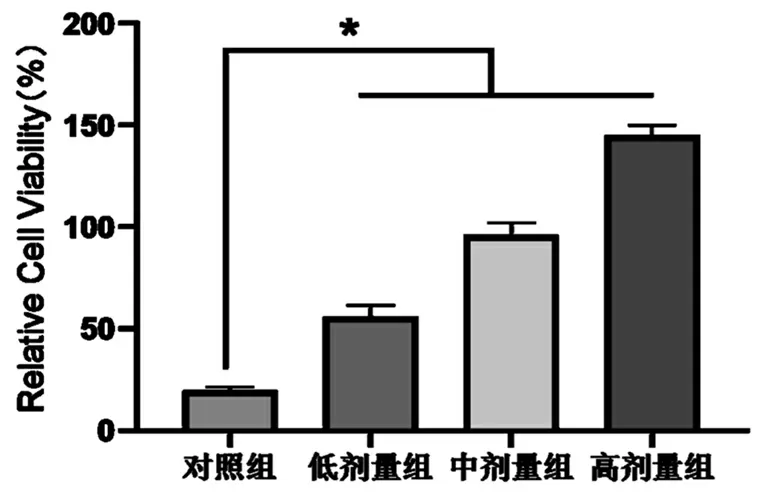
与对照组相比,*P<0.05
2.2 SK对AD细胞凋亡的影响
如表2和图2所示,使用SK对PC12细胞进行预保护后,各组AD的凋亡率与对照组相比显著降低(P<0.05)。随着SK浓度的加大,凋亡率呈现下降的趋势,且低剂量组、中剂量组和高剂量组间的差异具有统计学意义(P<0.05)。因此,SK可以有效的保护AD细胞,并对其凋亡起到抑制的作用。
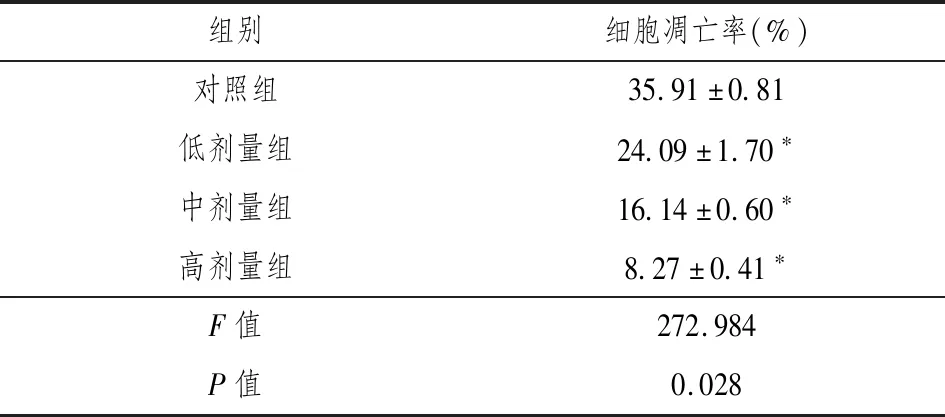
表2 SK对AD细胞凋亡的影响
注:与对照组相比,*P<0.05。
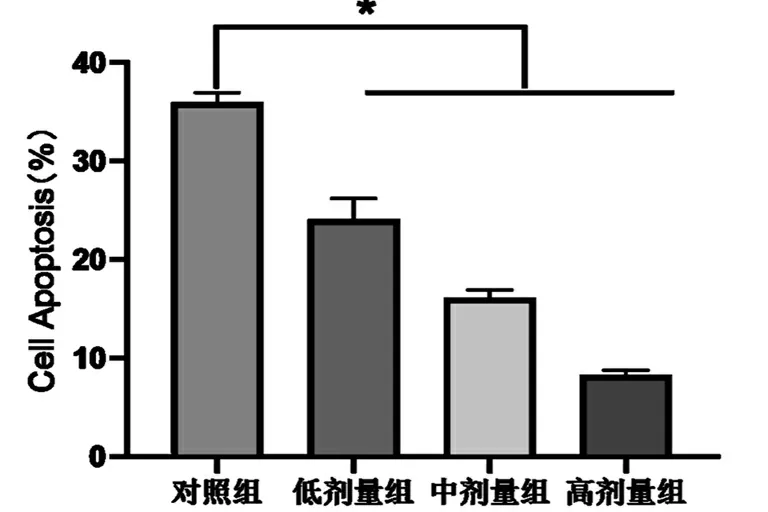
与对照组相比,*P<0.05。
2.3 SK对AD细胞线粒体MMP的影响
MMP下降时即指示线粒体功能出现障碍,本实验借助线粒体膜电位检测试剂盒和流式细胞术对AD细胞中的线粒体MMP的变化情况进行了测定。如表3所示,对于未加入SK预保护的AD细胞(对照组),其线粒体MMP荧光指数显著低于加入SK的各组AD细胞;经过SK的预保护干预,AD细胞内线粒体荧光指数均显著增高,且成梯度变化,与对照组间的差异具有统计学意义(P<0.05)。
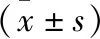
表3 各组细胞内线粒体MMP的检测
注:与对照组相比,*P<0.05。
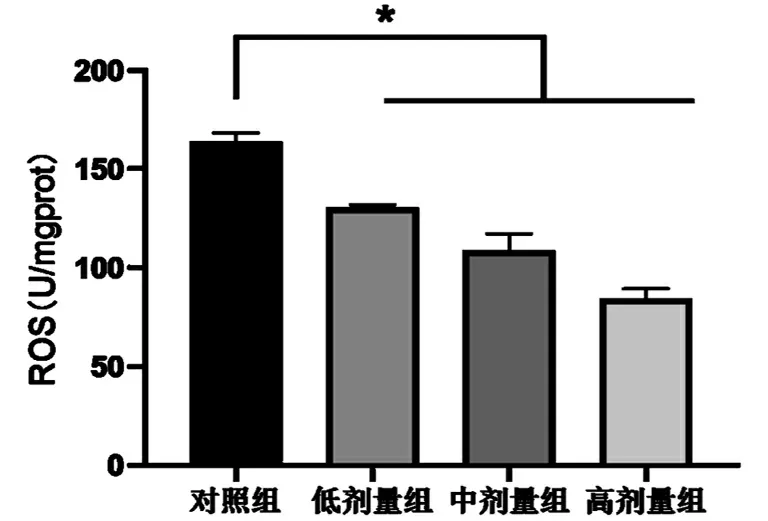
2.4 SK对AD细胞内ROS含量的影响
ROS是细胞新陈代谢的产物之一,过度的累积会造成细胞产生氧化应激反应并最终导致细胞的死亡。如表4和图3所示,使用不用浓度的SK预处理后再使用Aβ25-35对其进行诱导时,相比于对照组,细胞内的ROS含量明显下降(P<0.05),且不同剂量SK组间的差异具有统计学意义(P<0.05)。由此可知,SK可以显著降低Aβ25-35导致的AD细胞内ROS的过度积累。

表4 SK对AD细胞凋亡的影响
注:与对照组相比,*P<0.05。
与对照组相比,*P<0.05
3 讨 论
AD被认为是老年痴呆的最常见原因之一。通常,AD的症状开始于轻微的记忆障碍,但最终会逐渐演变成认知障碍、复杂日常活动中的功能障碍以及其他认知障碍[3]。当患者被临床确诊为AD时,其许多脑区已经出现了神经元丢失和神经病理损害等情况[7]。因此,中止脑部神经潜在损害的关键方法就是在AD恶化之前及时提供神经保护类药物。而西医针对AD的治疗性药物居多,对神经细胞的保护性药物少之又少[8]。
中医对AD有相当丰富的研究和治疗经验,早在汉代的《华佗神医秘传》中就记载了对AD的相关描述,并以“痴呆”为其病名[9]。从中医角度出发,“痴呆”虽然病发在脑部,但与五脏六腑有着密不可分的关系[10]。中医以“肾精不足,隋海失养”、“心脾两虚,气血不足”以及“肝失疏泄,痰瘀交结”对AD的病机进行了阐述[11]。近年来,中医在治疗和预防AD方面取得了较大的进展[12]。孙冬梅等人发现,姜黄素对患有AD的小鼠具有一定的治疗作用,可以有效降低小鼠脑中Aβ以及Ptau蛋白的表达,提高小鼠的记忆能力,抑制小鼠脑细胞的凋亡[13]。凌军军发现红芪多糖对经Aβ25-35诱导的AD细胞具有保护作用,可以有效抑制其凋亡[14]。崔婧发现人参皂甙Rg2可以通过磷酸肌醇3-激酶/aKT途径保护PC12细胞免受Aβ25-35诱导的凋亡,具有保护神经细胞的作用[15]。同时,李卉也在研究AD大鼠模型时发现人参皂甙配伍远志皂甙或者金针菇多糖都可以有效的提升AD大鼠的记忆能力和空间认知能力[16]。齐宇航在体外实验中发现,吴茱萸碱对神经具有良好的保护作用,可以有效减少AD细胞的凋亡,改善细胞内的线粒体MMP失衡的情况,同时还可以降低细胞内ROS的积累[17]。此外,韦梦莹等发现中药五味子对AD大鼠体内的神经递质代谢、APP代谢、抗氧化系统以及炎症反应具有一定的调节作用,可以有效改善大鼠认知障碍等情况[18]。
SK是泰山紫草的主要提取物,分子式为C16H16O5,生理活性和药物作用十分丰富,不仅在抗肿瘤、抗炎、抗病毒等方面具有较高的应用价值,而且毒副反应也很低,因此具有良好的临床应用前景[19]。近年来,研究证明SK对神经具有良好的保护作用。朱丹等人发现SK可以对缺血性脑损伤的大鼠脑组织起到保护作用[20]。李哲等人发现SK对慢性脑低灌注损伤大鼠的学习以及记忆能力有良好的改善作用,可以有效的减轻氧化应激所带来的损伤[21]。为此,本实验利用Aβ25-35诱导建立了AD细胞模型,以探究SK对AD作用机制。研究结果表明,经过SK预保护过的PC12细胞受Aβ25-35诱导后,其凋亡率和细胞内的ROS水平都发生了显著的降低,细胞活力和细胞内线粒体MMP得到了显著的提升,而且这些变化都呈现出了剂量依赖性的特点。
综上所述,SK对于Aβ25-35诱导的AD细胞具有良好的保护作用,可以有效减少细胞的凋亡,增加细胞的活力,改善线粒体功能。同时,还可以抑制AD细胞内ROS的累积,减少氧化应激导致的细胞死亡。因此,SK对抗AD起着良好的效果,可以作为预防和治疗AD的神经保护候选物。

