功能化介孔二氧化硅负载顺铂纳米药物的制备及其对乳腺癌细胞的杀伤作用
刘伟坤 张 萌 李炳龙 管西栋 孙明爽 何玉静 王春晓 赵宝昌 张吉梅
山东第一医科大学(山东省医学科学院),山东 泰安 271016
乳腺癌是全球女性最常见的癌症之一,流行病学研究显示其发病率呈上升趋势,且发病年龄日趋年轻化[1]。乳腺癌治疗棘手,严重影响患者的生存质量,化疗是治疗乳腺癌的主要手段之一[2]。顺铂 (cisplatin,CDDP)具有广谱抗癌作用,属于细胞周期非特异性药物,常用于乳腺癌的化疗,然而其水溶性差,限制了药物吸收,导致抗肿瘤效果不佳[3]。同时因其缺乏选择性,往往会引起不可逆的毒副作用。因此开发能够有效抑制肿瘤生长的靶向铂类药物制剂,降低用药量的同时提高抗肿瘤效率,对乳腺癌的治疗至关重要[4]。
近年来,纳米技术的发展和纳米材料的开发为肿瘤的治疗开辟了新的途径。介孔二氧化硅纳米颗粒(mesoporous silica nanoparticle,MSN)作为一种新型的纳米材料,具有比表面积高,孔容积大,孔径分布均一,生物相容性好等优点,可以作为许多抗癌药物的良好载体[5]。为增加药物的靶向性并提高对靶细胞的毒性,可以在MSN表面修饰靶标分子如透明质酸(hyaluronan hyaluronic acid,HA)。HA是细胞外基质的成分之一,不受机体免疫排斥,生物相容性好[6]。研究表明,HA可与肿瘤细胞表面高表达的CD44受体特异性结合,以受体介导的内吞途径进入肿瘤细胞,低pH值环境中存在透明质酸酶(hyaluronidase,Hyal-1)可迅速降解HA调控药物的释放[7-8]。因此,本研究设计具有肿瘤主动靶向性的载顺铂功能化介孔二氧化硅纳米药物(CDDP@HA-MSN),并评价该纳米药物的体外抗肿瘤活性。
1 材料和方法
1.1 材料
顺铂(货号:J44380-250 mg)购自上海金穗科技有限公司,透明质酸(货号:S7020)购自青岛中科泰达经贸有限公司,十六烷基三甲基溴化铵(CTAB,货号:30725-10G-10G)和正硅酸四乙酯 (TEOS,货号:345156-10G-10G)购自Sigma-Aldrich公司,3-氨基丙基-三乙氧基硅烷 (APTES,货号:A7440-100ml)购自北京华夏远洋科技有限公司,透明质酸酶(Hyal-1,货号:TH7399)购自合肥博美生物科技有限责任公司,其余试剂如氢氧化钠、浓盐酸、二甲基亚砜、无水乙醇等均为市售分析纯。
1.2 介孔二氧化硅纳米颗粒(MSN)制备
按照文献报道的方法[9-10],称取1.02 g CTAB,加入到盛有480 mL三蒸水的烧杯中,超声助溶后加入2 mol/L氢氧化钠溶液3.5 mL形成弱碱性溶液,持续搅拌至溶液均匀。烧杯中逐滴缓慢加入5 mL TEOS,恒温高速搅拌后静置至产生白色沉淀,白色沉淀经甲醇和去离子水洗涤3次后放到真空干燥箱中,60℃干燥过夜,得到的白色粉末即为MSN。将500 mg MSN经100℃油浴干燥后加入2 mL APTES和50 mL无水乙醇,置于-80℃冰箱中回流12 h,再次经醇洗后离心干燥,即得氨基化介孔二氧化硅纳米颗粒(NH2-MSN)。在70 mL水中搅拌溶解200 mg HA并将pH值调至4.7。加入19.17 mg EDC和11.51 mg NHS,搅拌均匀后,加入500 mg NH2-MSN,继续室温搅拌12 h,离心后干燥,即得透明质酸功能化介孔二氧化硅纳米颗粒(HA-MSN)。
1.3 载顺铂功能化介孔二氧化硅纳米药物(CDDP@HA-MSN)制备
将100 mg顺铂完全溶解到100 mL体积比为1∶1的水与二甲基亚砜混合液中,然后加入200 mg的HA-MSN,超声分散后避光搅拌24 h。样品最后以10 000 r/min离心30 min,然后用去离子水洗涤多次,至上层溶液清澈后离心,在真空干燥箱常温下干燥过夜后得到纳米药物CDDP@HA-MSN。
1.4 CDDP@HA-MSN的表征
取适量CDDP@HA-MSN纳米药物,稀释后超声分散均匀,取10 μL混悬液滴于载有碳膜的铜网上,干燥后透射电镜观察其颗粒形态尺寸、均匀程度、团聚状况等微观形貌。同时取CDDP@HA-MSN纳米药物分散在去离子水中,至适宜浓度,然后采用马尔文粒径测定仪对纳米药物的平均粒径、电位进行表征。
1.5 CDDP@HA-MSN的包封率与载药量
包封率与载药量的测定:取制备好的CDDP@HA-MSN溶液,离心,收取上清液,精密吸取适量混合液,运用紫外分光光度法测定溶液在301 nm检测波长下的吸光度,测定DDP的含量(记为W1);干燥后称重(记为W2);DDP的初始投入量(记为W3)。根据下列公式计算包封率(EE)和载药量(DL):① EE=(W3-W1)/W3×100%;② DL=(W2-W1)/W3×100%。
1.6 CDDP@HA-MSN的释放度测定
取适量稀释的CDDP@HA-MSN和CDDP原药储备液(含有等量的CDDP),分别转入已处理过的截留分子量为3 000 Da的透析袋中,将透析袋两头夹紧后放入盛有不同pH值的PBS缓冲液[含或不含100 U/mL透明质酸酶(Hyal-1)]的烧杯中,37℃恒温避光振荡。每隔一定时间,分别取等量溶液,同时补给等量的释放介质。运用紫外分光光度法测定溶液中顺铂的含量,计算累计释放率。平行重复3次。
1.7 乳腺癌细胞杀伤作用研究
将乳腺癌细胞(MDA-MB-231)采用15%胎牛血清的L-15培养基,在含5%CO2的培养箱中于37℃下培养。细胞生长至对数生长期时,胰蛋白酶消化、离心,加入适量L-15培养基重悬细胞,计数并接种于96孔板中,0.5×104个细胞/孔,贴壁生长24 h。用细胞培养基倍数稀释CDDP及CDDP@HA-MSN贮备液,以生理盐水和空白HA-MSN为对照,利用MTT比色法研究细胞存活率。培养24 h后,PBS洗涤细胞3次,加入含10%MTT的培养基,孵育4 h后吸弃培养基,加入150 μL DMSO溶液底部结晶,以酶标仪测定各孔在490 nm处的吸光度,比较CDDP与CDDP@HA-MSN的抗肿瘤活性。每个样品重复3次取平均值。
1.8 统计学方法
2 结果与讨论
2.1 CDDP@HA-MSN的大小与形貌表征
TEM图片显示制备的CDDP@HA-MSN纳米药物为球形,直径为(150±18)nm,颗粒尺寸分布均匀,分散情况良好(图1A)。马尔文粒径测定仪对纳米药物进行表征的结果表明其水合粒径为160.7 nm(图1B),两种测量的结果基本吻合。该尺寸的纳米药物在体内具有长循环效果,并通过增强渗透与滞留效应(EPR效应)增强药物的被动靶向性与抗肿瘤活性。
2.2 CDDP@HA-MSN的包封率与载药量
经紫外分光光度法测定CDDP@HA-MSN载药量为18.7%,包封率为82.8%,说明所制得的纳米颗粒具有较高的包封率,可能与该颗粒具有介孔这一独特结构有关,使药物能够吸附于介孔孔道中,而且透明质酸包覆到介孔二氧化硅表面作为堵孔剂,减少了药物的渗漏量,增加了纳米药物的运输稳定性和肿瘤靶向性。
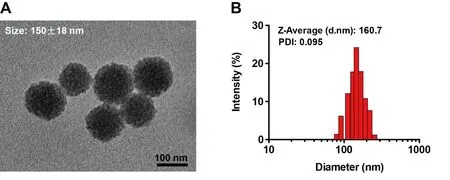
图1 CDDP@HA-MSN的电镜与DLS表征
2.3 CDDP@HA-MSN的释放度
由于血液的pH值约为7.4,我们首先测定了CDDP及CDDP@HA-MSN在pH 7.4环境中的释放度,结果如表1与图2所示。在pH 7.4的释放介质中,CDDP在2 h时药物累积释放量为15%,6 h累积释放量98%,预示顺铂在血液中的释放较快,且很快会被机体代谢排除,这与其他文献中报道的仅有少量顺铂可以进入肿瘤细胞相吻合[3]。纳米药物CDDP@HA-MSN在2 h的时候,其药物累积释放量为2%,24 h累积释放量也仅为38%,这预示纳米药物在血液中的释放较慢,纳米药物表面的HA可避免内部的CDDP过早释放,保证了药物在血液中的稳定性。同时,我们发现在pH 7.4的释放介质中添加Hyal-1后,24 h药物累积释放量也仅为39%,这表明是否添加Hyal-1对药物的释放几乎没有影响(P>0.05)。可能是与Hyal-1在pH 7.4的环境中没有酶活性,不能降解纳米药物表面的HA有关。
由于肿瘤细胞内pH较低且Hyal-1呈高水平表达,因此我们对比考察了纳米药物CDDP@HA-MSN在pH 4.5的介质中是否添加Hyal-1情况下的药物释药比例。在pH 4.5且不添加Hyal-1的情况下,纳米药物2 h累积释放量为2.4%,24 h药物累积释放量为76%;在pH 4.5且添加Hyal-1的情况下,纳米药物2 h累积释放量为4.7%,24 h药物累积释放量为92%。释放情况对比发现,Hyal-1可提高药物的释放速率(P<0.001)。这表明,当CDDP@HA-MSN进入肿瘤细胞后,HA可被细胞中的Hyal-1降解,从而使纳米药物中的CDDP快速释放,证明该纳米体系是透明质酸酶响应的可控、靶向纳米释药体系。
2.4 乳腺癌细胞杀伤作用研究
为了探究纳米药物CDDP@HA-MSN对癌症细胞的杀伤效果,我们利用MTT体外毒性实验检测了HA-MSN空白纳米颗粒对乳腺癌细胞MDA-MB-231杀伤作用,结果如图3A所示。HA-MSN处理细胞24 h后,细胞活率>90%,说明材料具有良好的生物安全性,对细胞基本无毒。在排出空白载体的干扰后,我们又检测了单纯CDDP与CDDP@HA-MSN纳米药物对乳腺癌细胞MDA-MB-231杀伤作用。不同浓度的CDDP和CDDP@HA-MSN对MDA-MB-231细胞的毒性的影响见表2与图3B。结果显示,CDDP和CDDP@HA-MSN对MDA-MB-231均起到了明显的杀伤作用,并且杀伤作用也随着药物浓度的提高而逐渐提高。在顺铂含量相同的条件下,CDDP@HA-MSN对癌细胞的杀伤作用大于单纯顺铂(P<0.001)。同时,经计算所得,CDDP的半数抑制浓度(IC50)约为72 μM,CDDP@HA-MSN的IC50约为48 μM,这表明CDDP@HA-MSN的IC50值比自由药物CDDP小,抑制细胞增殖的效果更加明显。由此推断,CDDP@HA-MSN高效抑瘤作用的机理可能体现在以下几个方面:①由于单纯顺铂大部分是经自由扩散途径快速进入细胞的,其也会很容易的被细胞排出,从而对细胞的作用时间较短,效果较差。而纳米药物CDDP@HA-MSN进入细胞主要是受体介导的内吞途径,即纳米体系改变了药物进入细胞的途径,减少了细胞对药物的泵出,使药物在细胞内部作用的时间延长,使药物能够更持久有效的发挥作用;②纳米药物CDDP@HA-MSN由于具有特殊的介孔特性,可以同时携带多个药物分子,使细胞内富集的药物浓度增加;③纳米药物CDDP@HA-MSN具有肿瘤靶向性,且其释放具有透明质酸酶响应性,从而大大减少了对正常组织的毒副作用。因此,纳米药物CDDP@HA-MSN的抑瘤效果更佳,生物安全性更高。
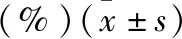
表1 CDDP@HA-MSN的体外累积释放度
图2 CDDP@HA-MSN的体外累积释放度(%)
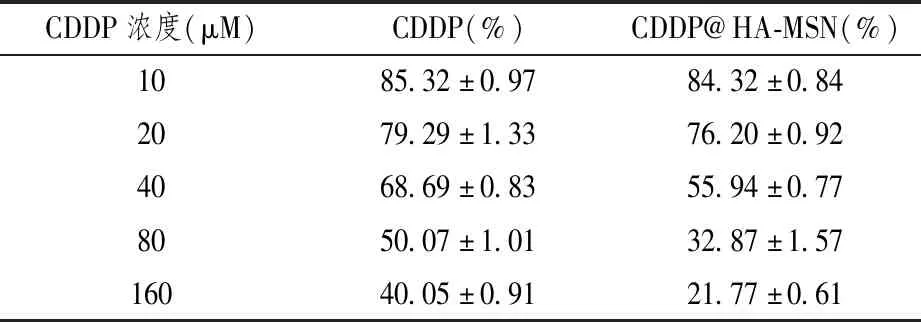
表2 CDDP、CDDP@HA-MSN对乳腺癌细胞的杀伤作用
3 结 论
化疗是目前临床上治疗乳腺癌的主要手段。顺铂的临床应用历史悠久,抗癌活性强,应用谱广,与其他抗癌药物发生交叉耐药较少。但其本身具有剂量性依赖毒副作用,长期使用会造成轻、中度肾损伤、耳损伤等毒副作用,并易产生耐药性[11]。因此研制一种低毒高效的抗癌药物,提高顺铂的靶向性,减小其对机体的毒副作用具有非常重要的研究意义。
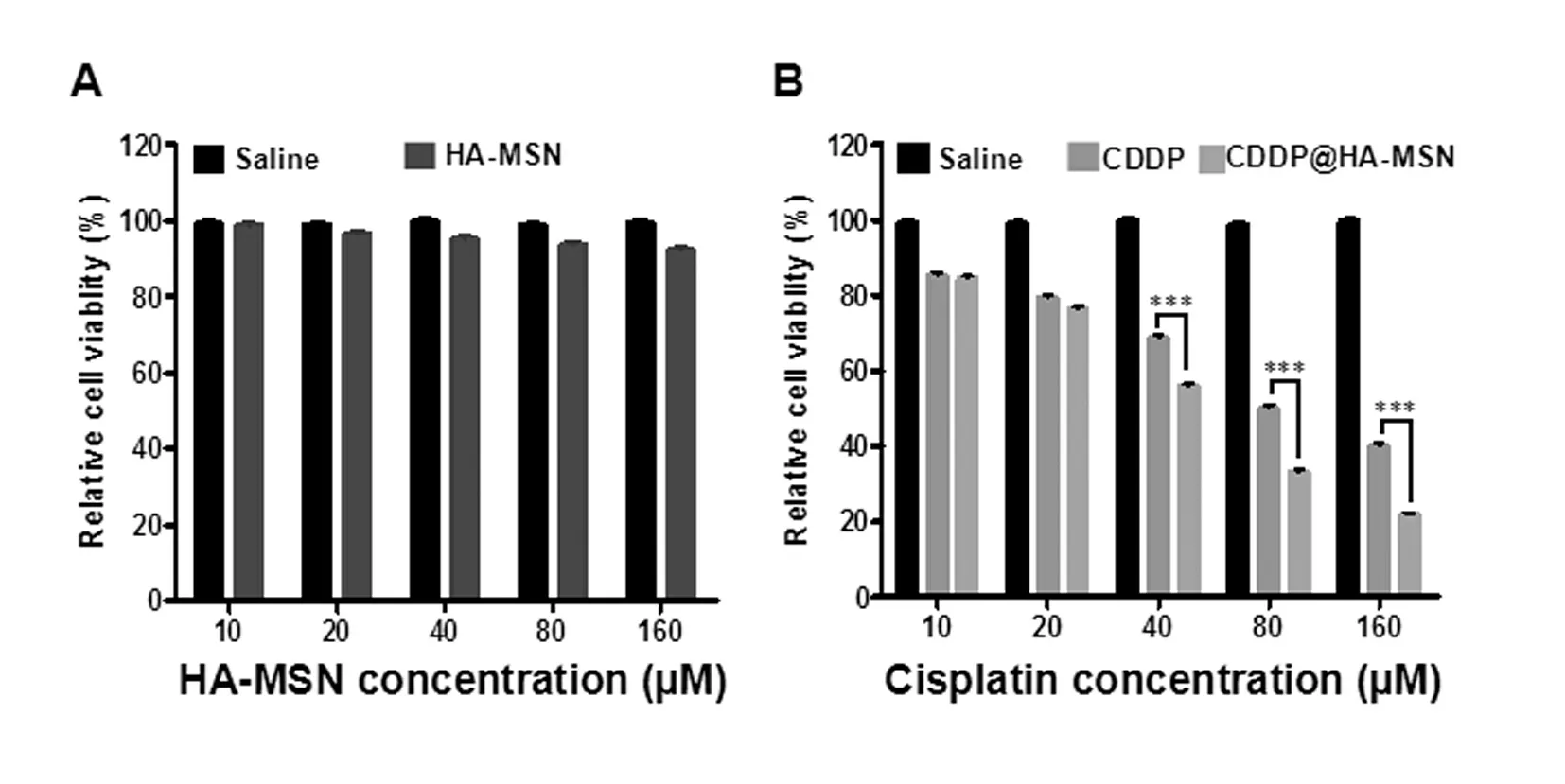
图3 MSN、顺铂、CDDP@HA-MSN对乳腺癌细胞的杀伤作用
随着纳米科学的发展,纳米载体被广泛应用于医学领域,如影像增强,药物靶向输送,基因治疗等。大量的体内体外研究证实,在一定的浓度范围内,SiO2纳米颗粒对人体几乎无毒,且能够通过体内循环代谢清除。MSN比表面积高,孔容积大,是药物分子的理想载体[12]。透明质酸作为堵孔剂保证药物在血液运输时不释放,而且作为靶向试剂可以与CD44+肿瘤细胞特异性结合并选择性富集,利用肿瘤细胞内过表达的透明质酸酶降解纳米药物表面的透明质酸,释放药物实现响应性释放[13]。基于功能化介孔二氧化硅制备的纳米药物具有良好的生物相容性,较高的包封率和载药量,能够很好的被肿瘤细胞吞噬,有效提高药物的靶向抗肿瘤效果[14]。
本研究通过纳米技术成功设计了尺寸合适、性质稳定、生物安全性好的透明质酸功能化介孔二氧化硅包载顺铂纳米药物(CDDP@HA-MSN);体外释药研究表明,该纳米药物具有很好的透明质酸酶响应性;对乳腺癌细胞MDA-MB-231的杀伤作用研究表明,MDA-MB-231对肿瘤的杀伤能力显著大于游离药物顺铂,纳米药物MDA-MB-231有望提高对乳腺癌的靶向治疗效果。

