“轴线点面分析法”在化学平衡图象问题中的应用
黑龙江
化学平衡图象分析题一直是历年高考的热点题型之一,主要包括化学反应速率和化学平衡图象分析题、水溶液中的离子平衡图象分析题。解答图象分析题的基本方法可采用“轴线点面分析法”,这种解题方法主要依据四方面:一看轴、二看线、三看点、四看面。“一看轴”指面对图象分析题,首先要看横纵坐标轴所代表的含义、单位及其对应的函数关系,一般情况下横坐标是变化条件,纵坐标是变化的结果,例如在“速率—时间”图象中,随着横轴(时间)的变化,纵轴(化学反应速率)是如何改变的;“二看线”是指弄清随横坐标的递增,纵坐标的值是递增的还是递减的,并进一步分析其中的对应关系,分析曲线的变化趋势(如斜率的大小及升降等),然后再联想化学原理进行解答。一般来说,若曲线是单调递增(或递减),则涉及一个反应,若曲线是先增后减、或先减后增,必涉及多个反应;“三看点”指根据图象进行计算时,要特别注意曲线中一些关键节点所包含的信息,如曲线的起点、终点、转折点、交叉点和极值点等;“四看面”指的是看图象上是否需要做辅助线,通过画出辅助线来确定某点横纵坐标值的大小关系。下面以化学反应速率和化学平衡曲线图、水溶液中的离子平衡曲线图的典型图象为例,说明“轴线点面分析法”在解答化学平衡图象分析题中的具体应用。
一、化学反应速率和化学平衡曲线图

1.速率曲线图
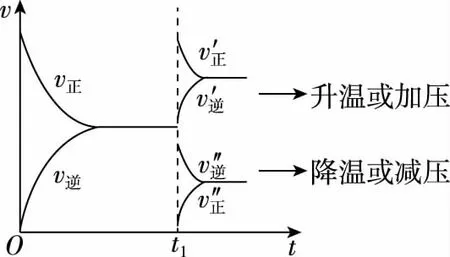
2.转化率、百分含量曲线图(p1
甲

乙
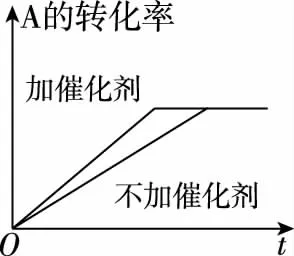
丙

丁
3.几种特殊曲线图

甲
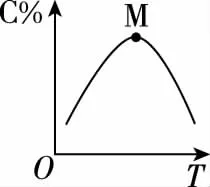
乙

丙
3中图甲、乙,M点前未达平衡,v正>v逆;M点为平衡状态,随温度的升高,A%增大或C%减小,化学平衡向左移动,说明逆反应是吸热反应,则正反应是放热反应,因此,ΔH<0。图丙,L曲线叫作平衡线,L曲线上所有的点都是平衡点;L曲线上方的点(E点)向A%减小的方向移动,即v正>v逆;L曲线下方的点(F点)向A%增大的方向移动,即v逆>v正。

( )

A.该反应的焓变ΔH>0
B.图中Z的大小为a>3>b
D.温度不变时,图中X点对应的平衡在加压后φ(CH4)减小
【答案】A
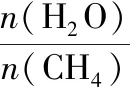
二、水溶液中的离子平衡曲线图
水溶液中的离子平衡曲线图也是近年高考热点题型之一,此种类型的图象可分为以下几类:
1.酸溶液稀释图象
(1)同体积、同浓度的盐酸和醋酸

加水稀释相同的倍数,醋酸的pH大加水稀释到相同的pH,盐酸加入的水多
(2)同体积、同pH的盐酸和醋酸

加水稀释相同的倍数,盐酸的pH大加水稀释到相同的pH,醋酸加入的水多
(3)pH与稀释倍数的线性关系

①HY为强酸、HX为弱酸②a、b两点的溶液中:c(X-)=c(Y-)③水的电离程度:d>c>a=b①MOH为强碱、ROH为弱碱②物质的量浓度:c(ROH)=c(MOH)③水的电离程度:a>b
【例2】常温下,分别取未知浓度的MOH和HA溶液,加水稀释至原体积的n倍。稀释过程中,两溶液pH的变化如图所示。下列叙述正确的是
( )
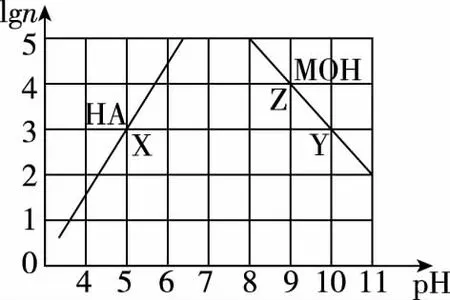
A.MOH为弱碱,HA为强酸
B.水的电离程度:X=Z>Y
C.若升高温度,Y、Z点对应溶液的pH均不变
D.将X点溶液与Z点溶液等体积混合,所得溶液呈碱性
【答案】B

2.KW与Ksp图象
(1)曲线型

不同温度下水溶液中c(H+)与c(OH-)的变化曲线常温下,CaSO4在水中的沉淀溶解平衡曲线[Ksp=9×10-6]①A、C、B三点为中性,温度依次升高,KW依次增大。②D点为酸性溶液,E点为碱性溶液,KW=1×10-14。③AB直线的左上方均为碱性溶液,任意一点:c(H+)Ksp,将会有沉淀生成。③d点在曲线的下方,是不饱和溶液,Qc(2)直线型(pM为阳离子浓度的负对数,pR为阴离子浓度的负对数)
①直线AB上的点:c(M2+)=c(R2-);
②溶度积:CaSO4>CaCO3>MnCO3;
③X点对CaCO3要析出沉淀,对CaSO4是不饱和溶液,能继续溶解CaSO4;

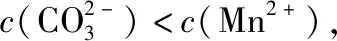
为简明直观地反映水溶液中离子浓度的变化规律,经常通过函数变换将离子浓度及其影响因素间的非线性函数关系转换为线性函数关系,例如对数关系曲线图。解答时首先从函数表达式入手,再由图象中的各点分析,如果函数表达式带有负号,则各点在图象中数值越大,其实际数值越小;如果函数表达式不带有负号,则各点在图象中数值越大,其实际数值越大。

【例3】常温下,向20 mL 0.1 mol/L氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。下列说法正确的是
( )
A.常温下,0.1 mol/L氨水的电离常数K约为1×10-5
D.d点代表两溶液恰好完全反应
【答案】A

3.分布系数图象
分布系数图象中一般都有两条或多条曲线,其代表的是某两种或多种成分的缓冲溶液,随溶液pH的变化,各粒子之间的相互转化,例如CH3COOH和CH3COONa的缓冲溶液,NH3·H2O和NH4Cl的缓冲溶液等。解答时需分析每条曲线所代表的粒子以及曲线上的特殊点,再结合反应原理、“三大守恒”及离子浓度大小关系等进行计算推理。
分布系数图象常以pH为横坐标,以各组分的平衡浓度占总浓度的分数为纵坐标的关系曲线。

一元弱酸(以CH3COOH为例)二元弱酸(以H2C2O4为例)注:PKa为电离常数的负对数δ0为CH3COOH分布系数,δ1为CH3COO-分布系数δ0为H2C2O4分布系数,δ1为HC2O-4分布系数、δ2为C2O2-4分布系数随着溶液pH增大,溶质分子浓度不断减小,离子浓度逐渐增大,酸根离子增多根据分布系数书写在一定pH的条件下,所发生反应的离子方程式同一pH条件下可以存在多种溶质微粒根据在一定pH的微粒分布系数和c(H+),可以计算各成分在该pH时的平衡浓度
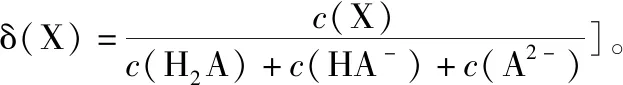
( )

A.pH=1.2时,c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
【答案】D

4.滴定图象
酸碱中和滴定曲线图、沉淀滴定曲线图和氧化还原滴定曲线图等为常考题型。对于酸碱中和滴定曲线图,解题时首先要明确横纵坐标轴所表示的含义,然后结合曲线上的特殊点,联想反应原理和三大守恒(电荷守恒、物料守恒、质子守恒),通过计算推理突破粒子的浓度关系。关键要巧抓“四点”:抓反应“一半”点,判断是什么溶质的等量混合;抓“恰好”反应点,生成什么溶质,溶液呈什么性,是什么因素造成的;抓溶液“中性”点,生成什么溶质,哪种反应物过量或不足;抓反应“过量”点,溶质是什么,判断哪种粒子多、哪种粒子少还是等量。
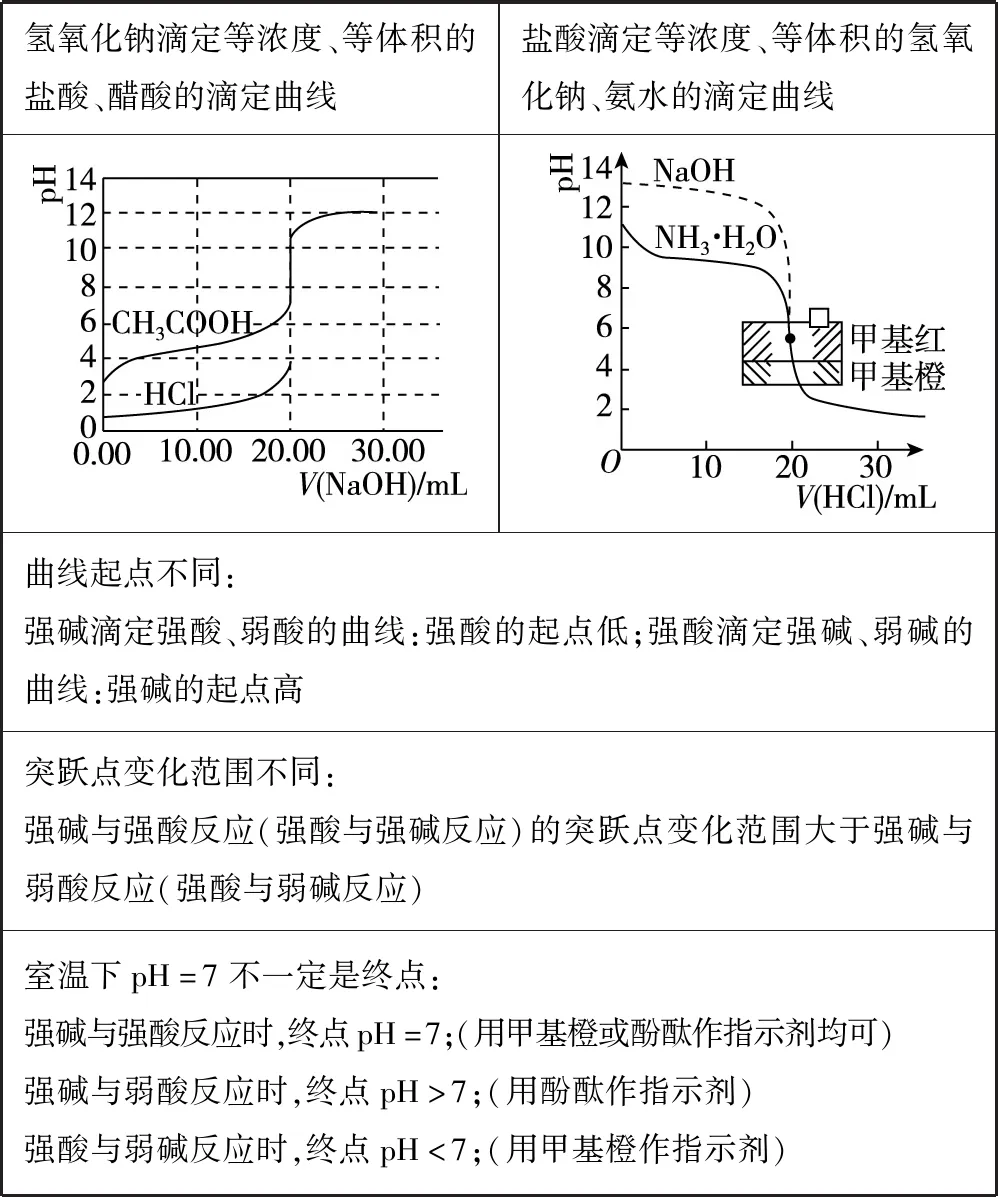
氢氧化钠滴定等浓度、等体积的盐酸、醋酸的滴定曲线盐酸滴定等浓度、等体积的氢氧化钠、氨水的滴定曲线曲线起点不同:强碱滴定强酸、弱酸的曲线:强酸的起点低;强酸滴定强碱、弱碱的曲线:强碱的起点高突跃点变化范围不同:强碱与强酸反应(强酸与强碱反应)的突跃点变化范围大于强碱与弱酸反应(强酸与弱碱反应)室温下pH=7不一定是终点:强碱与强酸反应时,终点pH=7;(用甲基橙或酚酞作指示剂均可)强碱与弱酸反应时,终点pH>7;(用酚酞作指示剂)强酸与弱碱反应时,终点pH<7;(用甲基橙作指示剂)
对于沉淀滴定曲线图,其沉淀滴定的原理与酸碱中和滴定的原理相类似,滴定的理论终点就是恰好反应的点。酸碱中和滴定是酸碱恰好中和,沉淀滴定是恰好沉淀完全。解答时首先确定哪个点是滴定终点,这样就能在判断溶液发生改变时,滴定终点将如何变化。
【例5】(2018·全国卷Ⅲ·12)用0.100 mol·L-1AgNO3滴定50.0 mL 0.050 0 mol·L-1Cl-溶液的滴定曲线如图所示。下列有关描述错误的是
( )
A.根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C.相同实验条件下,若改为0.040 0 mol·L-1Cl-,反应终点c移到a
D.相同实验条件下,若改为0.050 0 mol·L-1Br-,反应终点c向b方向移动

【答案】C
【解析】首先从图象入手,横坐标代表加入AgNO3溶液的体积,纵坐标代表Cl-浓度的负对数。然后通过在曲线上寻找特定数据及其计算来判断沉淀滴定的具体过程。选取横坐标为50 mL的点,此时向50 mL 0.05 mol/L的Cl-溶液中,加入了50 mL 0.1 mol/L的AgNO3溶液,可计算出此时溶液中过量的Ag+浓度为0.025 mol/L(按照Ag+和Cl-的物质的量之比为1∶1沉淀,此时溶液体积变为原来2倍),由图象纵轴负对数值8得到此时c(Cl-)略小于1×10-8mol/L(负对数值偏大,实际数值偏小),则Ksp(AgCl)=c(Ag+)·c(Cl-)≈0.025×10-8=2.5×10-10,所以其数量级为10-10,A正确;由于Ksp(AgCl)极小,所以向溶液滴加AgNO3就会有沉淀析出,溶液一直是AgCl的饱和溶液,即c(Ag+)·c(Cl-)=Ksp(AgCl),B正确;滴定的过程是用AgNO3滴定Cl-,所以滴定的终点应该由原溶液中Cl-的物质的量决定,将50 mL 0.05 mol/L的Cl-溶液改为50 mL 0.04 mol/L的Cl-溶液,此时溶液中的Cl-的物质的量是原来的0.8倍,因此滴定终点需要加入的AgNO3的量也是原来的0.8倍,所以应该由c点的25 mL变为25×0.8=20 mL,而a点对应的是15 mL,C错误;由于卤化银从AgF到AgI的溶解度应该逐渐减小,所以Ksp(AgCl)>Ksp(AgBr),将50 mL 0.05 mol/L的Cl-溶液改为50 mL 0.05 mol/L的Br-溶液,这是将溶液中的Cl-换为等物质的量的Br-,因为Ag+和Cl-或Br-都是1∶1沉淀,而滴定终点的横坐标不变,但因AgBr更难溶,故终点时,Br-的浓度应该比终点时Cl-的浓度更小,因此有可能由c点变为b点,D正确。

猜你喜欢
秦皇岛煤价周曲线图矿山安全信息(2021年21期)2021-07-04 秦皇岛煤价周曲线图矿山安全信息(2020年37期)2020-12-26 化学平衡状态的判断中学生数理化(高中版.高二数学)(2020年2期)2020-04-21 数学方法在化学平衡学习中的重要应用中学生数理化(高中版.高二数学)(2020年2期)2020-04-21 秦皇岛煤价周曲线图矿山安全信息(2020年2期)2020-03-05 秦皇岛煤价周曲线图矿山安全信息(2020年3期)2020-03-04 小题也可大做——由一道化学平衡题想到的中学生数理化(高中版.高考理化)(2019年6期)2019-06-22 立足高考考点着眼化学平衡中学化学(2017年6期)2017-10-16 三思而后行 强酸制弱酸规律的应用与思考理科考试研究·高中(2014年11期)2014-11-26 硝酸计算题的典型错误归纳数理化学习·高一二版(2009年5期)2009-07-31

甲

乙

丙

丁
3.几种特殊曲线图

甲

乙

丙
3中图甲、乙,M点前未达平衡,v正>v逆;M点为平衡状态,随温度的升高,A%增大或C%减小,化学平衡向左移动,说明逆反应是吸热反应,则正反应是放热反应,因此,ΔH<0。图丙,L曲线叫作平衡线,L曲线上所有的点都是平衡点;L曲线上方的点(E点)向A%减小的方向移动,即v正>v逆;L曲线下方的点(F点)向A%增大的方向移动,即v逆>v正。

( )

A.该反应的焓变ΔH>0
B.图中Z的大小为a>3>b
D.温度不变时,图中X点对应的平衡在加压后φ(CH4)减小
【答案】A
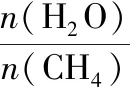
二、水溶液中的离子平衡曲线图
水溶液中的离子平衡曲线图也是近年高考热点题型之一,此种类型的图象可分为以下几类:
1.酸溶液稀释图象
(1)同体积、同浓度的盐酸和醋酸

加水稀释相同的倍数,醋酸的pH大加水稀释到相同的pH,盐酸加入的水多
(2)同体积、同pH的盐酸和醋酸

加水稀释相同的倍数,盐酸的pH大加水稀释到相同的pH,醋酸加入的水多
(3)pH与稀释倍数的线性关系

①HY为强酸、HX为弱酸②a、b两点的溶液中:c(X-)=c(Y-)③水的电离程度:d>c>a=b①MOH为强碱、ROH为弱碱②物质的量浓度:c(ROH)=c(MOH)③水的电离程度:a>b
【例2】常温下,分别取未知浓度的MOH和HA溶液,加水稀释至原体积的n倍。稀释过程中,两溶液pH的变化如图所示。下列叙述正确的是
( )

A.MOH为弱碱,HA为强酸
B.水的电离程度:X=Z>Y
C.若升高温度,Y、Z点对应溶液的pH均不变
D.将X点溶液与Z点溶液等体积混合,所得溶液呈碱性
【答案】B

2.KW与Ksp图象
(1)曲线型

不同温度下水溶液中c(H+)与c(OH-)的变化曲线常温下,CaSO4在水中的沉淀溶解平衡曲线[Ksp=9×10-6]①A、C、B三点为中性,温度依次升高,KW依次增大。②D点为酸性溶液,E点为碱性溶液,KW=1×10-14。③AB直线的左上方均为碱性溶液,任意一点:c(H+) (2)直线型(pM为阳离子浓度的负对数,pR为阴离子浓度的负对数) ①直线AB上的点:c(M2+)=c(R2-); ②溶度积:CaSO4>CaCO3>MnCO3; ③X点对CaCO3要析出沉淀,对CaSO4是不饱和溶液,能继续溶解CaSO4; 为简明直观地反映水溶液中离子浓度的变化规律,经常通过函数变换将离子浓度及其影响因素间的非线性函数关系转换为线性函数关系,例如对数关系曲线图。解答时首先从函数表达式入手,再由图象中的各点分析,如果函数表达式带有负号,则各点在图象中数值越大,其实际数值越小;如果函数表达式不带有负号,则各点在图象中数值越大,其实际数值越大。 【例3】常温下,向20 mL 0.1 mol/L氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。下列说法正确的是 ( ) A.常温下,0.1 mol/L氨水的电离常数K约为1×10-5 D.d点代表两溶液恰好完全反应 【答案】A 分布系数图象中一般都有两条或多条曲线,其代表的是某两种或多种成分的缓冲溶液,随溶液pH的变化,各粒子之间的相互转化,例如CH3COOH和CH3COONa的缓冲溶液,NH3·H2O和NH4Cl的缓冲溶液等。解答时需分析每条曲线所代表的粒子以及曲线上的特殊点,再结合反应原理、“三大守恒”及离子浓度大小关系等进行计算推理。 分布系数图象常以pH为横坐标,以各组分的平衡浓度占总浓度的分数为纵坐标的关系曲线。 一元弱酸(以CH3COOH为例)二元弱酸(以H2C2O4为例)注:PKa为电离常数的负对数δ0为CH3COOH分布系数,δ1为CH3COO-分布系数δ0为H2C2O4分布系数,δ1为HC2O-4分布系数、δ2为C2O2-4分布系数随着溶液pH增大,溶质分子浓度不断减小,离子浓度逐渐增大,酸根离子增多根据分布系数书写在一定pH的条件下,所发生反应的离子方程式同一pH条件下可以存在多种溶质微粒根据在一定pH的微粒分布系数和c(H+),可以计算各成分在该pH时的平衡浓度 ( ) A.pH=1.2时,c(H2A)=c(HA-) B.lg[K2(H2A)]=-4.2 C.pH=2.7时,c(HA-)>c(H2A)=c(A2-) D.pH=4.2时,c(HA-)=c(A2-)=c(H+) 【答案】D 酸碱中和滴定曲线图、沉淀滴定曲线图和氧化还原滴定曲线图等为常考题型。对于酸碱中和滴定曲线图,解题时首先要明确横纵坐标轴所表示的含义,然后结合曲线上的特殊点,联想反应原理和三大守恒(电荷守恒、物料守恒、质子守恒),通过计算推理突破粒子的浓度关系。关键要巧抓“四点”:抓反应“一半”点,判断是什么溶质的等量混合;抓“恰好”反应点,生成什么溶质,溶液呈什么性,是什么因素造成的;抓溶液“中性”点,生成什么溶质,哪种反应物过量或不足;抓反应“过量”点,溶质是什么,判断哪种粒子多、哪种粒子少还是等量。 氢氧化钠滴定等浓度、等体积的盐酸、醋酸的滴定曲线盐酸滴定等浓度、等体积的氢氧化钠、氨水的滴定曲线曲线起点不同:强碱滴定强酸、弱酸的曲线:强酸的起点低;强酸滴定强碱、弱碱的曲线:强碱的起点高突跃点变化范围不同:强碱与强酸反应(强酸与强碱反应)的突跃点变化范围大于强碱与弱酸反应(强酸与弱碱反应)室温下pH=7不一定是终点:强碱与强酸反应时,终点pH=7;(用甲基橙或酚酞作指示剂均可)强碱与弱酸反应时,终点pH>7;(用酚酞作指示剂)强酸与弱碱反应时,终点pH<7;(用甲基橙作指示剂) 对于沉淀滴定曲线图,其沉淀滴定的原理与酸碱中和滴定的原理相类似,滴定的理论终点就是恰好反应的点。酸碱中和滴定是酸碱恰好中和,沉淀滴定是恰好沉淀完全。解答时首先确定哪个点是滴定终点,这样就能在判断溶液发生改变时,滴定终点将如何变化。 【例5】(2018·全国卷Ⅲ·12)用0.100 mol·L-1AgNO3滴定50.0 mL 0.050 0 mol·L-1Cl-溶液的滴定曲线如图所示。下列有关描述错误的是 ( ) A.根据曲线数据计算可知Ksp(AgCl)的数量级为10-10 B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl) C.相同实验条件下,若改为0.040 0 mol·L-1Cl-,反应终点c移到a D.相同实验条件下,若改为0.050 0 mol·L-1Br-,反应终点c向b方向移动 【答案】C 【解析】首先从图象入手,横坐标代表加入AgNO3溶液的体积,纵坐标代表Cl-浓度的负对数。然后通过在曲线上寻找特定数据及其计算来判断沉淀滴定的具体过程。选取横坐标为50 mL的点,此时向50 mL 0.05 mol/L的Cl-溶液中,加入了50 mL 0.1 mol/L的AgNO3溶液,可计算出此时溶液中过量的Ag+浓度为0.025 mol/L(按照Ag+和Cl-的物质的量之比为1∶1沉淀,此时溶液体积变为原来2倍),由图象纵轴负对数值8得到此时c(Cl-)略小于1×10-8mol/L(负对数值偏大,实际数值偏小),则Ksp(AgCl)=c(Ag+)·c(Cl-)≈0.025×10-8=2.5×10-10,所以其数量级为10-10,A正确;由于Ksp(AgCl)极小,所以向溶液滴加AgNO3就会有沉淀析出,溶液一直是AgCl的饱和溶液,即c(Ag+)·c(Cl-)=Ksp(AgCl),B正确;滴定的过程是用AgNO3滴定Cl-,所以滴定的终点应该由原溶液中Cl-的物质的量决定,将50 mL 0.05 mol/L的Cl-溶液改为50 mL 0.04 mol/L的Cl-溶液,此时溶液中的Cl-的物质的量是原来的0.8倍,因此滴定终点需要加入的AgNO3的量也是原来的0.8倍,所以应该由c点的25 mL变为25×0.8=20 mL,而a点对应的是15 mL,C错误;由于卤化银从AgF到AgI的溶解度应该逐渐减小,所以Ksp(AgCl)>Ksp(AgBr),将50 mL 0.05 mol/L的Cl-溶液改为50 mL 0.05 mol/L的Br-溶液,这是将溶液中的Cl-换为等物质的量的Br-,因为Ag+和Cl-或Br-都是1∶1沉淀,而滴定终点的横坐标不变,但因AgBr更难溶,故终点时,Br-的浓度应该比终点时Cl-的浓度更小,因此有可能由c点变为b点,D正确。
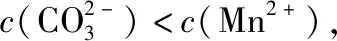



3.分布系数图象

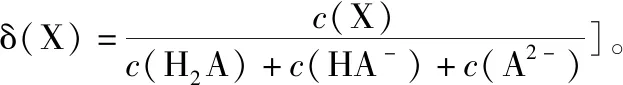


4.滴定图象




