冰片配伍黄芪甲苷与三七总皂苷对脑缺血/再灌注后血脑屏障通透性的影响
丁 煌,唐 三,杨筱倩,刘晓丹,黄小平,邓常清
(湖南中医药大学分子病理实验室,中西医结合心脑疾病防治湖南省重点实验室,细胞生物学与分子技术湖南省高校重点实验室,长沙 410208)
血脑屏障(blood brain barrier,BBB)是介于血液和脑组织间对物质通过具有选择性的动态界面,主要由血管内皮细胞、紧密连接(tight junctions,TJs)、基底膜、周细胞以及星形胶质细胞终足共同构成[1]。TJs是BBB的结构和功能基础,存在于相邻血管内皮细胞之间,主要由闭合蛋白(Claudin)、咬合蛋白(Occludin)和连接黏附分子三种跨膜蛋白组成[2]。它们通过闭锁小带蛋白(zonula cccludens,ZO)与血管内皮细胞骨架相连,并能识别TJs位置及传递各类信号。紧密连接蛋白表达减少会破坏TJs整体性,进而破坏BBB,导致脑水肿和脑损伤[3]。脑缺血后,可导致BBB的破坏,血管壁通透性增加[4]。
黄芪和三七是治疗心脑血管疾病的常用中药,黄芪总苷(astragalosides,AST)是黄芪中的主要药效组分,主要含黄芪甲苷(astragalosides Ⅳ,AST Ⅳ);三七总皂苷(panax notoginseng saponins,PNS)是三七的主要药效组分,主要含人参皂苷Rg1、Rb1和三七皂苷R1等。冰片是小分子脂溶性单萜类化合物,既可促进药物透过BBB,又能维持BBB结构的完整性,并降低其通透性,从而对BBB及脑组织起到保护作用[5]。我们根据中药归经理论,将冰片与AST Ⅳ和PNS配伍后,可促进AST Ⅳ、Rg1、Rb1和R1吸收入脑,增加药物成分在脑组织的富集[6]。由于脑缺血可导致BBB破坏、血管壁通透性增加,而BBB的通透性增加又可以促进药物成分进入脑组织,本研究的主要目的是探讨冰片“引药上行”促进AST Ⅳ与PNS有效成分入脑的作用是否与BBB的破坏和开放有关,对BBB的结构和受损的脑组织又起怎样的作用,从而为冰片配伍AST Ⅳ与PNS抗脑缺血作用的合理应用与开发提供实验依据。
1 材料
1.1 药品与试剂冰片(左旋龙脑,主要成分为1,7-三甲基-二环庚-2-醇,含量86%,购自湖北俊辉有限公司,批号20170815);AST Ⅳ(纯度≥98%,批号MUST-17022804);PNS(纯度≥98%,批号MUST-17060601)、人参皂苷Rg1(纯度≥98%,批号MUST-17030829)、Rb1(纯度≥98%,批号MUST-17022510)和三七皂苷R1(纯度≥98%,批号MUST-17071228)均购自成都曼思特生物科技有限公司,药物用时以0.5%羧甲基纤维素钠配置成相应浓度混悬液。依达拉奉注射液购自南京先声东元制药有限公司生产,批号80-090104,规格每支10 mg(5 mL)。
二甲基砷酸钠(Sigma公司,批号C0250)、戊二醛溶液(上海麦克林生化科技有限公司,批号G810413)、硝酸镧(上海麦克林生化科技有限公司,批号L812372)、Claudin5兔单克隆抗体(英国abcam公司,批号ab131259)、Occludin兔单克隆抗体(英国abcam公司,批号ab167161)、ZO-1兔单克隆抗体(美国proteintech公司,批号21773-1-AP)、ZO-2兔单克隆抗体(美国proteintech公司,批号18900-1-AP)、β-actin兔多克隆抗体(美国ABclonal公司,批号AC026)、 HRP标记的山羊抗鼠二抗(美国proteintech公司,批号SA00001-1)、HRP标记的山羊抗兔二抗(美国proteintech公司,批号SA00001-2),RIPA裂解液(康为世纪生物科技有限公司,批号cw2333s)、ECL化学发光液(北京鼎国昌盛生物科技有限公司,批号GE2301)、蛋白Marker(美国Thermo fisher,批号515683)、BCA试剂盒(北京中杉金桥生物技术有限公司,批号K176810E)。
1.2 动物SPF级♂ Sprague-Dawley(SD)大鼠,体质量(200~250) g,由湖南斯莱克景达实验动物有限公司提供(动物合格证号:No.43004700037715)。饲养于湖南中医药大学动物实验中心(场地许可证号:SKY(湘)2013-0005)。实验前适应性喂养(5~7) d,给药前禁食12 h,自由饮水。
1.3 仪器透射电镜(日本,日立HT7700),高速冷冻离心机(YINGTAI,TGL20),酶标仪(美国,ELX800),电泳仪(美国Bio-Rad公司,041BR132283),蛋白转膜槽(美国Bio-Rad公司),化学发光凝胶成像仪(美国Bio-Rad公司,ChemiDoC XRS+)。
2 方法
2.1 大鼠大脑中动脉阻塞(middle cerebral artery occlusion, MCAO)再灌注模型制作采用前期方法[7]制作MCAO局灶性脑缺血模型,阻断2 h后,拔出线栓进行再灌注22 h。
2.2 给药、取材根据我们前期实验结果[8],将动物随机分为:假手术组、模型组、单用冰片(15 mg·kg-1)组、单用AST Ⅳ(20 mg·kg-1)组、单用PNS(50 mg·kg-1)组、AST Ⅳ(20 mg·kg-1)+PNS(50 mg·kg-1)组、冰片(15 mg·kg-1)+AST Ⅳ(20 mg·kg-1)+PNS(50 mg·kg-1)组及依达拉奉4 mg·kg-1组,每组5只大鼠。各中药组于造模前2 d开始灌胃,每天两次,两次给药间隔12 h。依达拉奉组进行腹腔注射,每天1次。假手术组及模型组灌胃等量0.5%羧甲基纤维素钠。于给药d 3灌胃1 h后行缺血2 h,再灌注22 h,术后继续同前给药,再灌注结束后处死动物,做相应指标检测。
2.3 神经功能评分大鼠再灌注22 h后,取材前按前法[7]进行神经功能评分。评分越高,表明神经功能损伤越严重。
2.4 血脑屏障通透性检测(镧示踪电镜)
2.4.1取材 再灌注结束后取材。腹腔注射10%水合氯醛(0.35 mL·kg-1)麻醉大鼠,暴露心脏剪开右心耳,将灌注用针从心尖插入左心室,注入生理盐水,至动物出现肝脏、肺变白及右心房流出澄清液体后,灌注镧醛固定液200 mL(4.28 g二甲基砷酸钠,溶于40.8 mL的0.2 mol·L-1盐酸,定容至400 mL,配成二甲基砷酸钠溶液;再称取20 g多聚甲醛,溶解于60 ℃ 500 mL超纯水,倒入20 mL 50%戊二醛溶液及80 mL二甲基砷酸钠溶液,调pH值至7.4,加入20 g硝酸镧,定容至1 L即得)至动物全身僵硬,断头取患侧大脑置镧醛固定液中保存。
2.4.2镧电镜检测 取固定后的右脑切至1×1×3 mm3,用0.1 mol·L-1磷酸漂洗液漂洗3次,每次10~15 min,1%锇酸固定液固定1~2 h,0.1 M磷酸漂洗液漂洗3次每次10~15 min后,脱水处理:50%丙酮10~15 min,70%丙酮10~15 min,90%丙酮10~15 min,100%丙酮15~20 min,纯丙酮+包埋液(1 ∶1)37 ℃12 h,纯包埋液37 ℃ 10~12 h,37 ℃烘箱内过夜。再将脑组织60 ℃烘烤12~24 h,超薄切片至50~100 nm,3%醋酸铀以及硝酸铅双染,置于日立HT7700透射电镜观察、拍片。镧颗粒为重金属,不易通过BBB,当BBB完整性破坏时,镧从毛细血管漏出,且被示踪在脑毛细血管的周围组织,故可用镧示踪法评价BBB完整性。
2.5 脑含水量测定(干湿重法)断头取脑,去除嗅球、小脑和低位脑干等部位,分离双侧大脑半球,立即置电子天平测定脑组织湿重[室温(20~25)℃,湿度60%~75%],然后将脑组织于80 ℃烤2 d以上至恒重,测定脑组织干重(两次测定值之差小于0.2 mg)。脑含水量/%=(湿重-干重)/湿重×100%[9]。
2.6 脑组织ZO-1、ZO-2、Claudin5、Occludin蛋白的定位及定量检测(免疫组织化学染色法)取患侧视交叉后2~6 mm脑组织,冠状切开,迅速置于4%多聚甲醛溶液固定。石蜡包埋后切片,片厚4 μm。进行免疫组化染色测定,ZO-1单克隆抗体、ZO-2单克隆抗体、Claudin5单克隆抗体及Occludin单克隆抗体分别作1 ∶500稀释。每张切片在显微镜(10×40)下随机选取皮质区5个有毛细血管的视野,观察ZO-1、ZO-2、Claudin5、Occludin蛋白沿毛细血管分布情况,棕色颗粒即为阳性表达。Image pro-plus软件测定每个视野下每个血管壁上棕色颗粒的光密度(optical density,OD)值,计算平均值,代表相应蛋白表达量。
2.7 脑组织ZO-1、ZO-2、Occludin、Claudin5蛋白表达(Western blot法)取患侧视交叉后2~6 mm脑组织50 mg,加入1 mL预冷的RIPA,冰上匀浆,静置20 min后12 000 r·min-14 ℃离心10 min,取上清,BCA试剂盒测定总蛋白含量。每个样本取80 μg蛋白,100℃水浴10 min变性,110 V恒压电泳90 min,200 mA转膜2 h,5%脱脂牛奶封闭1 h,再分别与ZO-1抗体(1 ∶500)、ZO-2抗体(1 ∶500)、Claudin5抗体(1 ∶5 000)、Occludin抗体(1 ∶10 000)、β-actin抗体(1 ∶8 000)孵育,4 ℃静置过夜,TBST洗3次,每次10 min;然后分别加羊抗兔二抗(1 ∶5 000)或羊抗小鼠二抗(1 ∶8 000),于37 ℃孵育1 h或常温水平摇床上孵育2 h后,TBST洗膜3次,每次10 min,加ECL化学发光剂于凝胶成像仪中显影。用Image Lab图像分析软件测定目的条带的积分光密度值(integral optical density,IOD),以目的条带的IOD值与β-actin条带IOD值的比值作为该目的蛋白相对表达量。

3 结果
3.1 各组神经功能评分比较假手术组大鼠无神经缺损症状。与假手术组比较,模型组神经功能评分明显升高(P<0.01)。与模型组比较,各药物组神经功能评分明显降低(P<0.05或P<0.01),且冰片+AST Ⅳ+PNS组的效应强于各药物单用组及AST Ⅳ+PNS组(P<0.05或P<0.01)(见Fig 1)。
3.2 各组脑含水量的比较模型组脑组织含水量明显高于假手术组(P<0.01)。与模型组比较,各药物组脑含水量明显降低(P<0.05或P<0.01),且AST Ⅳ+PNS组明显低于AST Ⅳ单用组及PNS单用组(均P<0.05),冰片+AST Ⅳ+PNS组明显低于各药物单用组及AST Ⅳ+PNS组(P<0.05或P<0.01)(Fig 2)。
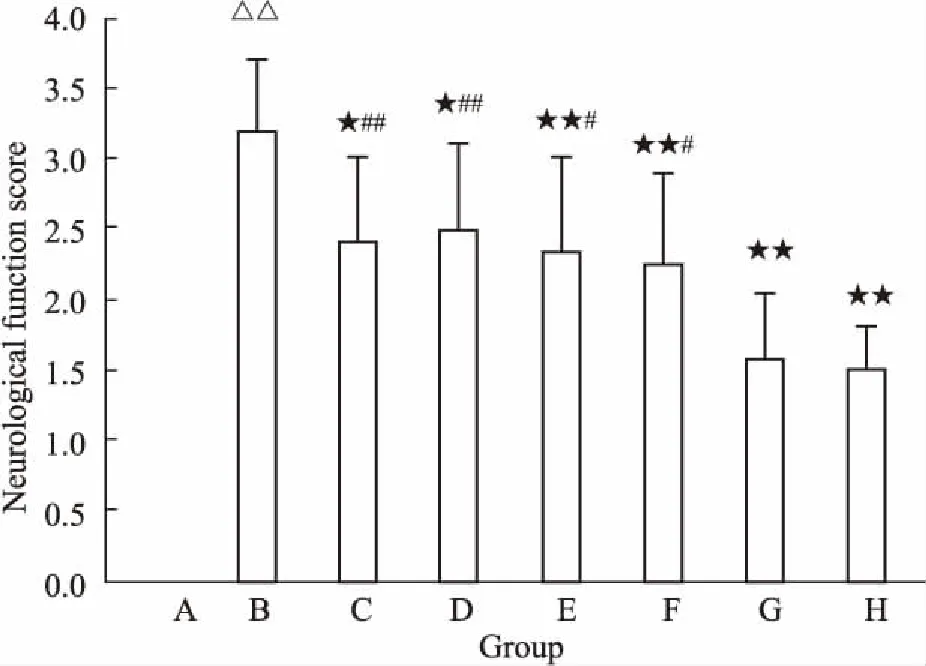
Fig 1 Comparison of neurologic function score
A: Sham; B: Model; C: Borneol; D: AST Ⅳ; E: PNS; F: AST Ⅳ+PNS; G: Borneol+AST Ⅳ+PNS; H: Edaravone.△△P<0.01vssham;★P<0.05,★★P<0.01vsmodel;#P<0.05,##P<0.01vsborneol +AST Ⅳ+PNS

Fig 2 Comparison of brain water content among each group , n=5)
A: Sham; B: Model; C: Borneol; D: AST Ⅳ; E: PNS; F: AST Ⅳ+PNS; G: Borneol+AST Ⅳ+PNS; H: Edaravone.△△P<0.01vssham;★P<0.05,★★P<0.01vsmodel;●P<0.05,vsAST Ⅳ+PNS;#P<0.05,##P<0.01vsborneol +AST Ⅳ+PNS
3.3 各组BBB通透性的变化假手术组高密度的镧颗粒仅附着在毛细血管内壁表面,呈连续线性分布,毛细血管内皮细胞间紧密连接、基底膜及毛细血管外均未见镧颗粒沉积,脑组织形态结构正常。在模型组,镧颗粒弥漫分布在基底膜、脑组织细胞间及细胞内,BBB破坏严重,通透性增加,脑组织高度水肿,内皮细胞及周围神经细胞失去正常形态和结构。在冰片组和AST Ⅳ、PNS单用组,镧颗粒在脑组织中的分布有所减少,脑组织水肿有所减轻。在AST Ⅳ+PNS组,水肿明显减轻,BBB紧密连接呈部分开放,镧颗粒大部分分布在毛细血管内表面,少部分穿过毛细血管壁进入基底膜,神经细胞内未见明显镧颗粒浸润。在冰片+AST Ⅳ+PNS组以及阳性对照依达拉奉组,镧颗粒在毛细血管内壁呈线性排列,脑组织无明显水肿,脑实质未见镧颗粒浸润,周细胞、各细胞器形态结构基本正常(Fig 3)。
3.4 各组微血管内皮细胞ZO-1、ZO-2、Occludin及Claudin5蛋白分布表达的比较(免疫组化法)Fig 4~6和Tab 1显示,ZO-1、ZO-2和Occludin蛋白在假手术组微血管内皮细胞上分布较多;脑缺血/再灌注后,各蛋白的分布及含量均明显低于假手术组(均P<0.01)。与模型组比较,冰片、PNS及AST Ⅳ+PNS组ZO-1和Occludin蛋白表达明显增多(P<0.05或P<0.01),AST Ⅳ组ZO-1表达增加(P<0.05),且AST Ⅳ+PNS升高ZO-1的效应明显强于AST Ⅳ、PNS单用(P<0.05或P<0.01)。冰片+AST Ⅳ+PNS及依达拉奉组ZO-1、ZO-2及Occludin蛋白表达明显增加(P<0.05或P<0.01),且冰片+AST Ⅳ+PNS增加ZO-1、ZO-2及Occludin蛋白的效应明显强于各药物单用及AST Ⅳ+PNS(P<0.05或P<0.01)。
3.5 各组脑组织ZO-1、ZO-2、Occludin及Claudin-5蛋白表达的比较(Western-blot法)Fig 7和Tab 2结果显示,脑缺血/再灌注后,ZO-1、ZO-2、Occludin、Claudin-5蛋白表达明显下调(均P<0.01)。与模型组比较,AST Ⅳ组ZO-1蛋白表达增加(P<0.05),冰片组与PNS组ZO-1、Occludin蛋白表达增加(P<0.05或P<0.01),AST Ⅳ+PNS组、冰片+AST Ⅳ+PNS组及依达拉奉组ZO-1、ZO-2及Occludin蛋白表达增加(P<0.05或P<0.01)。且AST Ⅳ+PNS组上调ZO-1、Occludin蛋白表达的效应明显强于AST Ⅳ、PNS单用组(P<0.05或P<0.01),冰片+AST Ⅳ+PNS组上调ZO-1、ZO-2及Occludin蛋白表达的效应明显强于各药物单用组及AST Ⅳ+PNS组(P<0.05或P<0.01)。各药物对Claudin-5蛋白表达的下调无明显效应(P>0.05)。

Tab 1 Comparison of expressions of tight junction proteins such as ZO-1, ZO-2, Occludin in microvascular endothelial cells among each group , n=5)
△△P<0.01vssham;★P<0.05,★★P<0.01vsmodel;●P<0.05,●●P<0.01vsAST Ⅳ+PNS;#P<0.05,##P<0.01vsborneol +AST Ⅳ+PNS
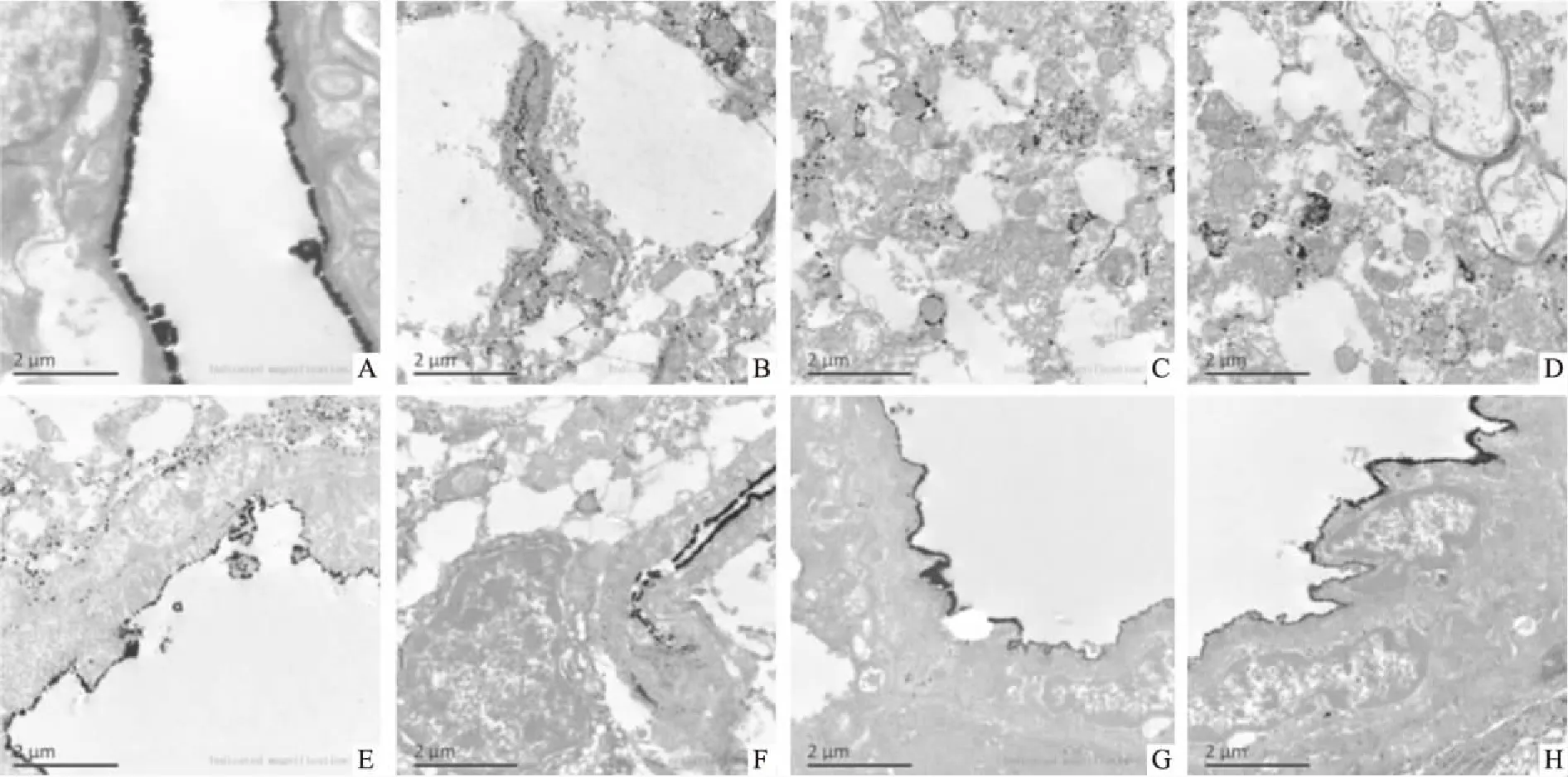
Fig 3 Comparison of BBB permeability among each group (×15 000, bar=2 μm)
A:Sham;B:Model;C:Borneol;D:AST Ⅳ;E:PNS;F:AST Ⅳ+PNS;G:Borneol+AST Ⅳ+PNS;H:Edaravone
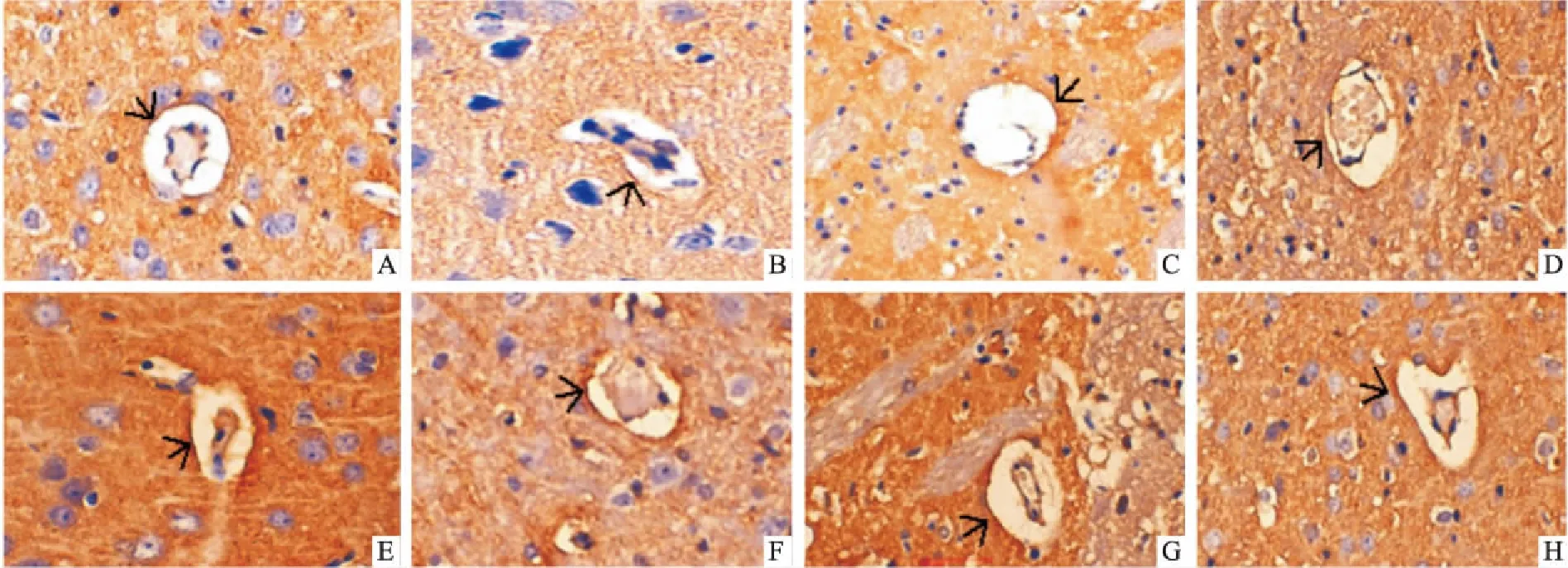
Fig 4 Immunohistochemistry pattern of ZO-1 protein in each group (×400)
The arrow indicates the positive expression of ZO-1 protein on the vascular wall. A:Sham;B:Model;C:Borneol;D:AST Ⅳ;E:PNS;F:AST Ⅳ+PNS;G:Borneol+AST Ⅳ+PNS;H:Edaravone
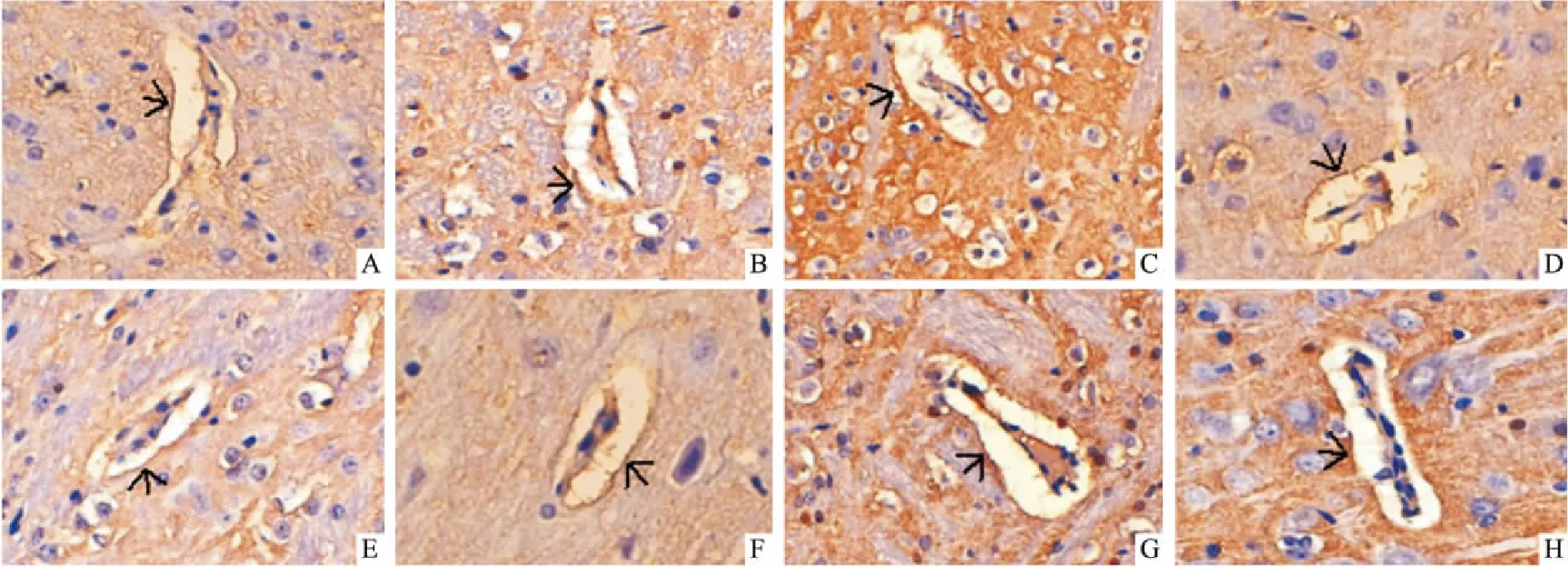
Fig 5 Immunohistochemistry pattern of ZO-2 protein in each group(×400)
The arrow indicates the positive expression of ZO-2 protein on the vascular wall. A:Sham;B:Model;C:Borneol;D:AST Ⅳ;E:PNS;F:AST Ⅳ+PNS;G:Borneol+AST Ⅳ+PNS;H:Edaravone

Fig 6 Immunohistochemistry pattern of Occludin protein in each group(×400)
The arrow indicates the positive expression of Occludin protein on the vascular wall. A:Sham;B:Model;C:Borneol;D:AST Ⅳ;E:PNS;F:AST Ⅳ+PNS;G:Borneol+AST Ⅳ+PNS;H:Edaravone

Tab 2 Comparison of expressions of ZO-1, ZO-2, Occludin and Claudin-5 proteins in rat brain tissues of each group , n=5)
△P<0.05,△△P<0.01vssham;★P<0.05,★★P<0.01vsmodel;●P<0.05,●●P<0.01vsAST Ⅳ+PNS;#P<0.05,##P<0.01vsborneol +AST Ⅳ+PNS
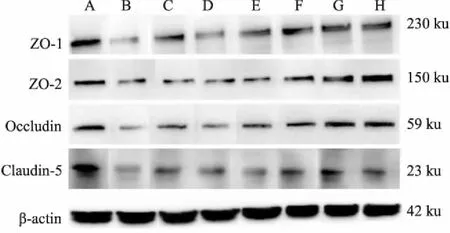
Fig 7 Western blot pattern of ZO-1, ZO-2, Occludin proteins in rat brain tissues of each group
4 讨论
BBB的屏障特性主要取决于毛细血管内皮细胞和细胞间紧密连接(TJs)结构和功能的完整性[10]。紧密连接蛋白由多种蛋白组成,主要包括胞浆黏附蛋白(ZO)家族、跨膜蛋白和细胞骨架蛋白,跨膜蛋白又包括咬合蛋白(Occludin)、闭合蛋白(Claudin)和连接黏附分子[2]。ZO-1是一种细胞质附着蛋白,位于紧密连接内皮细胞的胞质面。作为紧密连接复合体的重要组成单元,ZO-1、Occludin和Claudin 蛋白连同肌动蛋白一起,将跨膜蛋白锚定在形成细胞骨架的内皮细胞上[11]。ZO-1表达水平与BBB开放与关闭状态密切相关,其功能和结构的改变可导致TJs解离,继而引起细胞间隙和血管通透性增加[12],ZO-1表达下调常提示BBB完整性受损,可作为BBB破坏的标志。ZO-2与ZO-1以复合物的方式定位于TJs的胞质侧,共同参与组成调节基因表达和细胞功能的信号传导通路[13]。 Occludin和Claudin-5是调节BBB通透性的两种重要跨膜蛋白[14],在脑微血管内皮上高度表达,Claudin-5、Occludin蛋白表达下降可作为BBB损伤的标志[15]。
本研究结果显示,脑缺血/再灌注后,神经功能评分和脑组织含水量明显增加。各药物组能明显降低神经功能评分和脑含水量,以冰片+AST Ⅳ+PNS组与依达拉奉组的效应最强,且冰片+AST Ⅳ+PNS组的效应强于各药物单用及AST Ⅳ+PNS组。说明冰片与AST Ⅳ、PNS配伍能更好地缓解脑缺血后神经功能缺损症状和脑水肿。
镧示踪电镜结果显示,在正常脑组织,硝酸镧颗粒未渗透至毛细血管管腔外,紧密连接和BBB通透性正常。脑缺血/再灌注后,毛细血管内大量镧颗粒漏出,分布在基底膜、脑组织细胞间隙及细胞内,脑组织水肿明显,表明缺血导致紧密连接及BBB破坏,血管通透性增加,导致脑水肿和脑组织损伤。各药物组均能减轻上述病理改变,尤以冰片+AST Ⅳ+PNS组及阳性对照依达拉奉组作用更明显。说明冰片、AST Ⅳ、PNS能够降低脑缺血/再灌后BBB破坏和毛细血管通透性,减轻脑水肿和脑组织损伤,且三药合用后作用增强。同时也说明冰片促进AST Ⅳ及PNS有效成分进入脑组织的作用并非是通过增强BBB通透性、开放BBB来实现的。
ZO-1、ZO-2、Occludin、Claudin-5检测结果表明,这4种蛋白在正常大鼠毛细血管壁上均有表达,脑缺血/再灌注后,其表达均明显减少,表明紧密连接蛋白表达降低是引起脑缺血/再灌注后BBB通透性增加的重要原因。各药物可明显抑制ZO-1蛋白表达的降低;除AST Ⅳ外,各药能明显上调Occludin蛋白表达;冰片+AST Ⅳ+PNS和依达拉奉还能明显上调ZO-2蛋白表达。且冰片+AST Ⅳ+PNS上调ZO-1、ZO-2、Occludin的效应强于各药物单用及AST Ⅳ+PNS。说明各药物对脑缺血后ZO-1、ZO-2、Occludin表达均有促进作用,三种药物配伍的效应比药物单用和AST Ⅳ+PNS更加明显,这对于更好地维持脑缺血后紧密连接的稳定性和BBB的通透性具有重要的意义。
综上所述,脑缺血/再灌注后,大鼠BBB破坏、毛细血管通透性增加,出现脑水肿和脑组织损伤。冰片、AST Ⅳ和PNS能不同程度降低BBB通透性,减轻脑水肿和脑组织损伤,三种药物合用能起到增效作用。说明冰片与AST Ⅳ、PNS联用,其“引药上行”促进AST Ⅳ及PNS有效成分入脑的作用不但不是通过开放BBB来实现,而且还可降低脑缺血/再灌注后BBB的通透性、减轻脑水肿,增强AST Ⅳ及PNS抗缺血性脑损伤的作用,该作用可能与协同抑制脑缺血/再灌注后紧密连接蛋白ZO-1、ZO-2、Occludin蛋白表达的下调有关。