高效液相体积排阻色谱法测定口蹄疫灭活疫苗146S抗原含量及疫苗质量评估
朱元源,徐嫄,邹兴启,杨延丽,刘丽丽,万建青,李翠,徐璐,张乾义,夏应菊,王兆,郎洪武,王琴,张松平,赵启祖
高效液相体积排阻色谱法测定口蹄疫灭活疫苗146S抗原含量及疫苗质量评估
朱元源1,徐嫄1,邹兴启1,杨延丽2,刘丽丽2,万建青1,李翠1,徐璐1,张乾义1,夏应菊1,王兆1,郎洪武1,王琴1,张松平2,赵启祖1
(1中国兽医药品监察所,北京 100081;2中国科学院过程工程研究所/生化工程国家重点实验室,北京 100190)
口蹄疫疫苗质量评价方法对疫苗生产企业和监管部门进行质量控制尤为重要,146S抗原含量是评价口蹄疫疫苗质量的关键指标。蔗糖密度梯度离心法(sucrose density gradient centrifugation,SDGC)是公认经典的测定口蹄疫146S抗原含量的方法,但存在检测耗时长、过程复杂、重复性差等缺点,影响了疫苗的质量监测。口蹄疫灭活疫苗146S抗原含量高效液相体积排阻色谱法(size-exclusion high-performance liquid chromatography, SE-HPLC)是一种简便、快速、自动化程度高、高效的测定方法。【】在初步建立的采用SE-HPLC测定口蹄疫灭活疫苗146S抗原含量方法的基础上,针对不同类型、不同浓缩纯化生产工艺制备的口蹄疫灭活疫苗,进一步确认SE-HPLC法在检测过程中的普适性势在必行。利用口蹄疫146S抗原标准品建立SE-HPLC法标准曲线,求得回归方程,用于检测样品的146S含量。采用SE-HPLC法和SDGC法分别检测146S抗原标准品1倍、2倍、4倍、8倍、16倍稀释的5个样品和市场上随机选取的22批疫苗, 计算146S抗原含量,对比分析两种方法的相关性。用SE-HPLC法,3次重复检测不同企业生产的134批口蹄疫灭活疫苗146S抗原含量,通过色谱图特异性、检测值相对标准偏差(relative standard deviation ,RSD)分析SE-HPLC法的重复性,评价该方法的适用性,分析市场流通疫苗的总体质量情况。SE-HPLC法建立的标准曲线,峰面积与146S抗原含量的线性关系良好(2=0.9981,=8)。口蹄疫146S抗原标准品5个稀释样品和22批口蹄疫疫苗的146S抗原含量检测结果表明,口蹄疫146S抗原含量检测SDGC法和SE-HPLC法高度正相关(R2=0.9994,S=5;R2= 0.9602,v=22)。134批口蹄疫灭活疫苗中,146S抗原含量相对标准偏差5%的疫苗批次分别占疫苗总批次(134批)、单价苗总批次(18批)、双组分及双价苗总批次(76批)、三价苗总批次(40批)的81.34%、72.22%、85.53%、80.00%;146S抗原含量相对标准偏差≤10%的疫苗批次占疫苗总批次(134批)的97.76%。口蹄疫146S抗原含量SE-HPLC法检测重复性良好,其中疫苗146S抗原含量2—4µg·mL-1时,检测重复性最好。所有批次疫苗均检测到目的峰,目的峰的平均起峰、最高峰、落峰时间分别为SE-HPLC法进样后的11.58、12.90、14.93min,平均持续3.36min。134批口蹄疫灭活疫苗146S抗原含量为1.11—80.36µg·mL-1,其中单价苗、双价苗、双组分苗、三价苗146S抗原含量均值分别为2.07、2.40、2.85、13.14 µg·mL-1。口蹄疫灭活疫苗146S 抗原含量SE-HPLC法适用性好、重复性高、高效、快速、简便,能够用于检测不同类型的口蹄疫灭活疫苗,从而进行疫苗的质量监测和评估。市场流通的口蹄疫灭活疫苗146S含量较高,疫苗质量较好。
高效液相体积排阻色谱法;口蹄疫灭活疫苗;146S;疫苗质量
0 引言
【研究意义】随着我国口蹄疫疫苗悬浮培养生产工艺的普及、浓缩纯化技术的提高,以及疫苗质量新标准的颁布,制造优质、高效口蹄疫疫苗已成为大势所趋。国内口蹄疫疫苗生产企业制备工艺不同,疫苗质量良莠不齐,缺乏稳定、可靠的疫苗质量评价方法是主要原因之一,口蹄疫疫苗质量的评价方法对生产企业、养殖户以及疫苗监管部门都具有重要意义。【前人研究进展】动物攻毒试验是目前评价口蹄疫疫苗质量的最重要的方法之一[1-4]。但该方法存在检测周期长、成本高昂、阴性动物难以获得等缺点,难以用于疫苗质量控制。因为口蹄疫病毒完整病毒粒子146S具有最强的免疫原性,是影响疫苗免疫效果的关键要素[5-6],所以146S抗原含量的检测是体外评价疫苗质量的关键,是国际口蹄疫疫苗库储备抗原的重要指标,也是大型疫苗生产企业除疫苗种毒免疫原性、内毒素含量、杂质蛋白含量外最受关注的指标。蔗糖密度梯度离心法[7-9]是目前公认传统经典的检测口蹄疫146S抗原含量的方法,但该方法检测过程复杂、不同单位检测重复性差,且耗时、耗力,从而制约了技术的推广。近十余年来,中国兽医药品监察所探索了不同的方法和策略评估口蹄疫疫苗质量,包括免疫印迹,单抗夹心ELISA,超速离心、蔗糖密度梯度离心等方法,均不能满足口蹄疫146S抗原含量检测特异性、重复性、普适性等要求。为了解决口蹄疫146S定量检测存在的问题,国内外学者开发了其它定量测定口蹄疫病毒粒子的方法。有研究者通过制备级体积排阻色谱将口蹄疫疫苗中的146S与其它杂质分离,采用紫外检测器检测其特征吸收峰,并经过对比,证明体积排阻色谱检测结果与蔗糖密度梯度离心具有一致性[10]。在此基础上又发展出采用高效体积排阻色谱法测定146S抗原含量的技术,通过高效液相色谱系统及分析色谱柱可进行自动化、高通量、高灵敏度的测定[11]。经过中国兽医药品监察所的研究,该方法已初步应用于市售口蹄疫灭活疫苗146S抗原含量的定量测定[12-13]。鉴于口蹄疫灭活疫苗生产工艺复杂,抗原或疫苗破乳水相中残存的宿主细胞DNA等干扰物容易干扰SE-HPLC法目的峰的特异出现。可通过在抗原色谱分离前应用核酸内切酶进行酶切处理,从而排除干扰,准确测定[10-11],拓宽该方法的适用性。但该方法对大规模疫苗样本的检测应用效果未知,是否适用于国内不同企业生产的不同类型疫苗的检测也未知。【本研究切入点】利用SE-HPLC法和SDGC法分别检测口蹄疫146S抗原标准品1、2、4、8、16倍稀释的5个样品和市场上随机选取的22批疫苗, 计算146S抗原含量,对比分析两种方法的相关性。采用改进的SE-HPLC法,3次重复检测不同企业生产的134批口蹄疫灭活疫苗146S抗原含量,验证该方法的重复性、普适性、特异性,并初步评价市售疫苗的质量。【拟解决的关键问题】本研究进一步验证了口蹄疫146S抗原含量SE-HPLC法与蔗糖密度梯度离心法的高度相关性,制订了国内口蹄疫灭活疫苗146S抗原含量SE-HPLC法测定的操作规程,为使用该方法进行检测的操作人员及数据统计分析人员提供具体的技术指标及参数,推动了该方法在全国范围的普及和应用,为快速、高效、便捷的进行口蹄疫灭活疫苗制备全过程监管提供了技术策略,为开展口蹄疫灭活疫苗质量评估提供路径。
1 材料与方法
本试验于2018年4月至2019年4月在中国兽医药品监察所标准物质研究室完成。
1.1 疫苗、有机试剂及酶
疫苗:口蹄疫灭活疫苗134批,包括单价苗18批,双价苗及猪双组分苗76批,三价苗40批。A型、Asia1型、O型PD50均大于10.05。有机试剂:正戊醇(北京化工公司)。酶:核酸酶Benzonase Nuclease(Novagen公司)。
1.2 色谱柱、色谱仪及色谱条件
色谱柱:基质为亲水修饰的硅胶基质高效液相体积排阻色谱柱,孔径45—50nm,TSKgel G4000SWXL (7.8 mm×30 cm)(TOSOH公司);保护柱:TSKgel guard column SWXL(6.0 mm×4 cm)(TOSOH公司)。色谱仪:高效液相色谱仪L-2000 型(Hitachi 公司);流动相:pH 7.2—7.4的50 mmol·L-1磷酸缓冲液,含 0.1 mol·L-1Na2SO4,0.2μm滤膜过滤脱气处理。色谱条件:高效液相色谱仪配备的紫外检测器检测波长:259nm,流速:0.6mL·min-1,进样量:100μL,采集时间:30min。
1.3 标准曲线的制备
用pH 7.2—7.4的50 mmol·L-1磷酸缓冲液将浓度为60 μg·mL-1146S抗原标准品进行系列稀释,HPLC进样检测。采用系统自动积分146S在259 nm下的峰面积,以峰面积为横坐标,相应146S浓度为纵坐标,在EXCEL程序中绘制线性趋势线作为标准曲线,线性回归方程应达到2>0.990。
1.4 疫苗破乳
分别吸取疫苗1 350 μL与正戊醇150 μL,至同一2 mL离心管中,充分振荡使其破乳。4℃静置1 h后3 000 r/min,4℃,离心10min,用注射器缓慢插入底部吸取底层水相,转移至新的离心管中,再3 000 r/min,4℃,离心10min,用注射器缓慢吸取下层清亮水相抗原200μL。
1.5 抗原水相处理
加入Benzonase酶 0.5μL,室温下200r/min振荡反应1h后,3 000 r/min,4℃,离心10min,吸取150μL透明水相至色谱瓶,按照HPLC色谱条件HPLC进样检测。
1.6 146S含量的计算
HPLC法检测过程中,检测样品色谱图中146S特征峰保留时间在11—16min。对259 nm下的146S峰面积积分,得检测样品146S峰面积,将峰面积代入标准曲线,即得146S在每mL破乳水相中的浓度。由于疫苗制备是根据佐剂ISA 206与水相抗原质量比1:1进行乳化,根据二者密度计算,应将测定结果乘以体积系数0.46,即得每mL油佐剂灭活疫苗中146S浓度(µg·mL-1)。
1.7 相对标准偏差(relative standard deviation,RSD)分析
每批疫苗样品的146S抗原含量,采用SE-HPLC法进行3次重复检测,计算相对标准偏差(RSD)。
1.8 蔗糖密度梯度离心法(sucrose density gradient centrifugation,SDGC)
制备 15%—45%均匀线性蔗糖梯度,将破乳水相进行蔗糖密度梯度超速离心,利用紫外分光光度计检测OD259nm值,根据公式计算 146S的含量[7]。
1.9 高效液相体积排阻色谱法与经典方法蔗糖密度梯度离心法比对
将口蹄疫146S抗原标准品用磷酸缓冲液做1、2、4、8、16倍稀释,对稀释后的146S抗原标准品分别用146S抗原含量SE-HPLC法与SDGC法检测。随机选取22批疫苗,进行146S抗原含量 HPLC法和SDGC法检测。根据146S抗原含量检测结果,通过统计学分析,验证146S抗原含量SE-HPLC法与SDGC法检测的相关性、有效性和可行性。
2 结果
2.1 标准曲线及标准色谱峰
将146S 抗原标准品系列稀释样品的色谱峰面积与浓度进行线性回归处理,得到146S的回归方程为:=64409- 80431,2=0.998,具有良好的线性关系(图1)。146S抗原标准品在高效液相色谱仪中显示出特征性色谱峰,146S 抗原出峰时间为11—16min,最高峰的保留时间为12.947min(图2、3)。
2.2 口蹄疫灭活疫苗146S抗原含量SE-HPLC法与SDGC的检测比对
2.2.1 口蹄疫146S抗原标准品两种方法的比对 将口蹄疫146S抗原标准品用磷酸缓冲液做1、2、4、8、16倍稀释,对稀释后的146S抗原标准品分别用SE-HPLC法与SDGC法检测(表1)。
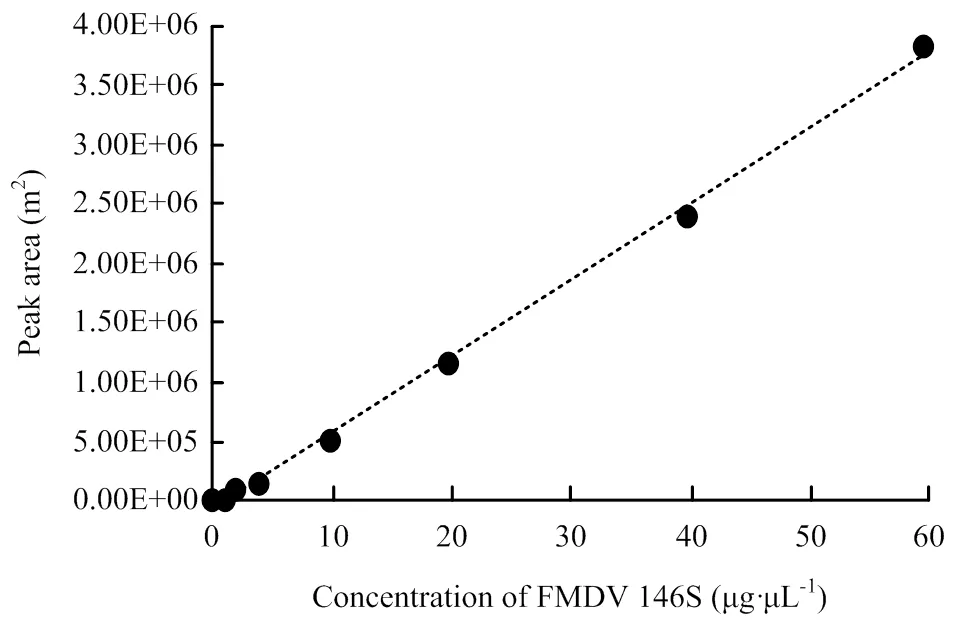
图1 口蹄疫灭活疫苗146S抗原定量分析标准曲线
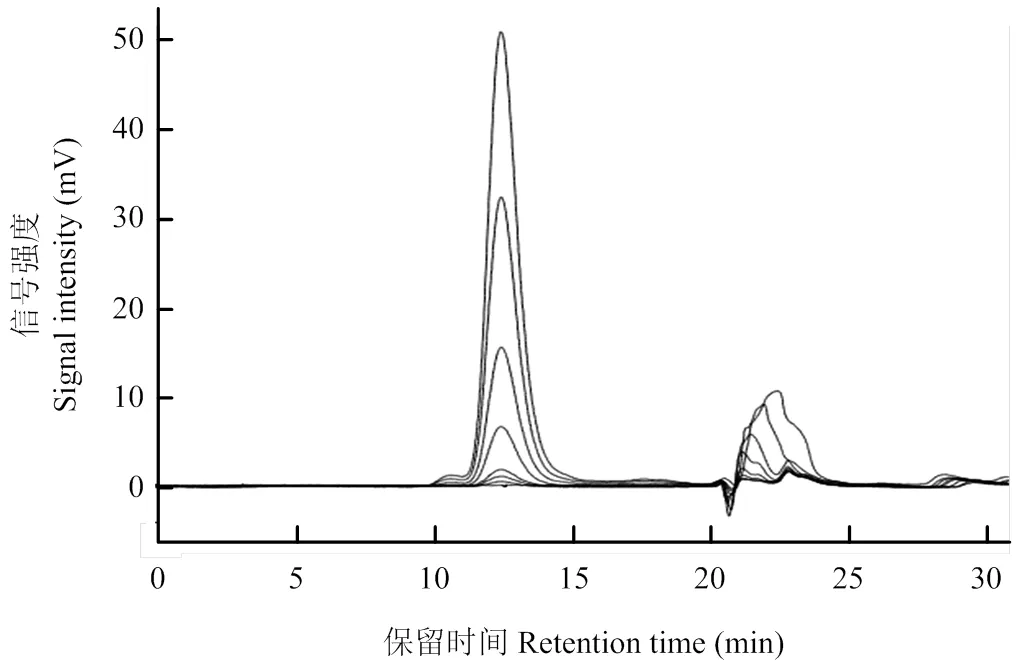
图2 口蹄疫146S抗原标准品检测色谱图

表1 口蹄疫146S抗原标准品SE-HPLC法与SDGC法检测比对
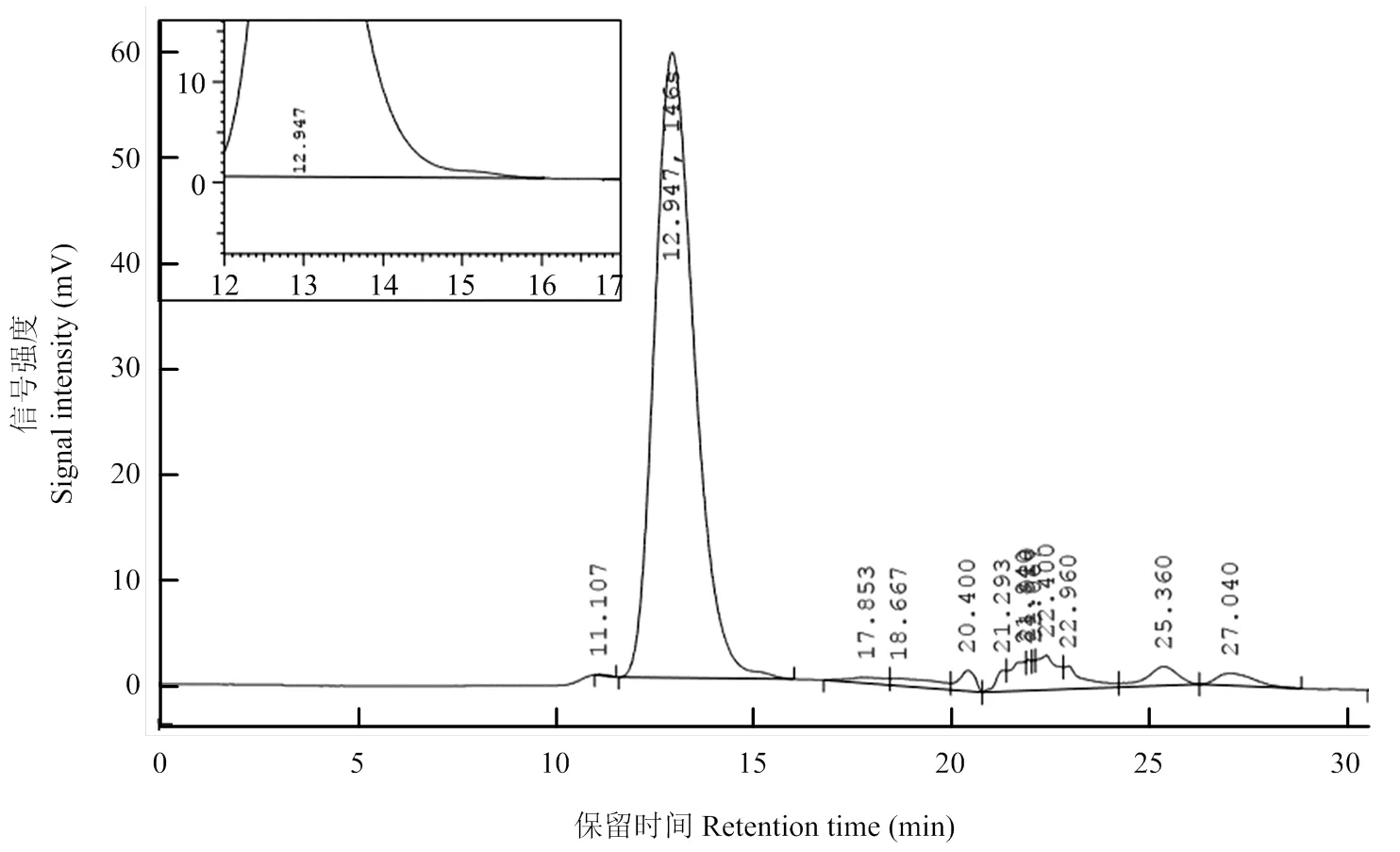
图3 口蹄疫146S抗原标准品原始浓度色谱图
以口蹄疫146S抗原标准品SE-HPLC法测定的146S抗原含量为横坐标x,SDGC法测定的146S抗原含量为纵坐标y,通过统计分析方法,得到线性回归方程为:y=0.6401 x+ 0.4640,相关系数R2= 0.9994,P<0.05(P=6.07E-06),T检验差异显著。2越接近1说明回归线拟合程度越好,y与x相关程度越高。P<0.05说明两组数据差异显著。统计分析结果表明:y与x线性关系显著,高度正相关,即口蹄疫146S抗原标准品检测SDGC法和SE-HPLC法高度正相关。
2.2.2 22批口蹄疫灭活疫苗两种方法的比对 随机选取22批口蹄疫灭活疫苗,分别采用 SE-HPLC法与SDGC进行146S抗原含量测定(表2)。以22批口蹄疫灭活疫苗SE-HPLC法测定的146S抗原含量为横坐标x,SDGC测定的146S抗原含量为纵坐标y,通过统计分析方法,得到线性回归方程为:=0.6019 x+0.4809,相关系数R2= 0.9602,P<0.05(P=9.26E- 15),T检验差异显著。统计分析结果表明:y与x线性关系显著,高度正相关,即口蹄疫灭活疫苗146S抗原检测SDGC法和SE-HPLC法高度正相关。

表2 口蹄疫疫苗146S抗原含量检测SE-HPLC法与SDGC比对
综上所述,口蹄疫146S抗原含量SE-HPLC法和SDGC法高度正相关。口蹄疫146S抗原含量SE-HPLC法测定的146S抗原含量是SDGC法的1.02—2.10倍,146S抗原含量越高,差异越大;口蹄疫146S抗原含量SE-HPLC法重复性好。
2.3 SE-HPLC法检测重复性及适用性
采用口蹄疫146S抗原含量SE-HPLC法检测134批口蹄疫灭活疫苗,包括单价苗18批、双组分苗及双价苗76批、三价苗40批,每批疫苗进行3次重复测定,计算检测的相对标准偏差(表3)。采用核酸酶处理后再进行SE-HPLC检测的方法均能检测到疫苗中完整的146S特征峰,表明该方法具有良好的适用性,对不同企业的不同类型疫苗均能进行检测。每个样品通过SE-HPLC法3次重复性检测分别得到3个146S含量数值(µg·mL-1),其中146S抗原含量相对标准偏差<5%的批次分别占疫苗总批次(134批)、单价苗总批次(18批)、双组分及双价苗总批次(76批)、三价苗总批次(40批)的为81.34%、72.22%、85.53%、80.00%;相对标准偏差10%的疫苗批次占疫苗总批次(134批)的97.76%。结果表明,口蹄疫146S抗原含量SE-HPLC法重复性高,其中三价苗、单价苗的检测重复性高于双组分苗及双价苗的检测重复性。
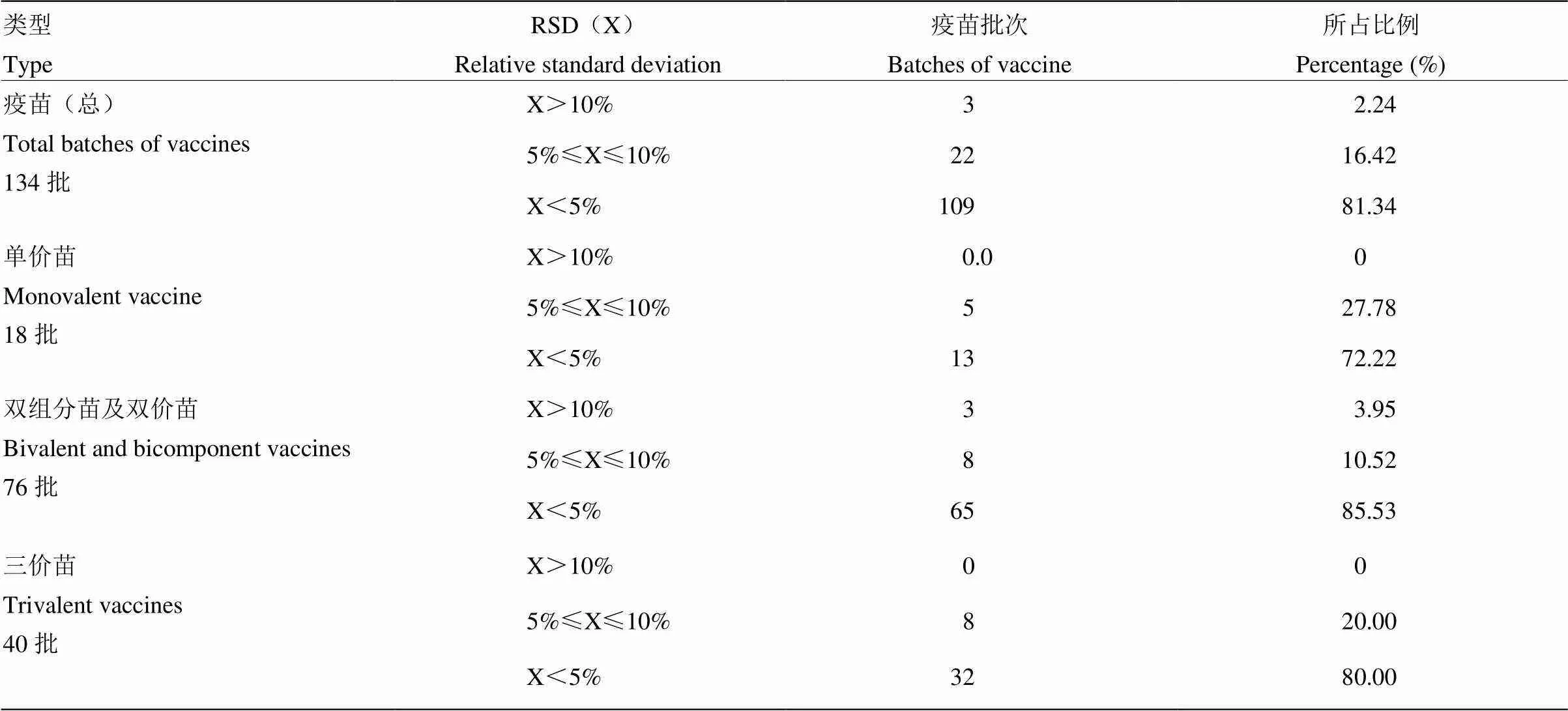
表3 口蹄疫灭活疫苗146S抗原含量SE-HPLC法检测重复性分析
2.4 口蹄疫灭活疫苗146S抗原含量分析
根据以上分析,口蹄疫疫苗146S抗原含量SE-HPLC法具有重复性高、适用性强的优点,可用于市售不同疫苗的质量监测。采用该方法对目前国内市售的疫苗质量进行评估,结果见表4。134批口蹄疫灭活疫苗中,疫苗146S抗原含量(Y,µg·mL-1)均值Y>2、Y>4、Y>6的疫苗批次分别占疫苗总批次的73.88%(99/134)、33.58%(45/134)、22.39%(30/134),146S抗原含量均值最低为1.11µg·mL-1,均值最高为80.36µg·mL-1。其中单价苗抗原146S含量(µg·mL-1)平均值Y>2的疫苗批次占单价苗总批次的61.11%(11/18),双组分苗抗原146S含量平均值Y>4µg·mL-1的疫苗批次占双组分苗总批次的23.08%(9/39),三价苗抗原含量146S平均值Y>6µg·mL-1的疫苗批次占三价苗总批次的60.00%(24/40)。单价苗、双价苗、双组分苗、三价苗的146S抗原含量(µg·mL-1)均值为2.07、2.40、2.85、13.14,平均每个毒株的146S抗原含量(µg·mL-1):三价苗>单价苗>双组分苗>双价苗。疫苗146S抗原含量(Y,µg·mL-1)2≤Y≤4时,检测相对标准偏差小,检测重复性高。
2.5 口蹄疫灭活疫苗146S目的色谱峰特征性指标
选取134批疫苗,共计检测样品402个,其目的色谱峰的平均起峰、最高峰、落峰时间为SE-HPLC进样后的11.58、12.90、14.93min,平均持续3.36min。疫苗样品色谱峰的最早起峰、最早落峰时间为11、16min,目的色谱峰的持续时间为2.5—5min。

表4 口蹄疫灭活疫苗146S抗原含量及检测分析
2.6 口蹄疫灭活疫苗的典型色谱曲线分析
疫苗破乳水相样品,在色谱分离之前,应用核酸内切酶Benzonase进行酶切处理,彻底进行核酸酶消化,以排除宿主细胞DNA等的干扰,避免与146S目的峰交叉的干扰峰或异常峰出现。酶处理后(图4)干扰物消除明显,保证了目的峰的特异性(11—16 min)以及146S抗原含量检测的准确性。
3 讨论
口蹄疫病毒颗粒为球形,直径为27—30nm,病毒粒子无囊膜,呈二十面体对称的颗粒。其蛋白衣壳包裹基因组RNA组成完整病毒粒子,有60个VP1、VP2、VP3和VP4结构蛋白分子组成,其中表面结构蛋白VP1、VP2和VP3立体结构位于病毒粒子表面,VP4位于内部[14]。口蹄疫完整病毒粒子在蔗糖梯度中的相对沉降系数为146S,完整病毒颗粒146S或75S空衣壳在酸性、碱性或一定温度条件下降解为12S和5S粒子,降解后的小分子无免疫原性[6,15-19]。因此口蹄疫灭活疫苗的质量控制关键在于监测完整病毒粒子146S而不受降解的12S的干扰,且SE-HPLC检测方法本身不会导致不稳定的146S发生损失。
过去30多年, Barteling开发的146S蔗糖密度梯度离心法提供了一个可靠的病毒浓度测定方法[7]。该方法将样品上样于均匀分布的15%—45%蔗糖密度梯度上层,然后进行超速离心。但连续蔗糖密度梯度的制备需要纯手工配制或用简单的梯度混合器,后期紫外分光检测过程和人为因素影响较大,整个操作过程关键环节多,造成样品检测重复性差、周期长、人力成本和运行成本较高。口蹄疫146S高效液相体积排阻色谱法依据口蹄疫病毒粒子的物理性状而建立,口蹄疫灭活疫苗生产过程中半成品及成品疫苗中病毒颗粒和其他紫外吸光分子大小差异显著,不同分子组分进入分子筛时,大分子不能进入颗粒内部,先于小分子被流动相洗脱至柱外,各组分按照分子尺寸大小先后洗脱,起到分离和纯化的作用。该方法由Spitteler等[11]于2011年首次建立,因其高效、快速、便捷等优势引起重视。阿根廷口蹄疫疫苗制造商BIOGENESIS-BAGO S.A.公司开发SE-HPLC法并用于口蹄疫疫苗生产和质量控制,专利申请已在阿根廷、巴西、美国和中国归档[20-22]。中国科学院过程工程研究所率先在国内开发该方法并验证[23-24],目前与中国兽医药品监察所联合负责该方法的改进和应用[12-13]。SE-HPLC定量检测146S和多角度激光散射定性检测146S病毒颗粒大小配合,被推荐用于口蹄疫灭活疫苗中间产品和终产品检测[10]。虽然口蹄疫146S抗原含量SE-HPLC法与SDGC法原理不同,但都是通过理化特性测定抗原含量。口蹄疫146S抗原标准品1倍、2倍、4倍、8倍、16倍稀释的5个样品和22批口蹄疫疫苗的146S抗原含量检测结果表明,口蹄疫146S抗原含量检测SDGC法和SE-HPLC法高度正相关(R= 0.9994,n=5;R=0.9602,n=22),22批口蹄疫疫苗146S抗原含量检测SE-HPLC法检测值均比SDGC法检测值高(表1、2),差异显著,前者测定的146S抗原含量是后者的1.02—2.10倍。

前表示加酶处理前;后表示加酶处理后
迄今我国有七家口蹄疫灭活疫苗生产企业,各企业均已实现悬浮培养技术制备抗原、超速离心和中空纤维柱等浓缩纯化工艺进行改进,但详细工艺不统一,由此制备的疫苗抗原中所含的稳定剂、盐离子等成分不同[25-28],导致在大规模使用SE-HPLC方法时出现干扰峰(图5-加酶处理前)。本研究所用的SE-HPLC方法已进行过改进和优化(图4-加酶处理后),制备的口蹄疫146S抗原标准品保证了检验的一致性和准确性。口蹄疫146S目的色谱峰特征性指标的收集便于研究者或使用者在具体运用该方法操作时参考执行。134批市售口蹄疫灭活疫苗中,SE-HPLC法检测的146S抗原含量相对标准偏差(RSD)RSD≤10%的疫苗批次占97.76%,检测重复性好(表2);疫苗146S含量2—4µg·mL-1时,检测相对标准偏差最小(表3);单价苗、双价苗、双组分苗、三价苗均成功采用SE-HPLC法进行了检测。以上结果表明该检验方法具有普适性、重复性、一致性。
国家中长期动物疫病防治规划(2012—2020年)中将我国部分地区列为口蹄疫免疫无疫区。制备和提供稳定、优质、高效、纯净的口蹄疫疫苗成为防控该病和实现目标的关键。在对SE-HPLC监测的准确性和适用性进行检验后,对134批口蹄疫灭活疫苗抗原146S含量进行检测。所有抽检疫苗146S含量(Y,µg·mL-1)均值Y>2占73.88%,说明口蹄疫疫苗总体质量较好;所有类型疫苗包括单价苗、双价苗、双组分苗、三价苗的抗原146S含量µg·mL-1均值分别为2.07、2.40、2.85、13.14µg·mL-1,不同类型疫苗抗原浓度均高于2 µg·mL-1。根据口蹄疫灭活疫苗质量标准,成品疫苗大多规定每头份口蹄疫146S抗原含量高于0.9µg·mL-1。临床免疫时,牛每头注射1—3mL,羊每头份注射0.5—1mL,猪每头份注射1—2mL,134批疫苗成品检测结果显示146S抗原含量符合相应的质量标准要求[29]。目前,我国口蹄疫疫苗检验项目须按OIE标准增加纯度检验项目[1],以便实现口蹄疫感染与免疫的鉴别诊断[30-33],实现 OIE口蹄疫无疫认证的标准,这对口蹄疫灭活疫苗的质量标准提出了更高要求。口蹄疫疫苗146S抗原含量SE-HPLC法具有简便、高效、快速等特性,适用于口蹄疫疫苗生产企业全过程的质量监测和终产品检测,有助于进一步提升我国口蹄疫疫苗质量,进而推动整个产业链水平的提高,为我国重大动物疫病防控提供切实可行的技术支撑。
4 结论
4.1 口蹄疫灭活疫苗完整病毒粒子(146S)高效液相体积排阻色谱法是一种快速、高效、便捷的定量检测有效抗原含量的方法,适于不同生产工艺制备的不同类型的口蹄疫灭活疫苗146S抗原含量测定。
4.2 不同生产企业生产的134批口蹄疫灭活疫苗,疫苗146S抗原含量全部符合质量标准要求,其中146S抗原含量大于2µg·mL-1的占73.88%,疫苗质量普遍较高。
[1] The World Organisation for Animal Health (OIE). Terrestrial Animal Health Code. Foot and mouth disease, Chapter 2.1.8. 2017. website: http://www.oie.int/fileadmin/Home/eng/Health_standards/tahm/2.01. 08_FMD.pdf .
[2] European Pharmacopoeia Commission. European Pharmacopoeia (5th ed) : Foot-and-mouth disease ( ruminants) vaccine ( inactivated). Paris: Pabalogh Scientific Books, 2006: 875-876.
[3] Goris N, Maradei E, D'Aloia R. Foot-and-mouth disease vaccine potency testing in cattle using homologous and heterologous challenge strains: precision of the “Protection against Pedal Generalization” test., 2008, 26(27-28) : 3432-3437.
[4] Levings R L, Henderson L M, Metz C A.potency assays for no replicating veterinary vaccines: comparison toassays and considerations in assay development., 1993, 37: 201-219.
[5] RAN M G, BUTCHAIAH G, SEN A K. Antibody-response to 146S particle, 12s protein subunit and isolated Vp1 polypeptide of foot-and- mouth-disease virus type Asia-1., 1994, 39:135-143.
[6] HARMSEN M M, FIJEN H P, WESTRA D F, COCO-MARTIN J M. Effect of thiomersal on dissociation of intact (146S) foot-and-mouth disease virions into 12S particles as assessed by novel ELISAs specific for either 146S or 12S particles., 2011, 29: 2682-2690.
[7] BARTELING S J, MELOEN R H. A simple method for the quantification of 140S particles of foot-and-mouth disease virus (FMDV)., 1974, 45:362-364.
[8] Doel T R, Fletton B W, Staple R F. Further developments in the quantification of small RNA viruses by U. V. photometry of sucrose density gradients., 1981, 50: 209-219.
[9] Junsuke S, Arinee C, Wacharee S, et a l. Estimation of 140S particles in foot-and-mouth disease virus ( FMDV) vaccine by using the computer analyzing system., 1990, 52(3): 621-630.
[10] SOBRINO F, DOMINGO E.. CRC Press Inc, 2017:292-293.
[11] SPITTELER M A, FERNANDEZ I, SCHABES E, KRIMER A, REGΜLIER E G, GUINZBURG M. Foot and mouth disease (FMD) virus: quantification of whole virus particles during the vaccine manufacturing process by size exclusion chromatography., 2011, 29:7182-7187.
[12] 徐嫄, 邹兴启, 李翠, 朱元源, 何天慈, 杨延丽, 林旋, 宋艳民, 郑金来, 张松平, 赵启祖. 应用体积排阻色谱法测定口蹄疫灭活疫苗中的 146S 抗原含量. 生物工程学报, 2018, 34(5): 676−684.
XU Y, ZOU X Q, LI C, ZHU Y Y, HE T C, YANG Y L, LIN X, SONG Y M, ZHENG J L, ZHANG S P, ZHAO Q Z. Using size-exclusion chromatography to quantify the 146S antigen in inactivated foot-and- mouth disease vaccine., 2018, 34(5): 676-684.(in Chinese)
[13] 徐嫄, 邹兴启, 刘晓东, 李翠, 朱元源, 李阳, 万建青, 何天慈, 徐璐, 张乾义, 王琴, 郑金来, 赵启祖应用高效体积排阻色谱法测定市场抽检口蹄疫灭活疫苗中的抗原(146S)含量.中国兽药杂志, 2018, 52(1):7-12.
XU Y, ZOU X Q, LIU X D, LI C, ZHU Y Y, LI Y, WAN J Q, HE T C, XU L, ZHANG Q Y, WANG Q, ZHENG J L, ZHAO Q Z. Using high performance size exclusion chromatography to determine antigen(146S) conten in foot-and-mouth disease vaccine of quality supervision., 2018, 52(1): 7-12. (in Chinese)
[14] BROWN F, CARTWRIGHT B. Dissociation of foot-and-mouth disease virus into its nucleic acid and protein components., 1961, 192(4808):1163-1164.
[15] Brown F, Crick J. Application of agar-gel diffusion analysis to a study of the antigenic structure of inactivated vaccines prepared from the virus of foot-and-mouth disease., 1959, 82(5): 444-447.
[16] Ceglowski W S. Antibody response to the noninfectious 7 Mu component of the virus of foot-and-mouth disease., 1965, 25:328-330.
[17] Meloen R H, Rowlands D J, Brown F. Comparison of the antibodies elicited by the individual structural polypeptides of foot-and mouth disease and polio viruses., 1979, 45(3):761-763.
[18] Doel T R, Chong W K. Comparative immunogenicity of 146S, 75S and 12S particles of foot-and-mouth disease virus.1982, 73(2):185-191.
[19] Rao M G, Butchaiah G, Sen A K. Antibody response to 146S particle, 12S protein subunit and isolated VP1 polypeptide of foot-and-mouth disease virus type Asia-1.1994, 39(1-2):135-143.
[20] Patent applications US20150355147A1 and CN105158130A “High throµghput quantification and characterization of foot and mouth disease virus and products thereof”. 2015.
[21] Patent applications WO2015186113A1, CN106461625A, EP3152302A1, KR20170015482A and US2017198332A1. “High throµghput quantification and characterization of virus and products thereof”. 2015.
[22] Patent applications AR085877A1, BR102013012689. “Cuantificación exacta de partículas enteras de VFA mediante un método cromatográfico de exclusión molecular”. [Accurate quantification of intact FMDV using a molecular exclusion chromatographic method]. 2012.
[23] YANG Y L, Li H, Li Z J, ZHANG Y, ZHANG S P, CHEN Y, YU M R, MA G H, SU Z G. Size-exclusion HPLC provides a simple, rapid, and versatile alternative method for quality control of vaccines by characterizing the assembly of antigens., 2015, 33(9): 1143-1150.
[24] YANG Y L, ZHAO Q Z, LI Z J, SUN L J, MA G H, ZHANG S P, SU Z G. Stabilization study of inactivated foot and mouth disease virus vaccine by size-exclusion HPLC and differential scanning calorimetry., 2017, 35 : 2413-2419.
[25] Patricia A S, Samuel R F. Characterization of virus adsorption by using DEAE-sepharose and octyl-sepharose., 2002, 68(8): 3965-3968.
[26] 黄炯, 马文戈, 朱刚. 浓缩和纯化操作对口蹄疫 A 型弱毒病毒含量的影响. 中国兽药杂志, 2007, 41(10): 13-15.
Huang J, Ma W G, Zhu G. Effects of concentration and purification on the content of FMDV type A attenuated virus., 2007, 41(10): 13-15. (in Chinese)
[27] Biswal J K, Bisht P, Subramaniam S, et a l. Engineering foot-and-mouth disease virus serotype O IND R2 /1975 for one-steppurification by immobilized metal affinity chromatography., 2015, 43(5): 390-398.
[28] Capozzo A V, Martínez M R, Schielen W J. Development of an in process control filtration-assisted chemiluminometric immunoassay to quantify foot and mouth disease virus( FMDV) non- capsid proteins in vaccine-antigen batches.2010, 28(40): 6647-6652.
[29] 中国兽药典委员会. 中华人民共和国兽药典. 2015 年版(三部). 北京: 中国农业出版社, 2016.
Commission of Chinese Veterinary Pharmacopeia.2015 (3). Beijing: China Agriculture Press, 2016. (in Chinese)
[30] Lu Z, Cao Y, Guo J, et a l. Development and validation of a 3ABC indirect E LISA f or diff erentiation of foot-and-mouth disease virus infected from vaccinated animals., 2007, 125(1-2):157-169.
[31] Bergmann I E, Malirat V, Neitzert E, et a l. Improvement of a serodiagnostic strategy f or foot-and-mouth disease virus surveillance in cattle under systematic vaccination :a combined system of an indirect E LISA-3ABC with an enzyme-linked immune electrotransfer blot assay., 2000, 145(3):473-489.
[32] Sorensen K J, Madsen K G, M adsen E S, et a l. Differentiation of infection from vaccinati on in foot-and-mouth disease by the detection of antibodies to the non-structural proteins 3D, 3AB and 3ABC in E LISA u sing antigens expressed in baculovirus., 1998, 143(8):1461-1476.
[33] De Diego M, Brocchi E, Mackay D, et a l. The non- structural polyprotein 3ABC of foot-and-mouth disease virus as a diagnostic antigen in ELISA to differentiate infected from vaccinated cattle., 1997, 142(10):2021-2033.
Determination of 146S Antigen in Inactivated Foot-and-Mouth Disease Vaccine by Size-exclusion High-performance Liquid Chromatography and Quality Evaluation of Vaccine
ZHU YuanYuan1, XU Yuan1, ZOU XingQi1, YANG YanLi2, LIU LiLi2, WAN JianQing, LI Cui1, XU Lu1, ZHANG QianYi1, XIA YingJu1, WANG Zhao1, LANG HongWu1, WANG Qin1, ZHANG SongPing2, ZHAO QiZu1
(1China Institute of Veterinary Drug Control, Beijing 100081;2National Key Laboratory of Biochemical Engineering/Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190)
【】As vaccine manufacturers and regulatory departments, the quality evaluation method of foot-and-mouth disease (FMD) vaccine is particularly important in quality control, where the 146S antigen is the key index. For the quantification of 146S antigen in FMD vaccine, sucrose gradient density centrifugation (SGDC) is recognized as a classical method but the process is complex, time-consuming and poorly repeatable, which affect the quality monitor of vaccines. Size-exclusion high-performance liquid chromatography (SE-HPLC) is previously reported as a simple, rapid, highly automated and efficient technology for analysis of 146S content. 【】A method of 146S antigen determination in inactivated FMD vaccine by SE-HPLC has been preliminarily established. However, the applicability, repeatability and effectiveness of this method are unknown in the FMD vaccines produced by different manufacturers with different concentration and purification processes. Hence, it is imperative to confirm the universality of the SE-HPLC method.【】Here, the standard curve and regression equation of SE-HPLC method were established with FMD 146S antigen standard, which were used for 146S antigen detection of samples. Moreover, using five samples with 1, 2, 4, 8 and 16 times dilution of 146S antigen standard and 22 batches of vaccine randomly selected in the market, the 146S antigen was detected by SE-HPLC and SDGC respectively, and the correlation between the two methods was analyzed. Further, 134 batches of inactivated FMD vaccines products from different manufacturers in the market were detected three times each for 146S content by SE-HPLC. By analysis of chromatogram specificity of SE-HPLC method and relative standard deviation of 146S content, we confirmed its repeatability and reliability in evaluating all types of vaccine. Finally, 146s content was operated for the quality of FMD vaccines in the market. 【】The standard curve of SE-HPLC method showed good linearity between peak area and concentration of FMD 146S antigen standard (2=0.9981,=8).The detection results of 146S content in 5 diluted 146S antigen standards and 22 batches of FMD vaccine demonstrated that there was a highly positive correlation between SDGC and SE-HPLC methods (R2=0.9994,S=5;R2= 0.9602,v=22). Among 134 batches of vaccines, the vaccine batches with 146S content relative standard deviation RSD<5% accounted for 81.34%, 72.22%, 85.53% and 80.00% of the total vaccine batches (134 batches), total monovalent vaccine batches (18 batches), total bicomponent and bivalent vaccine batches (76 batches) and total trivalent vaccine batches (40 batches), respectively. The vaccine batches with 146S content RSD≤10% accounted for 97.76% of the total vaccine batches (134 batches). The SE-HPLC method for detection 146S content in FMD vaccines performed good repeatability, and best repeatability appeared in 2-4µg·mL-1146S content of the vaccines. Target peaks could be detected in all batches of vaccine, the average peak starting time, peak and peak falling time of objective chromatographic peaks were 11.58 min, 12.90 min and 14.93 min after HPLC sampling. The average retention of peak was 3.36min. The average 146S content was 1.11-80.36µg·mL-1in all vaccines, 2.07 µg·mL-1in monovalent vaccines, 2.40 µg·mL-1in bivalent vaccines, 2.85 µg·mL-1in bicomponent vaccines and 13.14 µg·mL-1in trivalent vaccines respectively.【】These results provided proof that SE-HPLC assay was universal, highly repeatable, reliable, rapid and simple for detection 146S content in various types of current inactivated FMD vaccines in the market, which could be used to monitor and evaluate the quality of the vaccine. FMD vaccines in the market had high 146S content and good vaccine quality.
size-exclusion high-performance liquid chromatography; inactivated foot-and-mouth disease vaccine; 146S; quality of the vaccine
10.3864/j.issn.0578-1752.2019.20.019

2019-01-28;
2019-05-08
国家重点研发计划资助(2018YFC1200501),国家重点研发计划资助(2016YFD0501500)
朱元源,E-mail:zhuyuanyzz@163.com。
赵启祖,E-mail:zhaoqizu@163.com
(责任编辑 林鉴非)

