汤姆青霉PT95和Q1菌株产酶活力及抗菌活性研究
赵文婧,乔宏萍
太原师范学院生物系,晋中 030619
青霉(Penicillium)是自然界中极为常见的的一种菌属,通过分解有机物来生长,是一类杂食性真菌。它与人类生活息息相关,既能给人类带来有益的方面,比如医药中的抗生素——青霉素的使用;也会给自然界带来一定的危害,例如在微生物实验室中,它是一种常见的污染菌。在实验室适当的增加通气性,使空气较为干燥,并让其生长环境的温度处于较低的状态,可以有效的减轻青霉的危害。微生物在生长代谢过程中所产生的消化酶,不仅有助于提高动物饲料转化率、消除抗营养因子,还有助于动物的生长;降低海洋动物体内胆固醇含量,减少排泄物和生长环境中氮、有机磷含量,减少对其周边环境的污染。
随着我国畜牧业的发展和生物工程技术的不断进步,酶制剂在饲料工业中的应用越来越多。由于酶制剂能够消除饲料中的某些抗营养因子的负面作用,提高饲料消化率,改善动物生产性能,降低生产成本,因此日益受到饲料界的重视。
目前,关于汤姆青霉代谢产物产消化酶活性测定以及抑菌实验方面的研究鲜为少见。因此,对汤姆青霉产生的消化酶活性进行测定,同时辅以抑菌实验可以为微生态制剂产品和饲用酶制剂的的广泛使用等提供科学依据。
1 材料与方法
1.1 菌株
PenicilliumthomiiPT95菌株,保存在查氏(CA)斜面上[1]。
PenicilliumthomiiQ1菌株,保存在马铃薯葡萄糖琼脂(PDA)斜面上。
大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌由山西大学生命科学学院韩建荣教授惠赠。
1.2 培养基
四种诱导培养基分别为:发酵培养基、酪素琼脂培养基、羧甲基纤维素钠(CMC-Na)琼脂培养基、淀粉琼脂培养基。
马铃薯葡萄糖(PDB)液体培养基、牛肉膏蛋白胨液体培养基。
1.3 主要试剂
三氯乙酸(TCA),2%可溶性淀粉溶液,柠檬酸钠,L-酪氨酸,羧甲基纤维素钠(CMC-Na),结晶乙酸钠,对硝基苯酚,麦芽糖,干酪素,Na2HPO4,HCL,酒石酸钾钠,NaOH,苯酚,葡萄糖,NaCO3,冰乙酸,对硝基苯酚棕榈酸酯,二硝基水杨酸,柠檬酸,福林试剂,NaH2PO4,无水亚硫酸钠,二硝基亚砜(DMSO)等,均为分析纯。
福林试剂:福林试剂原液∶蒸馏水=1∶2。
酪氨酸标准溶液:取酪氨酸 0.1 g,加入1 mol/L HCL 6 mL,再用 0.1 mol/L HCL 定容至100 mL,最后用蒸馏水稀释10倍即为酪氨酸标准溶液。
DNS指示剂:称取18.2 g酒石酸钾钠,加入50 mL蒸馏水,50 ℃水浴搅拌溶解,再依次加入水杨酸0.6 g、无水亚硫酸钠0.5 g、 NaOH 2.1 g、苯酚0.5 g,待全部溶解后,冷却并用蒸馏水定容至100 mL,4 ℃棕色瓶贮存[2]。
1.4 消化酶活力测定
1.4.1 汤姆青霉产消化酶初筛
将汤姆青霉PT95菌株、Q1菌株分别接种于酪素、CMC-Na、淀粉琼脂培养基平板上,25 ℃培养2天,观察是否产生透明圈完成汤姆青霉发酵液产生的消化酶的初筛。
1.4.2 汤姆青霉产消化酶复筛
将初筛中长有透明圈的汤姆青霉PT95、Q1菌株接种于发酵培养基,28 ℃、160 rpm振荡培养96 h,发酵物4 000 rpm 离心10 min,所获得的上清液就是待测粗酶液。
1.4.3 蛋白酶活力测定
采用福林-酚试剂法进行蛋白酶活力测定[3,4]。
1.4.3.1 标准曲线的绘制
取16只试管分别编号,按表1进行操作,每个浓度设3组重复;将不含酪氨酸的试管(0)作为空白对照组, 用分光光度计测定680 nm处各浓度梯度的酪氨酸标准溶液的OD值,横坐标为酪氨酸浓度,纵坐标为OD值,绘制标准曲线。

表1 蛋白酶标准曲线的制备
1.4.3.2 待测粗酶液的处理
根据孙建南[5]方法进行蛋白酶活力测定。
蛋白酶活力单位定义:每min水解酪蛋白释放1 μg酪氨酸的酶量定义为1个蛋白酶单位(U)。

式中:K:吸光常数
OD:样品平行试验的平均光密度
4:试管中反应液总体积(mL)
10:反应10 min
N:稀释倍数
1.4.4 纤维素酶活力测定
采用CMC-Na法测定其纤维素酶的活力[6,7]。

1.4.4.1 标准曲线绘制
取16支试管分别编号,按表2进行下列的各项操作,每个浓度设3组重复,将不含葡萄糖的试管(0)作为空白对照组,在 550 nm处用分光光度计测定各个浓度梯度的葡萄糖标准溶液的吸光度值,然后将纵坐标定为葡萄糖浓度,横坐标定为吸光度值,绘制标准曲线。

表2 纤维素酶标准曲线的制备
1.4.4.2 待测粗酶液的处理
根据罗佳[8]方法进行纤维素酶活力测定。 纤维素酶活力单位定义:在50 ℃,1 mg酶每min催化纤维素水解生成1 μg葡萄糖定为一个活力单位(U)。
纤维素酶活力单位(U)=
式中:N一酶液的稀释倍数,此处为10
30一糖化所用时间,min
1一反应酶液的mL数
1.4.5 淀粉酶活力测定
采用二硝基水杨酸比色法测定淀粉酶的活力[9-11]。
1.4.5.1 标准曲线的绘制
取19支试管分别编号,按表3进行下列的各项操作,每个浓度设3组重复, 以不含麦芽糖的试管(0)作为空白对照组调零,在520 nm处用分光光度计测定各个浓度梯度的麦芽糖标准溶液的OD值,将纵坐标定为麦芽糖量,横坐标定为吸光度值,绘制标准曲线,计算出OD值所对应的麦芽糖含量。

表3 淀粉酶标准曲线的制备
1.4.5.2 待测粗酶液的处理
根据史永昶[11]方法进行淀粉酶活力测定。
淀粉酶活力单位定义:在60 ℃,pH为5.6时,以单位体积样品在30 min释放1 mg麦芽糖所需要的酶量为一个麦芽糖单位(MMU)[2]。
淀粉酶活性U按下式计算:
U=麦芽糖含量(mg)×淀粉原液总体积(mL)
×稀释倍数/样品重
1.4.6 脂肪酶活力的测定
采用对硝基苯酚法进行脂肪酶活力测定[12,13]。
1.4.6.1 标准曲线的绘制
取16支试管分别编号,按表4进行下列的各项操作,每个浓度设3组重复,以不含对硝基苯酚的试管(0)调零,在410 nm 处用分光光度计测定各个浓度梯度对硝基苯酚的OD值,将横坐标定为对硝基苯酚浓度,纵坐标定为吸光度值,绘制标准曲线。

表4 脂肪酶标准曲线的制备
1.4.6.2 待测粗酶液的处理
根据李蓓[12]方法进行脂肪酶活力测定。
脂肪酶活力单位定义为:在一定条件下,以1min内催化水解底物p-NPP产生1 μmol p-NP所需的酶量为1个酶活单位(U)。
脂肪酶活计算公式为:U=1 000×n×V×c/t
其中n为稀释倍数
c为所测吸光度值对应的浓度(mmol/L);
t为反应时间(单位:min);
V为反应体系的总体积(单位:L)。
1.5 抑菌实验
1.5.1 指示菌活化
用移液枪吸取100 μL大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌保存液接种于50 mL牛肉膏蛋白胨液体培养基中,37 ℃、150 rpm振荡培养24 h。
1.5.2 汤姆青霉PT95和Q1菌株发酵液制备
用接种环挑取汤姆青霉菌株于100 mL PDB培养基中,置于25 ℃、200 rpm振荡培养5天,留汤姆青霉菌株发酵滤液备用。
1.5.3 牛津杯法检测发酵液的抑菌活性
用移液枪吸取200 μL活化好的各指示菌株于冷却后的无菌培养皿中,牛肉膏蛋白胨培养基(25 mL)灭菌后冷却至50 ℃左右时倒入相应加入指示菌株的培养皿中,采用牛津杯法检测发酵液的抑菌活性,37 ℃下培养12~24 h,观察是否有抑菌圈出现并用十字交叉法测量抑菌圈直径大小。
抑菌率=(抑菌圈直径-牛津杯直径)/
抑菌圈直径×100%
1.5.4 最小抑菌浓度的测定
将汤姆青霉PT95和Q1菌株的发酵滤液在50 ℃下旋转浓缩至原体积的五分之一,然后加入95%乙醇沉淀,使其终浓度为75%,4 ℃冰箱放置2天后离心,弃去沉淀,重复一次,上清液50 ℃下浓缩得浸膏,冷却干燥成冻干粉备用[14]。
准确称取一定量的发酵液冻干粉,用2.5%的DMSO分别配制成浓度为5.12、2.56、1.28、0.64、0.32、0.16 mg/mL的样品溶液[15]。采用牛津杯法用样品溶液以及最佳抑菌效果的菌种来测定,置于37 ℃恒温培养箱中培养24 h,观察各培养皿中菌落形成情况,是否有抑菌圈出现并用十字交叉法测量抑菌圈直径大小。
1.6 统计学分析
实验均设三次重复,以平均值±标准差来表示实验数据,用SPSS软件进行方差分析和相关性分析,同时用Duncan多重比较法进行多个均数间的两两比较[16]。
2 结果
2.1 汤姆青霉产蛋白酶活力测定
2.1.1 蛋白酶标准曲线
图1为蛋白酶标准曲线,两者线性关系良好,方程可表示为y=0.011 5x-0.028 9,R2=0.993 8。

图1 蛋白酶标准曲线Fig.1 Standard curve of protease
当OD值为1时,酪氨酸的浓度即吸光常数K,K=89.47。
2.1.2 酶活力测定
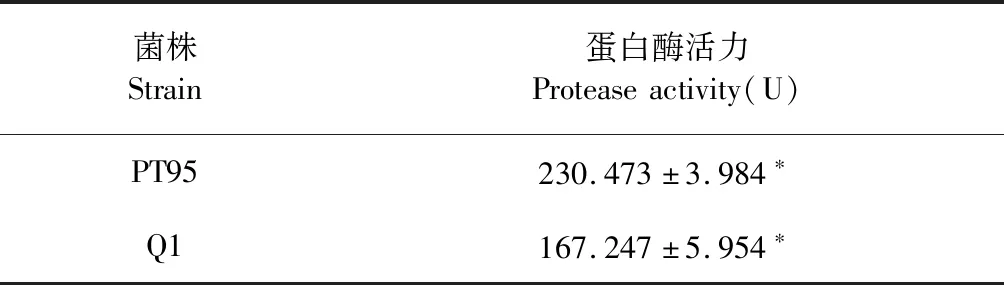
表5 汤姆青霉蛋白酶活力
从表5可以看出,汤姆青霉PT95与Q1之间所产的蛋白酶活力相比差异较显著(P<0.05),PT95菌株的蛋白酶活力是Q1菌株的1.38倍。Uttatree 等[17]报道了枯草芽孢杆菌B.subtilisBUU1 液体发酵24 h 产蛋白酶活力为26.455 U。可以看出汤姆青霉两株菌株的蛋白酶活力相对较高,后续可以开展发酵优化实验进一步提高蛋白酶活力,用于酶制剂的开发。
2.2 汤姆青霉产纤维素酶活力测定
2.2.1 纤维素酶标准曲线
图2为纤维素酶标准曲线,两者线性关系良好,方程表示为y=0.071 1x-0.001 8,R2=0.999 4。

图2 纤维素酶标准曲线Fig.2 Standard curve of cellulase
2.2.2 酶活力测定

表6 汤姆青霉纤维素酶活力
从表6可以看出,汤姆青霉PT95与Q1菌株的纤维素酶活力差异较显著(P<0.05),PT95菌株的纤维素酶活力是Q1菌株的1.6倍。真菌是目前工业生产更是纤维素酶的主要菌种,其中丝状真菌以木霉属、曲霉属和青霉属为主,纤维素酶产量高于其他微生物,所以被广泛使用于纤维素酶产业化生产[18],但汤姆青霉的纤维素酶活力从实验结果来看并不是很高,推测可能和汤姆青霉PT95和Q1菌株主要以产生富含类胡萝卜素的菌核为主,以产生抗氧化物质度过生长,并不是以产生纤维素酶为主的;也有可能是没有做发酵优化以提高纤维素酶活力,后续可以开展此方面研究来看是否有帮助。
2.3 汤姆青霉产淀粉酶活力测定
2.3.1 淀粉酶标准曲线
图3为淀粉酶标准曲线,方程表示为y=2.983x+0.038 6,R2=0.997 2。

图3 淀粉酶标准曲线Fig.3 Standard curve of amylase
2.3.2 酶活力测定

表7 汤姆青霉淀粉酶活力
从表7可以看出,汤姆青霉PT95和Q1菌株所产的淀粉酶活力差异不大,PT95菌株的蛋白酶活力仅比Q1菌株大0.277 U。淀粉酶是指分解淀粉及糖原等高分子聚合物的酶的总称。淀粉酶主要作用于直链淀粉、可溶性淀粉和糖原等,根据其催化特点,通常分为α-淀粉酶和β-淀粉酶。淀粉为动物生长发育提供重要的能量来源,而淀粉的消化与吸收离不开淀粉酶的参与和调控。研究发现,家禽日粮中添加淀粉酶产品,有助于提高家禽对淀粉的消化和利用率;在复胃动物基础饲粮中补充适量淀粉酶,对其生产性能的改善具有促进作用。张帅等[19]利用黑曲霉对橘皮进行固体发酵生产淀粉酶和纤维素酶。结果显示优化后淀粉酶活力达196 U/g,从实验结果可以看出汤姆青霉PT95和Q1菌株的产淀粉酶活力并不高,需要进行优化并添加发酵底物。
2.4 汤姆青霉产脂肪酶活力测定
2.4.1 脂肪酶标准曲线
图4为脂肪酶标准曲线,方程表示为y=14.791x+0.018 7,R2=0.996。

图4 脂肪酶标准曲线Fig.4 Standard curve of lipase
2.4.2 酶活力测定

表8 汤姆青霉脂肪酶活力
从表8可以看出,汤姆青霉PT95与Q1之间产的脂肪酶活力差异极显著(P<0.01),PT95菌株的脂肪酶活力是Q1菌株的1.7倍。脂肪酶又称三酰基甘油酰基分解酶。在脂肪代谢过程中能够将脂肪水解成动物可以直接吸收的小分子物质。在动物体内,脂肪酶控制着脂质代谢的整个过程。因此,脂肪酶是动物机体内重要的消化酶。用于生产脂肪酶的微生物菌种主要包括黑曲霉和假丝酵母等。何茹等从葡萄中分离出1 株产脂肪酶的内生黑曲霉菌株并对其发酵条件进行优化试验,脂肪酶活力可达18.75 U[20],汤姆青霉PT95和Q1菌株在没有优化的基础上脂肪酶活力已有一定的量级,后续研究中可以对其进行优化以提高活力进行酶制剂的开发利用。
2.5 最佳抑菌效果菌株的筛选
从表9和表10可以看出枯草芽孢杆菌可以作为具有最佳抑菌效果的指示菌株,两株菌株对其的抑菌率分别可以达到56.37%和53.73%,且抑菌圈直径也最大。汤姆青霉PT95菌株发酵滤液对大肠杆菌有抑菌活性但是相比较枯草芽孢杆菌来说活性较低,对金黄色葡萄球菌没有抑菌作用;Q1菌株发酵液对大肠杆菌和金黄色葡萄球菌均有抑菌作用,但远低于枯草芽孢杆菌。从表11可以看出汤姆青霉PT95和Q1发酵滤液对枯草芽孢杆菌的最小抑菌浓度为0.64和0.32 mg/mL。

表9 发酵液对不同指示菌株的抑菌圈直径
注:每行数据中带不同字母表示差异显著(P<0.05),“-”表示没有出现抑菌圈。
Note:There are significant differences in different letters in each row of data (P<0.05),"-" means no bacteriostatic circle.

表10 发酵液对不同指示菌株抑菌率大小
注:每行数据中带不同字母表示差异显著(P<0.05)“-”表示没有抑菌效果。
Note:There are significant differences in different letters in each line of data (P<0.05),"-" means no bacteriostasis effect.
3 讨论
众所周知,我国养殖业发展迅速,集约化养殖规模不断扩大。为了防止养殖过程中病害的暴发,抗生素被大量使用。但是抗生素导致耐药性的产生及残留药物通过食物链影响人类健康问题日益突出。因此,寻找新型环保的抗生素替代品成为了当下的研究热点[21,22]。

表11 发酵液对指示菌的最小抑菌浓度测定
注:“-”表示无抑菌活性或者无抑菌圈;“+”表示菌落的数量,+的数量越多,表示菌落数越多;“*”表示抑菌圈大小,*的数量越多,表示抑菌圈越大。
Note:"-" means no bacteriostatic activity or no bacteriostatic circle;"+" denotes the number of colonies,and the more + denotes the number of colonies;"*" denotes the size of the bacteriostatic zone,and more “*” denotes larger bacteriostatic zone.
益生菌作为替代抗生素成为新型的饲料添加剂,受到人们的广泛关注。研究表明,益生菌具有增强养殖动物免疫力、促进饵料的消化吸收、改善养殖环境等作用。益生菌本身无毒无害,不残留,不产生抗药性,是未来养殖产业的应用研究重点[23]。随着饲料添加剂研究的不断深入,人们发现纤维素酶、蛋白酶和淀粉酶等酶制剂在动物体内发挥重要作用,因此对于益生菌中添加复合酶制剂将成为新的研究热点。而青霉在自然界中广泛存在,与人类生活息息相关,因此对青霉代谢产物的研究有助于对其理化特性的进一步分析从而更好地发挥其功能。本实验所用汤姆青霉PT95和Q1菌株是可以在菌核中积累类胡萝卜素的[1],但其能否产生消化酶,并用于饲用酶制剂中有待实验证实,而本文中选取蛋白酶、纤维素酶、淀粉酶、脂肪酶4种消化酶作为检测指标,对菌株产生的酶活力进行了测定,从实验结果中可以看出两株菌株淀粉酶活力差异不大,而脂肪酶活力差异极显著,其余两种酶活力差异显著,结果说明汤姆青霉PT95和Q1菌株可以作为益生菌进行饲用酶制剂的开发利用,整体来看,PT95菌株的消化酶活力大于Q1菌株,可能PT95菌株中有其他作用机制有待探索。
抑菌实验可以看出汤姆青霉PT95以及Q1菌株对枯草芽孢杆菌都表现出了极强的抑菌活性,下一步可以对其进行优化培养以提高两株菌株的抑菌活性,并可以对其抑菌机理进行深入研究,以期开发出相关的抑菌活性产品应用于医药、食品等领域。

