HBV表面抗原preS1激活Wnt信号通路导致肝癌发生的机制研究
袁 杰,熊 希,李云静,谭华炳,刘志新,3,王 娅,邱雪梅,李 蓓,杨 靖,
乙型肝炎病毒(Hepatitis B Virus, HBV)属嗜肝性DNA病毒科,其基因组由不完全闭合环状双链DNA(Relaxed circular DNA,rcDNA)组成,长约3 200对碱基[1]。HBV感染分急性和慢性感染,全球约有20亿人感染过HBV,其中大约3.5亿是慢性感染者。每年死于慢性乙肝(Chronic hepatitis B,CHB)引起的肝纤维化(Liver fibrosis)、肝硬化(Liver cirrhosis)及肝细胞癌(Hepatocellular carcinoma,HCC)的人数约有78万[2]。我国是HBV感染大国,不仅HBV携带者基数大(约1.2亿左右),而且HBV携带者极易转化为HCC患者,每年导致大量的死亡病例[3]。因此,研究HBV感染导致HCC的分子机制对于防治病毒感染至关重要。
HBV感染与肝癌发生具有正相关关系[4],但是学术界对于HBV病毒如何导致肝细胞癌化目前并没有一致结论。目前的文献资料关于此方面的阐述主要集中在3个方面:① HBV 基因组整合到宿主基因组的关键位置导致宿主基因组抑癌基因的失活或者是原癌基因基因的活化[5-7];② HBV感染细胞造成宿主细胞的炎症反应,进而激活下游信号通路,导致肝细胞癌化[8-9];③ HBV进入细胞之后病毒 DNA编码的结构蛋白、分泌蛋白, 或者通过表观遗传导致宿主基因突变和染色体重排等[10-12]。
HBV在细胞中有2种存在方式,即游离型和整合型。HBV阳性的肝细胞癌患者中几乎均可检测到HBV基因组整合[13]。HBV 基因整合至宿主基因组中有利于其持久感染, 长期的慢性炎症可导致肝细胞生命周期改变和增殖, 这增加了宿主基因组DNA终端的数量, 从而有利于HBV基因组整合到宿主基因组中。在有些案例中,HBV基因组整合与肝癌发生具有一定的相关性,但是研究者仍需要更加坚实的临床高通量测序数据来进行深入分析[14]。
检测急性和慢性HBV感染者可在外周血单个核细胞(Peripheral Blood Mononuclear Cells,PBMC)中检测到游离和整合的病毒基因组[15]。Shi等[16]曾报道HBV基因组特定位点的整合可导致T细胞缺陷。HBV除引起肝脏细胞的炎症反应之外,亦可以引发外周血淋巴细胞持续性的炎症反应。但是,目前仍未见报道HBV感染与血液系统的癌症发生具有相关性。
HBV基因组进入肝细胞中之后,自身也可以表达一系列的蛋白。虽然经过几十年的研究,很多蛋白的功能仍未能得到完整的阐释,但有证据显示,HBV DNA表达合成成熟的preS/S和X蛋白触发级联信号可导致肝细胞恶变[17]。
近期,有研究报道HBV的表面膜蛋白preS1可促使正常肝细胞向癌化肝细胞发展[18]。在已有研究结果的基础上,我们进一步研究发现preS1通过抑制β-catenin的磷酸化激活Wnt信号通路,进而促进正常肝细胞向癌化肝细胞转化。本研究旨在能为HBV感染与肝癌发生的机制研究提供新的思路和线索,为未来临床基因诊断和治疗肝癌奠定理论依据。
1 材料和方法
1.1临床组织标本 12例肝癌患者的石蜡包埋肝脏肿瘤组织标本来源于湖北医药学院附属人民医院病理科。其中,6 例标本是HBsAg阳性,6 例标本是HBsAg阴性。肝脏肿瘤组织经4%甲醛溶液固定,修块、脱水、浸蜡、包埋、切片,免疫组化染色,光学显微镜下观察肿瘤切片情况,并拍照记录。所有的人体组织材料的使用均通过湖北医药学院伦理审查委员会批准。
1.2细胞培养 L02肝脏细胞系,HepG2肝癌细胞系和HEK293T细胞系购自中国典型培养物保存中心(China center for Type Culture Collection,CCTCC),用含10%胎牛血清(Gibco Life Technologies, USA)、双抗(青霉素100 U/mL,链霉素100 mg/mL)(Gibco Life Technologies, USA)的DMEM高糖培养基(Gibco Life Technologies, USA),于 5% CO2的恒温培养箱中37℃培养。
1.3载体构建和引物合成 慢病毒载体pWPXLD (Addgene plasmid # 12258) 、pLKO.1-TRC (Addgene plasmid # 10878)及辅助质粒均购自Addgene公司。preS1基因全长使用PCR扩增后,连接入pWPXLD载体的多酶切位点PmeI(NEB, #R0560S)和BamHI(NEB, #R0136S)之间。根据文献[18],一段preS1 shRNAs 序列构建入pLKO.1-TRC载体的AgeI(NEB, #R0552S)和EcoRI(NEB #R0101S)酶切位点之间。所有的构建过程均参照载体说明书进行。preS1基因PCR引物序列和shRNA序列均为华大基因合成,具体序列信息见表1。
表1 引物序列信息
Tab.1 Information of primer

引物名称引物序列(5′-3′)退火温度/℃引物用途preS1 FAGCTTTGTTTAAACATGGGAGGTTGGTCTTCC62载体构建preS1 RGCGGGATCCCTTGTCATCATCGTCCTTG-TAGTCGGCCTGAGGATGACTGTCTC62载体构建preS1 shRNA FCCGGGATTCTTTCCCGATCACCAGTTG-GACTCGAGTCCAACTGGTGATCGGGAAAGAATCTTTTTG—载体构建preS1 shRNA RAATTCAAAAAGATTCTTTCCCGATCAC-CAGTTGGACTCGAGTCCAACTGGTGATCGGGAAAGAATC—载体构建ALDH1 FAAAGAAGCTGCCGGGAAAAG58QRT-PCRALDH1 RCCCCATGGTGTGCAAATTCA58QRT-PCROCT4 FAGAACATGTGTAAGCTGCGG58QRT-PCROCT4 RGGTTCGCTTTCTCTTTCGGG58QRT-PCRSOX2 FAGCTCGCAGACCTACATGAA58QRT-PCRSOX2 RTGGAGTGGGAGGAAGAGGTA58QRT-PCRFGF20 FTTAGAGGTGTGGACAGTGGT58QRT-PCRFGF20 RAGTGCCACAAAATACCTGCG58QRT-PCRDKK1 FAGGTTCTGTTTGTCTCCGGT58QRT-PCRDKK1 RCTCCACAGTAACAACGCTGG58QRT-PCRWISP1 FGACTTTACCCCAGCTCCACT58QRT-PCRWISP1 RGTAGTCACAGTAGAGGCCCC58QRT-PCRCCND1 FGCATGTTCGTGGCCTCTAAG58QRT-PCRCCND1 RCGTGTTTGCGGATGATCTGT58QRT-PCRGAPDH FTCGTGGAAGGACTCATGACC58QRT-PCRGAPDH RATGATGTTCTGGAGAGCCCC58QRT-PCR
1.4慢病毒包装和感染 构建完成的慢病毒质粒使用293T细胞系进行包装。每个6 cm的培养皿,使用Lipofectamine® 2000 (Thermo Fisher Scientific, USA) 转染12 mg的目的质粒,加上6 mg的辅助质粒pMD2G,12 mg的辅助质粒psPAX2。转染后的48 h和72 h收集细胞培养物上清,并使用0.45 μm的微孔滤膜过滤、分装后,于-80 ℃超低温冰箱备用。培养的L02和HepG2细胞系使用包装好的慢病毒进行感染,并使用流式细胞术分选或是嘌呤霉素筛选阳性细胞。
1.5免疫印迹分析 使用加入了蛋白酶抑制剂的(complete protease inhibitor cocktail, Roche, USA) RIPA裂解液裂解收集的细胞。使用Bradford蛋白定量试剂盒 (Bio-Rad, USA)对提取的总蛋白溶液进行定量,并使用SDS-PAGE进行电泳分离,并转至NC膜(Nitrocellulose Membrane)。与相应的一抗孵育之前,NC使用含5%脱脂奶粉和0.1%的吐温20的PBS溶液进行封闭。使用Bio-Rad凝胶图像成像仪显影,并保存实验结果。
1.6实时荧光定量PCR分析 用TRIZOL试剂提取细胞总RNA,用TaKaRa逆转录试剂盒将RNA逆转录成为cDNA,具体步骤按照产品说明书进行。QRT-PCR检测使用BIO-RAD CFX96 和 SYBR RT-PCR kits (ROCHE, USA)荧光定量试剂盒进行。反应体系为:10 μL SYBR Green PCR master mix,5 μL稀释10倍的 cDNA模板和5 μL稀释10倍的正反引物混合物。反应程序为:95 ℃,3 min;95 ℃,20 s,58 ℃,20 s,72 ℃,20 s,采集荧光信号,运行45个循环;65 ℃至95 ℃绘制溶解曲线。QRT-PCR所使用的引物使用Primer Premier 5.0软件进行设计,具体所使用引物序列请见表1。
1.7免疫共沉淀 稳定过表达带FLAG标签preS1蛋白的L02-preS1细胞系使用加入了蛋白酶抑制剂的(complete protease inhibitor cocktail, Roche, USA)RIPA裂解液冰上裂解1 h。细胞裂解产物高速离心(15 000 g, 15 min, 4 ℃)去除未溶解的细胞碎片。收集的上清加入anti-FLAG标签抗体(1 μg/mL)4 ℃孵育过夜,然后再加入30 μL的可以吸附IgG的proteinA琼脂糖珠(CST,#9863)4 ℃孵育2 h。使用RIPA溶液漂洗5~7次。然后高温洗脱吸附的蛋白,使用SDS-PAGE或是Western-Blot进行检测。
1.8数据处理 采用SPSS 17.0软件进行统计学处理。两两检验采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1HBV促进肝癌发生的临床肝癌样本分析 通过对 6 例HBV阳性的肝癌标本和 6 例HBV阴性的肝癌样本进行石蜡切片和免疫组化染色分析,我们发现HBV携带者CD133阳性的肝癌干细胞数量要多于对照组(图1)。基于对临床样本的分析,我们推测HBV可以表达某些因子促进肝癌干细胞的产生。
2.2preS1促进肝癌发生的细胞模型分析 近期,已有研究报道preS1可以促进正常肝脏细胞向癌化肝脏细胞转化[18]。为了进一步深入研究preS1促进肝细胞癌化的具体机制,我们利用慢病毒转染技术构建了稳定过表达preS1的肝脏细胞模型。与对照组L02-GFP相比,L02-preS1细胞中癌症细胞相关基因ALDH1、Oct4和Sox2在mRNA水平上调表达(图2A)。在细胞模型HepG2-preS1中,我们可以得到类似的结果(图2B)。Western-Blot结果显示,L02-preS1和HepG2-preS1中ALDH1、Oct4和Sox2的表达水平均因为preS1的过表达而上调(图2C)。以上结果证实,在肝细胞中过表达preS1可以促进癌症相关因子的上调表达。
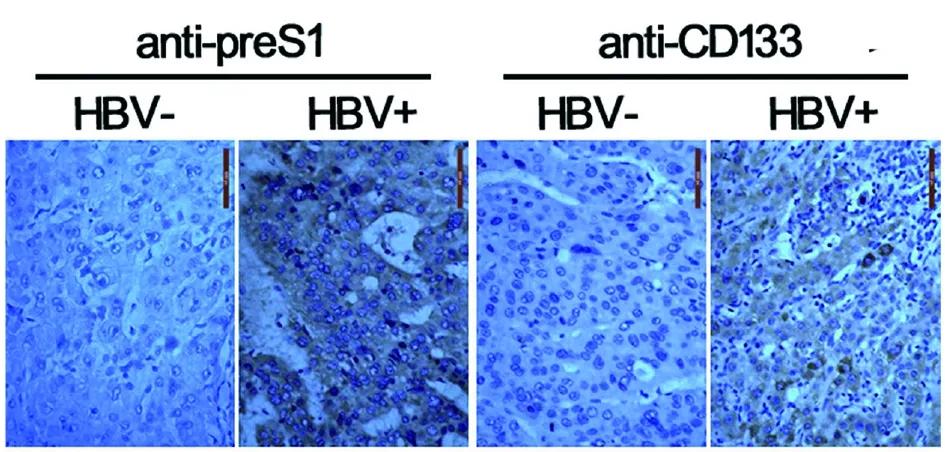
图1 肝癌病理切片免疫组化染色的显微照相图片Fig.1 A micrographic picture of immunohistochemical staining of the pathological section of liver cancer

Graphs show means±SD, n= 3;*: P<0.05; **: P<0.01; ***: P<0.001.图2 在肝细胞系L02和肝癌细胞系HepG2中稳定过表达preS1可上调表达肿瘤标志分子ALDH1、Oct4和Sox2Fig.2 Stable over-expression of preS1 in hepatocyte line L02 and hepatoma cell line HepG2 can up regulate the expression of tumor markers ALDH1, Oct4 and Sox2
2.3preS1促进肝癌发生的内在机制分析 虽然已有报道preS1促进肝癌产生,但是研究者对其内在机制仍缺乏了解。我们通过免疫共沉淀技术获取了能与preS1相互作用的蛋白。免疫共沉淀产物经过SDS-PAGE电泳分离,主要条带经质谱分析,发现preS1与β-catenin存在相互作用(图3A)。我们进一步对preS1稳定过表达和下调表达细胞模型进行QRT-PCR分析。令人意外的是,在过表达和下调表达preS1之后,在mRNA水平并未检测到β-catenin的表达变化(图3B)。我们进一步使用Western-Blot分析β-catenin磷酸化水平的变化。结果显示:过表达preS1之后,磷酸化的β-catenin表达量降低,而非磷酸化的β-catenin表达量升高;而使用RNA干扰下调preS1的表达量,β-catenin的磷酸化水平可以得到恢复(图3C)。为了进一步证实上述结果,我们使用不同浓度梯度preS1过表达质粒(0、0.2、0.4 μg/mL)转染L02细胞,并在转染48 h 之后检测磷酸化β-catenin和非磷酸化β-catenin表达量。结果显示:随着preS1过表达质粒转染浓度的增加,磷酸化β-catenin的表达量逐步降低,而非磷酸化的β-catenin表达量逐步升高 (图3D)。FGF20、DKK1、WISP1和CCND1是Wnt信号通路中可以被β-catenin激活的关键下游基因[22]。我们结果显示:与对照组(L02-GFP)相比,preS1稳定过表达肝细胞系(L02-preS1)在mRNA水平上调表达FGF20、WISP1和CCND1(图3E)。以上结果说明,preS1可以通过抑制β-catenin磷酸化,进而提高细胞内未磷酸化β-catenin的浓度,从而激活Wnt信号通路。

Graphs show means±SD, n=3;ns: no significant difference; *: P<0.05; **: P< 0.01.图3 preS1通过结合β-catenin,抑制β-catenin磷酸化,从而激活Wnt信号通路 Fig.3 preS1 activates Wnt signaling pathway by binding to β-catenin and inhibiting phosphorylation of β-catenin
3 讨 论
CD133作为肝癌干细胞的表面标志物已得到研究者的公认[19]。ALDH1、Sox2和Oct4作为细胞内部表达的关键肿瘤干细胞标志分子,也广泛用于肝癌干细胞的筛选和标记[20]。我们对临床肝癌标本进行免疫组化分析发现,HBV携带者病理切片标本中CD133阳性细胞数量要多于未感染HBV的对照组(图1)。我们利用慢病毒技术,构建了稳定过表达HBV表面膜蛋白preS1的肝细胞模型。与对照组相比,过表达preS1的肝细胞模型中ALDH1,Sox2和Oct4在mRNA水平和蛋白水平均得到了上调表达(图2)。相对于肝癌细胞模型HepG2,在正常肝细胞模型L02中过表达preS1,肝癌细胞肿瘤标志物的表达水平上调更加明显。
已有报道显示,preS1的表达对于正常肝细胞向癌化肝细胞的转化具有重要作用[18],但是肝癌发生过程中与preS1相互作用的下游因子及信号通路仍未见报道。利用建立的L02-preS1稳定过表达细胞系,结合免疫共沉淀技术我们获取了能与preS1相互作用的蛋白。使用SDS-PAGE电泳分离之后,对主要条带进行质谱分析后发现,preS1在蛋白层面可以和β-catenin相互作用(图3A)。我们利用慢病毒RNAi载体pLKO.1-TCR,在过表达preS1的L02细胞系中下调表达preS1。令我们意外的是,下调表达preS1,β-catenin在mRNA水平的表达量并没有变化(图3B)。随后,我们使用Western-Blot对β-catenin的蛋白水平进行了检测。我们发现在L02肝细胞模型中过表达preS1,β-catenin的磷酸化水平受到抑制。而下调preS1的表达量,β-catenin的磷酸化水平可以得到恢复(图3C)。通过不同浓度梯度的preS1过表达质粒转染肝细胞系L02,我们进一步证实了preS1的表达可以抑制β-catenin的磷酸化,上调非磷酸化β-catenin的表达水平(图3D)。β-catenin作为Wnt信号通路上的关键蛋白,对于癌症干细胞的发育至关重要。在经典的Wnt信号通路中,APC、Axin、GSK3和CKI可组成复合物,降解磷酸化的β-catenin,阻止β-catenin和转录因子TCF结合,抑制Wnt信号通路开启[21]。β-catenin和转录因子TCF结合会激活下游基因(如FGF20,DKK1,WISP1,CCND1等)的表达[22],从而开启Wnt信号通路。本研究也证实过表达preS1可以抑制β-catenin的磷酸化,激活FGF20,WISP1和CCND1的表达(图3E)。
结合已发表的研究结果[18],并对本次的研究结果进行分析之后,我们提出如下观点:preS1与β-catenin的结合可抑制β-catenin的磷酸化,未磷酸化的稳态β-catenin在细胞内积聚,与下游TCF转录因子结合,激活Wnt信号通路,并促进肝细胞癌化(图3F)。本研究旨在能够促进我们对HBV导致的肝癌的机制理解,并未将来防治HBV引起的肝癌奠定理论基础。
利益冲突:无

