消癌平注射液对大鼠体内多西紫杉醇药动学的影响研究*
余 彬,饶友义,宁 红,高秀容,许小红,黄毅岚
1.西南医科大学附属医院 药学部(泸州 646000);2.绵阳市中心医院 药学部(绵阳 621000);3.成都医学院 药学院(成都 610500)
药物治疗是抗肿瘤的有效方法之一,其中药物的联合使用尤为重要。多西紫杉醇(docetaxel, DTX)又名多西他赛,是紫杉烷类第二代抗癌药[1-3],其疗效优于紫杉醇。作为临床常用的抗肿瘤一线药物,也常与其他抗肿瘤药物进行联合使用治疗肿瘤,其中包括抗肿瘤中药注射液。消癌平注射液取自乌骨藤的根和藤茎,并经提取而制成[4],具有能够杀灭多种肿瘤细胞、抑制肿瘤生长的作用,与化疗药物联合使用可明显增强化疗疗效,降低化疗引起的不良反应[5]。
目前,中西药联用治疗恶性肿瘤的情况日益普遍[6],其中也包括DTX注射液联用消癌平注射液,而DTX需经CYP3A4酶进行代谢[7],而本团队前期研究[8]结果表明消癌平对CYP3A4酶具有抑制作用,因此当两药联合使用时,DTX代谢很可能会被抑制,引起血药浓度增加及疗效的增强,但仍缺乏进一步的相关研究进行佐证。故本团队以大鼠作为研究对象,采用高效液相色谱(high performance liquid chromatography,HPLC)法探讨消癌平对DTX大鼠体内药动学的影响,进一步验证消癌平对DTX的抑制作用,并为两药在肿瘤患者的联合使用提供实验依据和指导。
1 材料与方法
1.1 实验动物
雄性SD大鼠,体重(200±10) g,共计24只,并采用计算机随机分为4组,每组6只大鼠,4组大鼠分别编为分为A、B、C、D组,大鼠由西南医大实验动物中心提供,动物的许可证为SCXK (川)2012-17。大鼠采用分笼饲养,1笼1只,每日给予食物和水。大鼠在实验室动物实验中心,实验中心相对湿度在40%~60%之间,室温控制在(23±3)℃。
1.2 药品与试剂
消癌平注射液(江苏恒瑞医药股份有限公司,规格:0.5 mL∶20 mg,批号15111215);DTX对照品(中国食品药品检定研究院,纯度98.4%,批号100666-201403);紫杉醇对照品(中国食品药品检定研究院,质量分数99.9%,批号100382-201603)。乙腈、甲醇为色谱纯;水为重蒸馏水;其余为分析纯。
1.3 仪器
HPLC仪(Ultimate 3000型,德国戴安公司);医用离心机(G16型,北京白洋医疗器械有限公司);旋涡混合器(HX-B型,江苏康健医疗用品有限公司);电子天平(ME104型,德国Sartorius公司)。
1.4 药动学实验设计
大鼠给药前禁食不禁水12 h,A组大鼠仅给予DTX;B组大鼠给予DTX及消癌平(低剂量);C组大鼠给予DTX及消癌平(中剂量);D组大鼠给予DTX及消癌平(高剂量)。其中A组为空白组,B组为低剂量组,C组为中剂量组,D组为高剂量组。通过不同种属之间的药物剂量换算并依据预试验结果,确定给予大鼠的DTX剂量为13.3 mg/kg, 消癌平的中剂量为5 mL/kg,依据中剂量开展预实验确定大鼠的另外两个剂量,最后确定消癌平的高剂量为中剂量的1.5倍,低剂量为中剂量的0.5倍。4组大鼠的DTX和消癌平分别前后给药,消癌平在注射DTX前12 h进行给药,药物经尾静脉注射,并于给药后在不同的时间点进行取血,依据的时间点为5、15、30 min和1、2、3、4、5、6、8、10 h, 取血量约0.5 mL, 并将采取得血样置于离心管中,随即进行离心,分离后将血浆于-20℃冰箱内保存至测定。
1.5 HPLC测定方法
1.5.1 标准曲线溶液和质控(QC)样品溶液制备 1)标准曲线工作液:精密称取DTX对照品3.0 mg置于10 mL量瓶中,采用有机溶剂-甲醇进行溶解,及定容至刻度线,得300 mg/L DTX储备液。储备液用甲醇-水(50∶50,V/V)稀释,配制在0.781 3~100.0 mg/L质量浓度范围内的系列标准曲线工作液。2)内标溶液:精密称取一定量DTX,用甲醇溶解定容,配制30.0 mg/L内标溶液。3)标准曲线溶液:分别将系列标准曲线工作溶液50 μL加入至50 μL空白大鼠血浆中,混匀得质量浓度为0.39、0.78、 1.56、3.12、6.25、 12.50、25.00、50.00 mg/L系列标准曲线溶液。4)质控(quality control,QC)样品溶液:配制方法方法同标准曲线溶液,得质量浓度分别为1.56、6.25、25.00 mg/L的QC样品溶液。
1.5.2 色谱条件 色谱柱为Nucleodur C18色谱柱(规格:5 μm,4.6 mm×250 mm);流动相为50%的乙腈水溶液;检测波长为233 nm;流速为1 mL/min;柱温为室温。
1.5.3 血浆样品的处理和测定 取大鼠空白血浆约0.2 mL置于离心管内,并在离心管中加入内标液(紫杉醇)30 μL和1 mL的三氯甲烷后进行3 min的涡旋,随即在转速为6 000 r/min,离心半径10 cm的离心机内离心10 min,完毕后将有机层转移至另一离心管内,于离心管内加入50%的乙腈水溶液并在氮气下直至吹干,随后在转速为3 000 r/min,离心半径10 cm的离心机内离心20 min, 离心后取20 μL进行分析,记录色谱图。
1.6 统计学方法
2 结果
2.1 方法专属性考察
DTX、紫杉醇的保留时间分别为12.13、15.21 min,两峰完全分离,且分离度R>1.5,DTX的对称因子0.98,理论塔板数为9 400,紫杉醇的对称因子为1.02,理论塔板数为11 000,且无其他干扰物质存在,表明本色谱方法专属性良好(图1)。
2.2 标准曲线和最低定量限(lower limit of quantification,LLOQ)
计算DTX面积与内标峰面积的比值Y(As/Ai),以Y作为纵坐标,血浆中DTX质量浓度C(ng/mL)为横坐标,进行加权(权重1/C2)回归,得到DTX的标准曲线方程、相关系数r如下:Y=8.101 3X-3.265 2,r=0.999 3,最佳权重为: 1/C2。
在0.39~25.00 mg/L质量浓度范围内,DTX与内标峰面积比值与DTX质量浓度有良好的线性关系,LLOQ为0.19 mg/L。
2.3 精密度
高、中、低3种质量浓度的DTX连续3 d 内日间精密度的相对标准偏差(RSD)分别为3.12%、3.68%、7.66%;日内精密度的RSD值分别为3.84%、3.15%、6.38%(表1)。

图1 高效液相色谱图注:A:空白血浆;B:空白血浆+DTX(6.25 mg/L)与内标液;C:大鼠静脉注射DTX 1 h后的血浆
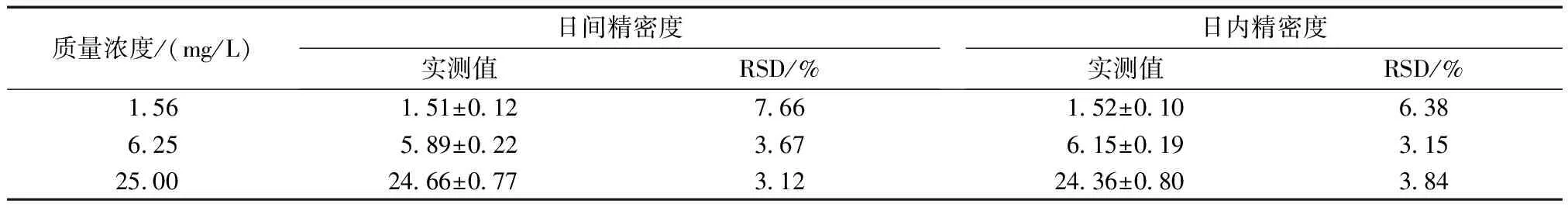
质量浓度/(mg/L)日间精密度实测值RSD/%日内精密度实测值RSD/%1.561.51±0.127.661.52±0.106.386.255.89±0.223.676.15±0.193.1525.0024.66±0.773.1224.36±0.803.84
2.4 回收率
高、中、低3种浓度的DTX回收率的RSD分别为6.44%、3.82%、3.19%(表2)。
表2 待测组份在大鼠血浆中的回收率
2.5 稳定性
参照SFDA“化学药物非临床药代动力学研究技术中的相关技术”指导原则,对高(25 mg/L)、低(1.56 mg/L)两个浓度样品的稳定性进行考察,以确保实验结果的准确可靠。分别考察DTX血浆样品在不同条件下的稳定性,考察条件包括:样品置于室温下避光放置6 h、样品1周内连续反复冻融3次、 样品置于-20 ℃冰箱中分别冻存15 d以及30 d,和处理后的样品放在自动进样架上(12 h,15 ℃)的稳定性考察,在各条件下测得的RSD值均小于8%(表3)。

表3 各条件下稳定性的RSD(%,n=6)
2.6 药动学研究
4组大鼠在给药后,DTX的血药浓度为纵坐标,时间为横坐标绘制浓度-时间曲线图,药动学参数采用DAS2.1.1软件拟合(图2、表4)。
药代动力学参数按非房室模型进行拟合,从上表结果可知,B、C、D 3组的t1/2(α)、CL分别与A组相比,差异均无统计学意义(P>0.05),说明消癌平对DTX的t1/2(α)以及CL没有任何影响;仅D组的t1/2(β)与A组相比,差异有统计学意义(P<0.05),说明D组的消除半衰期有所延长,其余两组的消除半衰期没有影响;C组和D组的AUC、Cmax、MRT与A组相比,差异有统计学意义(P<0.05),说明中剂量组和高剂量组的AUC和Cmax增大,MRT延长,低剂量组未受影响。因此结合以上参数结果,当两药联合使用时,高剂量组的DTX t1/2(β)延长,中剂量组和高剂量组的DTX AUC、Cmax增大,MRT延长,CL和t1/2(α)未受影响,说明在DTX在与消癌平合用时,DTX的清除减慢,导致血药浓度增大,这也进一步证实了本团队的期前研究结果,消癌平对DTX的消除具有抑制作用[8]。
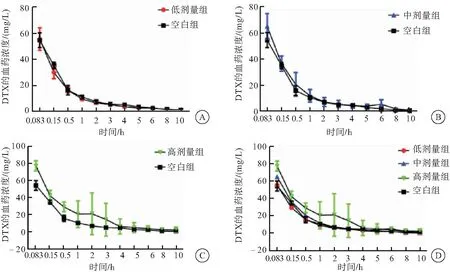
图2 DTX在大鼠体内的药-时曲线图
注:A:空白组与低剂量组大鼠给予药物后DTX的血药浓度;B:空白组与中剂量组大鼠给予药物后DTX的血药浓度;C:空白组与高剂量组大鼠给予药物后DTX的血药浓度;D:4组大鼠给药后DTX的血药浓度
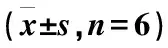
表4 DTX的药动学参数
注:与A组比较,*P<0.05
3 讨论
3.1 关于色谱条件的确定
色谱条件的确定有以下几个要点:1)DTX的对称因子较好;2)DTX和内标峰互补干扰,也都不被血浆杂质峰所干扰;3)DTX以及内标峰的各自分离度(R)≥1.5;4)出峰时间较短。依据上述要求,并结合已有的实验条件及参考相关文献[9-13]进行预实验,最终确定色谱条件为色谱柱。Nucleodur C18柱(规格:5 μm, 4.6 mm×250 mm);流动相为50%的乙腈水溶液;检测波长为233 nm;流速为1 mL/min;柱温为室温。
3.2 关于动物试验中给药剂量的设计
按照说明书中DTX用量,成人的常用剂量为75~100 mg/m2,根据文献[14]和剂量换算公式,以及预实验,最终确定给予大鼠的静脉注射剂量为13.3 mg/kg。说明书中成人消癌平的给药剂量为0.33~1.67 mL/kg,根据文献[15-17]和剂量换算公式,以及预实验,确定给予大鼠消癌平的剂量(中剂量)为5 mL/kg。
3.3 内标物的选择
在目前对DTX的HPLC研究中,内标物的选择也多种多样;大多采用地西泮作为内标物[14,18-19]。但本研究以紫杉醇作为内标物,紫杉醇是在DTX的结构上改造而成,且两药的药效作用相似。同时本研究的色谱条件下,内标峰的峰型对称良好并不受干扰,也未干扰主峰,R满足需求,且出峰时间早,因此本研究选择紫杉醇作为内标物符合要求。
本研究结果显示,DTX在大鼠体内的血药浓度有所增加,消癌平对DTX的多个药动学参数有较大影响,结合其余参数结果,消癌平对多西紫杉醇的消除具有明显的抑制作用,提示两药在联合使用时,需严格的把握药物的剂量,保障患者用药的安全和有效。本团队将在此次试验和前期研究[8,20]的基础上,继续采用HPLC法探寻DTX与其他的抗肿瘤中药注射剂(如:注射液香菇多糖、康艾注射液)之间潜在的药动学和药效学等多种形式的药物相互作用。