牛种布鲁氏菌clpP 基因缺失株的毒力和免疫保护力评价
彭小薇,吴方达,刘郁夫,董 浩,孙永健,毕一鸣,张存瑞,刘林青,韩 焘
(1.中国兽医药品监察所,北京 102618;2.宁德市动物疫病预防控制中心,福建宁德 352000;3.中国动物疫病预防控制中心,北京 102618;4.农业农村部畜牧兽医局,北京 100125)
布鲁氏菌病(以下简称布病)是世界动物卫生组织(OIE)规定的须通报动物疫病,目前在全球160 多个国家和地区流行[1]。近年来,由于我国牛羊养殖量快速增长,地区间牛羊无序调运,畜间和人间布病疫情有加重趋势。2014 年全国共报告人感染病例57 222 例,到达历年峰值[2]。
疫苗免疫是防控动物布病的主要手段之一。目前,在国内使用的弱毒活疫苗,包括猪种S2 株、牛种A19 株和羊种M5 株,其在防控布病流行中发挥了重要作用。然而这些疫苗株仍存在局限性,如引起怀孕动物流产、毒力返强以及对人有感染性和干扰临床血清学检测等[3]。
ClpP 蛋白是一种保守的肽酶,可以与不同亚基组成Clp 蛋白酶复合体。在多种病原菌中,ClpP 蛋白与细菌致病性密切相关[4-5]。目前,该蛋白的功能及其与细菌毒力的关系尚没有相关研究。本研究构建了牛种布鲁氏菌clpP基因缺失株,测定了该缺失株在巨噬细胞感染模型和小鼠感染模型中的毒力,并评价了用clpP基因缺失株免疫小鼠后产生的免疫保护力,从而为揭示布鲁氏菌的致病机制和布病疫苗候选株的筛选提供了一定的数据支持。
1 材料与方法
1.1 菌株、质粒与实验动物
牛种布鲁氏菌2308 株[6],由国家动物布鲁氏菌病参考实验室保存;大肠杆菌感受态细胞DH5α,购于天根生化科技有限公司;同源重组质粒pBluscript ⅡKS(+)和广宿主基因克隆质粒pBBR1MCS,由国家动物布鲁氏菌病参考实验室保存。SPF 级4~6 周龄雌性BALB/c 小鼠,购于北京维通利华实验动物技术有限公司。所有涉及布鲁氏菌的实验操作,均在中国兽医药品监察所生物安全3 级实验室完成。
1.2 主要试剂
细菌基因组DNA 提取试剂盒,购于天根生化科技有限公司;质粒小提试剂盒、胶回收试剂盒,购于OMEGA 公司;Premix ExTaq聚合酶,KpnI、BamHI 限制性内切酶,购自TaKaRa 公司;胰蛋白胨大豆琼脂(TSA)和胰蛋白胨大豆肉汤(TSB),购于BD 公司;胰蛋白胨、酵母浸出膏,购于Sigma 公司。
1.3 同源重组质粒和回补质粒的构建
以提取的牛种布鲁氏菌2308 株基因组DNA为模板,使用引物DclpP-UF/UR 和DclpP-DF/DR,分别扩增clpP基因的上下游同源臂片段;以回收的上下游同源臂片段为模板,使用引物DclpP-UF 和DclpP-DR 进行连接PCR 扩增;回收连接PCR 产物并经过BamHI 和KpnI 双酶切后,插入同样经双酶切的pBluscript ⅡKS(+)质粒中,获得质粒pBluscript-clpP 载体;最后,使用卡那霉素抗性基因扩增引物(Kan-F/R)进行PCR 扩增,并将扩增的卡那霉素抗性基因片段,经XhoI 单酶切插入pBluscript-clpP 质粒中,获得同源重组质粒pBlue-clpP::Kan。
以提取的牛种布鲁氏菌2308 株基因组DNA为模板,应用引物对CclpP-F/R 进行PCR 扩增(扩增片段包括clpP基因的ORF 及上下游启动子序列);胶回收PCR 产物,使用KpnI 和BamHI 对DNA 片段和pBBR1MCS 质粒进行双酶切;过夜连接后转化DH5α,用含氯霉素的LB 平板进行筛选,经PCR 和测序鉴定阳性质粒,将其命名为pBBRCclpP。
构建同源重组和互补质粒的引物,参照牛种布鲁氏菌2308 株clpP基因片段(BAB1_1132)进行设计,并由中美泰和有限公司合成。引物详细信息见表1,相关测序试验由中美泰和有限公司完成。
1.4 clpP 基因缺失株和回补株的构建
将牛种布鲁氏菌2308 株单菌落接种于10 mL的TSB 液体培养基中,在37 ℃条件下,震荡培养至生长对数期;将细菌在4 ℃低温条件下离心,去除培养基上清,然后经4 ℃预冷的无菌去离子水洗涤3 次;取78 μL 洗涤后的牛种布鲁氏菌2308株菌液和5 μL pBlue-clpP::Kan 质粒,混匀后加入电击杯,使用“Agr”的电转参数进行电转化;将电击后的细菌加入500 μL TSB 液体培养基,37 ℃震荡培养6 h 后,取200 μL 涂布在卡那霉素抗性的TSA 平板培养基上,并置于37 ℃温箱静置培养3~7 d;待长出单菌落后,分别经氨苄青霉素和卡那霉素抗性的平板培养基筛选,并采用PCR 鉴定是否为clpP基因缺失株(ΔclpP)。

表1 引物序列
回补菌株构建方法与clpP基因缺失株构建方法类似,同样采用电转化方法,将构建的pBBRCclpP 质粒导入clpP基因缺失株,通过氯霉素抗性的平板培养基进行阳性克隆筛选,并采用PCR 方法进一步鉴定是否为回补菌株(CclpP)。
1.5 细胞感染试验
用TSB 培养基,将2308、ΔclpP和CclpP菌株培养至稳定期,进行细菌平板计数后放至4 ℃冰箱暂存。用3% FBS 的DMEM,将小鼠RAW264.7巨噬细胞悬液稀释至5×105cell/mL;将0.5 mL细胞悬液加到24 孔细胞板中,即每孔细胞数为2.5×105个。根据细菌计数结果,将布鲁氏菌以MOI=100:1 的剂量接种RAW264.7 细胞,500×g离心5 min,然后置于37 ℃孵育1 h;感染结束后,换成含50 μg/mL 庆大霉素的细胞维持液处理1 h,杀灭胞外细菌,最后换成含20 μg/mL 庆大霉素的维持培养液;取感染后1、12、24、48、72 h 5 个时间点,统计胞内细菌存活数,做3 个复孔。试验重复2 次。
1.6 小鼠感染试验
用TSB 培养基将布鲁氏菌2308、ΔclpP、CclP菌株培养至稳定期,进行细菌计数后置于4 ℃冰箱暂存。根据细菌计数结果,用生理盐水将细菌稀释至1×106CFU/mL,并以0.1 mL 的剂量腹腔注射4~6 周龄SPF 级BALB/c 小鼠(1×105CFU/只)。
分别于攻毒后1 周和4 周处死小鼠,无菌采集小鼠脾脏,加1 mL 生理盐水研磨脾脏组织;10倍倍比稀释后,涂布TSA 平板,置于37 ℃、5%CO2培养箱中培养3~5 d,计算脾脏细菌载量。
1.7 小鼠体内持续存活期评价
在小鼠模型中,评价clpP缺失株在小鼠模型中的脾脏残余毒力,同时设置A19 疫苗株对照组和2308 强毒株对照组。具体试验步骤同1.6。
1.8 clpP 基因缺失株免疫保护力测定
试验步骤参照OIE《陆生动物诊断试验与疫苗手册》(2004 版)中关于布鲁氏菌疫苗评价的内容进行。将36 只4~6 周龄BALB/c 小鼠分成3组:clpP基因缺失株免疫组、A19 疫苗对照组和PBS 阴性对照组,每组12 只;分别以1×105CFU/只的剂量腹腔接种小鼠;免疫8 周后,每个免疫组分别以牛种布鲁氏菌强毒2308 株和羊种布鲁氏菌强毒M28 株腹腔接种小鼠,攻毒剂量均为2×105CFU/只;攻毒2 周后剖杀小鼠,无菌采集小鼠脾脏,统计脾脏质量和载菌量,计算免疫保护单位,以此来评价ΔclpP和A19 菌株的免疫保护效果。免疫保护单位为PBS 注射组与免疫组小鼠平均脾脏载菌量取10 的对数的差值。
2 结果
2.1 clpP 基因缺失株和回补菌株的构建
将同源重组质粒pBlue-clpP::Kan 电转至2308株后,经氨苄青霉素和卡那霉素平板筛选,得到具有卡那霉素抗性且对氨苄青霉素敏感的布鲁氏菌clpP基因缺失株。使用DclpP-UF/DR 引物进一步进行PCR 验证,结果发现亲本株2308 可扩增出约1 400 bp 大小的片段,而突变株可以扩增出约2 400 bp 大小的片段(图1),证明基因缺失株ΔclpP构建成功。
将回补质粒PBBR-CclpP 电转至基因缺失株ΔclpP后,经氯霉素平板筛选和进一步PCR 验证,证明clpP基因缺失回补菌株(CclpP)构建成功。
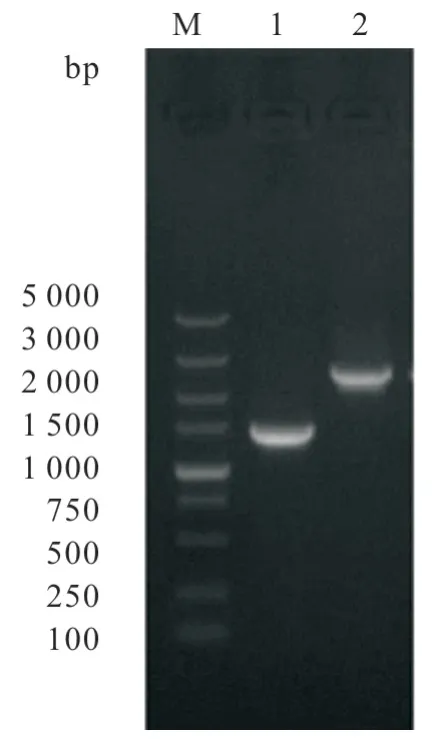
图1 亲本株与基因缺失株的PCR 鉴定结果
2.2 细胞感染试验
为评价2308、ΔclpP和CclpP等菌株在巨噬细胞内的增殖能力,在体外进行RAW264.7 小鼠巨噬细胞系感染试验。结果如图2 所示:在相同感染剂量下(MOI=100:1),感染1 h 和12 h 后,感染细胞内2308、ΔclpP及CclpP的细菌数无显著差异;感染24、48 和72 h 后,ΔclpP菌株感染的巨噬细胞胞内细菌数显著低于亲本株2308 和回补株CclpP,说明clpP基因缺失可显著降低布鲁氏菌在巨噬细胞感染模型中的胞内增殖能力。
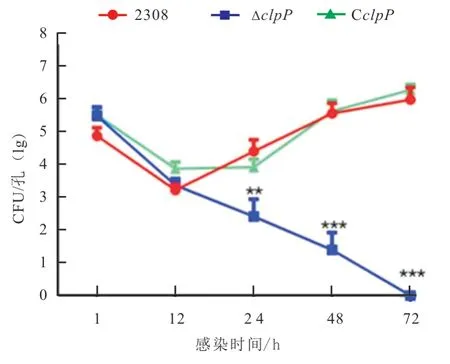
图2 牛种布鲁氏菌2308、ΔclpP 和Cclp在RAW264.7 细胞中的胞内增殖情况
2.3 小鼠感染试验
将 亲 本 株2308 以 及ΔclpP和CclpP株,以1×105CFU/只的剂量腹腔注射4~6 周龄SPF 级雌性BALB/c 小鼠(每组5 只),并分别在感染后1周和4 周剖杀小鼠,通过脾脏质量和脾脏载菌量评价细菌毒力。结果如图3 所示:在感染后1 周和4周,ΔclpP株感染组小鼠脾脏质量和载菌量显著低于2308 株感染组;在感染后4 周,80%(4/5)的ΔclpP株感染组小鼠已经在体内清除细菌,而亲本株2308 和回补菌株CclpP感染组的脾脏载菌量仍维持在高位。
2.4 clpP 基因缺失株持续期评价
为评价clpP基因缺失株的安全性,首先在BLAB/c 小鼠模型中,检测clpP基因缺失株在小鼠脾脏中的持续期,以亲本菌株2308 为强毒对照、疫苗株A19 为疫苗株对照,分别在感染后不同时间点剖杀小鼠,以小鼠脾脏质量、脾脏载菌量为指标进行评价。结果显示(图4):clpP基因缺失株的残余毒力显著低于2308 株和疫苗株A19;clpP基因缺失株可在感染后6 周完全从小鼠脾脏中被清除;与2308 株、A19 疫苗株相比,clpP基因缺失株感染小鼠后并不引起明显的脾脏肿胀。
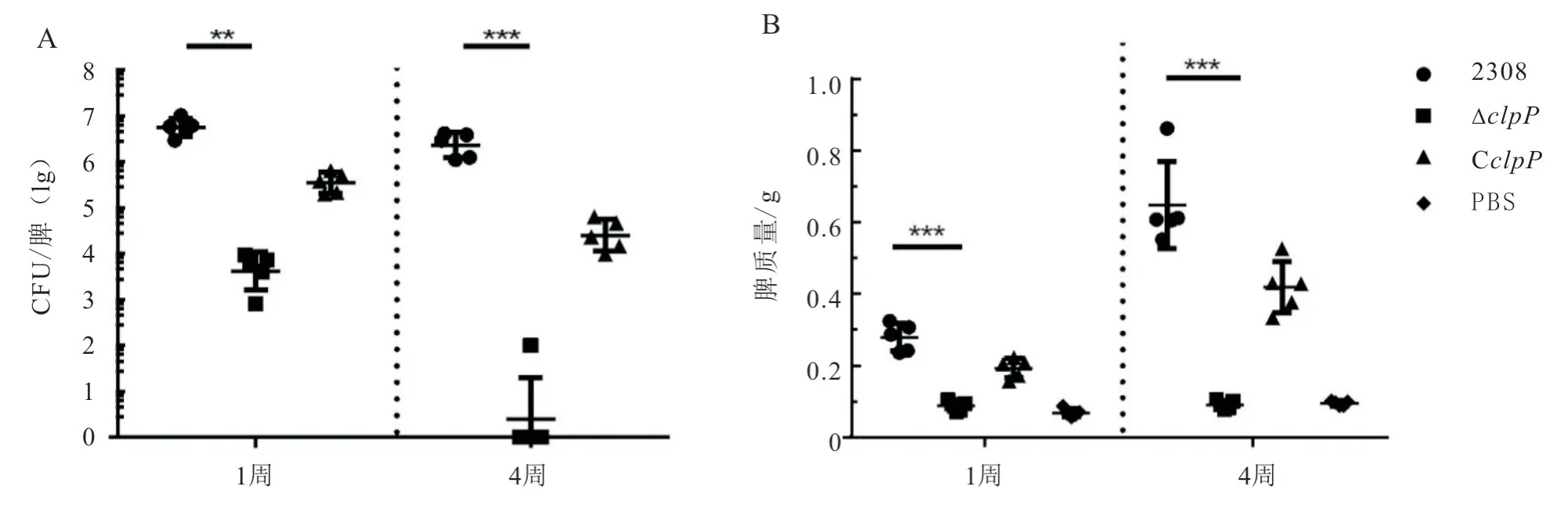
图3 牛种布鲁氏菌2308、ΔclpP 和CclpP 感染后小鼠的脾脏质量及载菌量
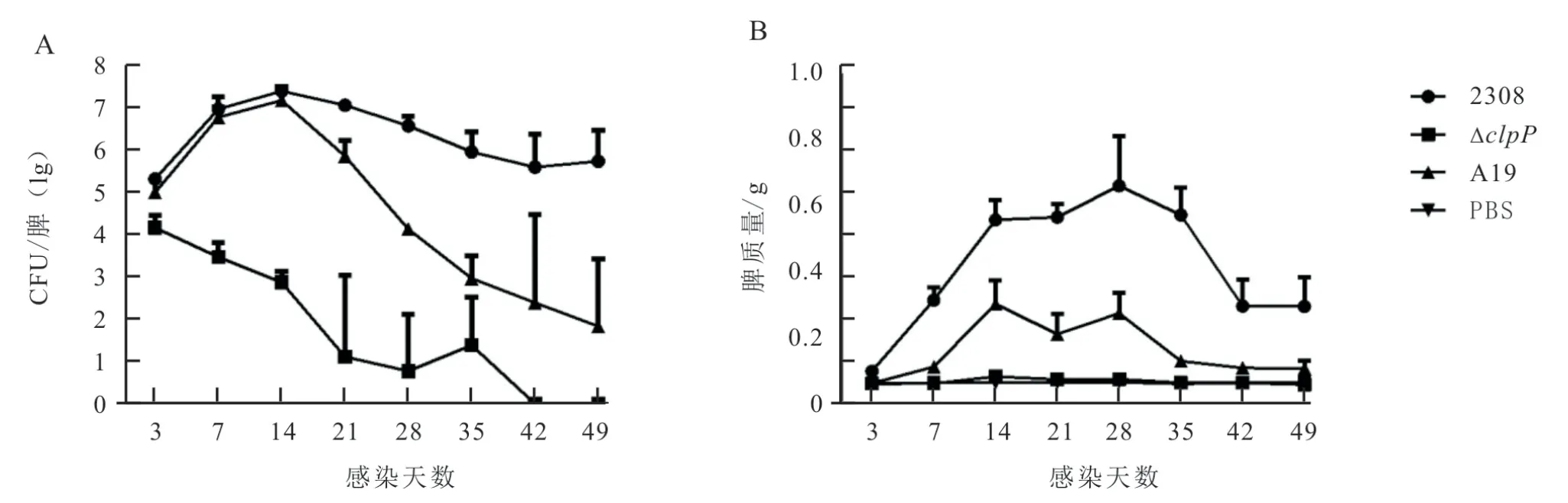
图4 2308、ΔclpP 和A19 株感染小鼠3~49 d 后在脾脏中的残余毒力
2.5 clpP 基因缺失株免疫保护力评价
为评价clpP基因缺失株免疫动物后产生的抵抗同源和异源攻毒的免疫保护力,在小鼠模型中进行了免疫保护力测定。结果如表2 所示:疫苗株A19 可为同源和异源攻毒提供良好的免疫保护力,抵抗同源(牛种2308 强毒)攻毒的脾脏免疫保护单位为2.41,抵抗异源(羊种M28 强毒)攻毒的脾脏免疫保护单位为4.23;而clpP基因缺失株仅能提供微弱免疫保护力,免疫保护单位分别为0.67(P〈0.05)和0.46(P〈0.001),免疫保护效果明显低于疫苗株A19。
3 讨论
在病原菌感染过程中,蛋白酶水解作用与细菌的毒力密切相关。在细胞质中,Lon 和Clp 是发挥蛋白水解作用的主要蛋白酶,可通过降解毒力调控因子直接参与调控毒力,也可调控细菌在不利环境中的耐受能力,从而间接影响毒力。在布鲁氏菌中,研究表明,Lon 蛋白酶与布鲁氏菌抵御多种应激环境密切相关。除此之外,Lon 蛋白酶功能的缺失还会影响布鲁氏菌对小鼠的早期感染[7-8]。然而,在布鲁氏菌中,ClpP 蛋白酶的功能一直是未知的。本研究首次构建了牛种布鲁氏菌clpP基因缺失菌株,并通过巨噬细胞感染试验和小鼠模型感染试验,证明了ClpP 蛋白酶与布鲁氏菌毒力密切相关。

表2 clpP 基因缺失株免疫保护力测定结果
疫苗免疫是防控家畜布病的重要手段。但是目前国内使用的布鲁氏菌疫苗均存在对人有感染风险、干扰血清学鉴别诊断等缺点。因此,研究人员利用分子生物学技术,尝试对疫苗株进行改造,在不影响疫苗株免疫原性的前提下,提高其安全性,并使其具有成为分子标记从而进行鉴别诊断的潜力。本研究发现,clpP基因缺失株的毒力显著低于亲本菌株2308,并且在小鼠体内存活时间也短于A19 疫苗株,并且不引起小鼠脾脏肿胀,说明相比A19 疫苗株,clpP基因缺失株的安全性得到显著提升,但是clpP基因缺失株免疫小鼠后抵抗同源和异源攻毒能力却明显低于A19 疫苗株。
布鲁氏菌是一种胞内寄生菌,宿主在抗布鲁氏菌感染的过程中,细胞免疫发挥了主要作用,体液免疫发挥次要作用[9]。因此,一种优秀的布鲁氏菌疫苗除了不形成持续性感染,还应能在宿主体内存活一定时间,从而充分激活机体的细胞免疫反应[10]。clpP基因缺失株很可能是由于过快地被宿主清除,无法激发机体产生足够的细胞免疫反应,所以无法保护小鼠抵御布鲁氏菌同源菌株和异源菌株的感染。

