溶胶-凝胶法设计与制备金属及合金纳米材料的研究进展
王庆庆,王锦玲,姜胜祥,李平云
南京理工大学化工学院,国家特种超细粉体工程技术研究中心,南京 210094
1 引言
溶胶-凝胶(Sol-gel)法是广泛应用于制备无机功能材料的一种传统化学方法,制备的氧化物、硫化物等功能材料可广泛地应用于介电、铁电,高温超导、磁性以及生物医用材料等领域。溶胶(Sol)是具有液体特征的胶体体系,分散的胶体粒子(1-1000 nm)是固体或者大分子。凝胶(Gel)是具有固体特征的胶体体系,被分散的物质形成连续的网状骨架,骨架空隙中充有液体或气体,凝胶中分散相的含量很低,一般在1%–3%之间。1846年,Elbelmen首次采用该方法制备出SiO2材料1。但是,当时由于凝胶干燥的步骤所需的时间较长,Solgel法的实际应用价值并没有获得认可。自20世纪30年代以来,干燥的时间大为缩短,使得Sol-gel法不仅得到学术界和工业界的广泛关注,其应用领域也不断得到发展。在Sol-gel法中,不同组份能达到分子级的均匀混合,在高温煅烧时,不同组份之间的相互扩散可以得到复杂成份的化合物,特别是含多种成份的化合物2–4。正因为如此,Sol-gel法首先应用于氧化物领域,特别是含复杂组份的氧化物领域3。例如,在制备YFeO3硬磁材料时,根据Y2O3-Fe2O3的二元相图5,Y与Fe的原子比例必须严格等于1 : 1,否则材料中会含有Y2O3或者Fe2O3杂质。此时,采用Sol-gel法可以得到单相无杂质的YFeO3硬磁材料。除了氧化物体系,在20世纪80年代,Sol-gel法又被应用于制备含有多组份的微晶玻璃6,从而显著地拓展Sol-gel法的应用领域范围。此外,传统的Stöber方法可以制备出尺寸均匀的SiO2微球,将Stöber方法稍加拓展,可以制备出尺寸均匀的碳球,且该材料对氧还原反应具有较好的催化效果7。
最近十年以来的研究结果表明:Sol-gel法的应用领域还可拓展至金属纳米材料8–20。例如,南京大学都有为院士课题组采用柠檬酸等为螯合剂,制备出FePt薄膜8,9以及Ni3Fe10、Ni11纳米粒子。南京大学杨绍光教授课题组也采用溶胶-凝胶法制备出Ni12–14、Co13、Fe15、Bi13、Sb13、Cu13、Co-Ni13,16、Ag-Ni17、Fe-Co14,18、FePt19等金属纳米材料。李平云等也采用溶胶-凝胶法制备Ni20–28、Co21、Cu20,21、Bi21、Sb21、Te21、Pt20、Pd20、Ag20,21,23、Cd21、Sn21、Cu3Pt20、Ni-Pt20、Ni3Sn22、Ni3Fe29,30、Ni-Co29金属粉体材料以及Ni-Te、Ag2Te、Co-Te、CdTe、Bi2Te3、Sb2Te3等由金属-半金属组成的半导体纳米材料21,并提出了使用该方法设计制备金属纳米材料的热力学原理21。此外,吉林师范大学杨景海等研究者也采用溶胶-凝胶法制备Ni31–33、CoPt34–38、Fe-Pt39–42金属纳米材料。国外学者也采用该方法制备Ni43–51、Co52、Cu45,50,53、Ni-Cu50,54等金属纳米材料。武汉理工大学傅正义等研究者采用溶胶-凝胶法制备CoCrCuNiAl高熵合金纳米材料55。本文在前期研究工作的基础上,针对溶胶-凝胶法设计制备金属材料的实验路线及原理以及材料的性能与应用方面进行简要综述,以期抛砖引玉。
2 溶胶-凝胶法的一般实施路线
溶胶-凝胶法的实施过程中,首先是将金属盐(如金属醇盐、硝酸盐、乙酸盐等)溶解在溶剂中,其中溶剂可为有机溶剂、水溶剂及有机溶剂与水溶剂共存的混合溶剂。然后使溶剂逐渐挥发形成溶胶和凝胶,最后对干凝胶进行热处理得到目标产物。目前已发现若干种体系可以形成溶胶和凝胶。例如,正硅酸乙脂及金属醇盐(如异丙醇钛、异丙醇铝和异丙醇锆)的水解缩聚可形成溶胶和凝胶,并制备等氧化物。由于Si、Ti、Al与O的结合能力较强,目前尚未有使用Sol-gel法制备金属Si、Al、Zr的报导。此外,某些金属难以形成金属醇盐。此时可采用金属无机盐代替有机盐,相应可使用柠檬酸、乙二胺四乙酸(EDTA)、抗坏血酸等配位能力较强的有机酸作为螯合剂,再加上少量的分散剂(例如:聚乙烯吡咯烷酮、十六烷基三甲基溴化铵、十二烷基硫酸钠等)。如图1所示,溶剂可为水溶剂,也可使用乙醇、丙酮、正丙醇、异丙醇、乙二醇等为有机溶剂。首先将各种物质在溶剂中均匀混合物。然后使溶剂蒸发形成稳定的溶胶,此时溶液的粘度逐渐增加,并逐渐形成溶胶和凝胶,待溶剂完全蒸发后,形成干凝胶,随后将干凝胶煅烧。当在空气中煅烧时,最终形成氧化物材料,这种实验路线也是传统的溶胶-凝胶法制备氧化物材料的实验实施方案。当在保护性气氛(氮气、氩气以及H2、Ar/H2等还原性气氛)中煅烧时,可以制备Ni、Co、Te以及Ni-Fe、Ni-Co等合金金属材料12–42。此外,也有研究工作表明,将前驱体溶液或者干燥的前驱体在空气中点燃或放入预先升温的马弗炉中时,在一定的温度范围内也能得到Ni43,44,46–51、Cu50,53、Co52金属纳米材料。但是,在较高温度下金属纳米材料转变为氧化物材料。例如,Trusov等45的研究工作表明,采用甘氨酸为螯合剂(甘氨酸与硝酸镍的摩尔比为2 : 1)时,在空气中燃烧的产物为Ni和NiO。以柠檬酸60–62、丙三醇61、丙氨酸61为螯合剂时,在空气中热处理时,也只能得到Ni和NiO的混合物。
溶胶-凝胶法的重点在于形成稳定的溶胶和凝胶。为此,在选择实验路线时应合理选择金属盐、溶剂与螯合剂。一般而言,硝酸盐与乙酸盐可有效地溶解于水溶剂,金属有机化合物(如乙酰丙酮化合物)可有效地溶解于有机溶剂(乙醇、丙酮、乙二醇、N,N-二甲基甲酰胺等)。螯合剂的选择范围比较广泛。目前,大多数研究者都选用柠檬酸作为螯合剂12–19,31–42,我们的研究工作则表明20–30,具有配位能力的有机酸(如抗坏血酸、乳酸、丙酮酸、葡萄糖酸、焦性没食子酸、EDTA等)、糖类(葡萄糖、果糖、麦芽糖、蔗糖、核糖、乳糖、半乳糖、木糖、棉子糖、菊糖、环糊精等)、多元醇类(乙二醇、1,2-丙二醇、丙三醇、季戊四醇等)、胺类(甲酰胺、乙二胺、三乙醇胺、N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、丙烯酰胺等)、间苯二酚、大分子物质如明胶、可溶性淀粉、羧甲基纤维素、壳聚糖等都可作为制备金属Ni的“螯合剂”。但是将这些物质应用于制备其它金属纳米材料时,可能存在问题。例如,葡萄糖具有一定的还原性,可以与硝酸银发生银镜反应。此时,葡萄糖的螯合效应得到抑制。柠檬酸也有一定的还原性,也有研究者报导利用柠檬酸在溶液中还原硝酸银63和[PdCl4]2-离子64,此时柠檬酸的螯合效应也得到抑制。其原因在于,金属离子在水溶液中的标准电极电位(Standard electrode potential,SEP)有所不同21。Ni2+离子的SEP为-0.2363 V,而Ag+离子的SEP为0.7991 V65,因此,Ni2+离子难以被螯合剂还原,此时螯合剂的还原性得到抑制,显示出螯合效应。而对于Ag+离子,螯合剂的螯合效应得到抑制,显示出还原性。因此,对于不同的金属元素,应选择不同的螯合剂。螯合剂的SEP应大于金属离子的SEP,此时螯合剂的还原性可以得到抑制。但是,各种有机物的SEP尚无手册可供检索,此时螯合剂的选择可能更多依赖于研究者的经验。除了螯合体系,其它体系如间苯二酚-甲醛体系、环氧树脂体系等也可形成稳定的溶胶和凝胶66。但是,相应的实验报导还较为少见,实验研究也值得探索。因此,本文的论述重点在于基于螯合效应且在气氛保护下的溶胶-凝胶法制备金属纳米材料。
3 溶胶-凝胶法制备的不同金属纳米材料
如前所述,采用不同的螯合剂可制备不同的金属纳米材料。表1简要归纳采用溶胶-凝胶法制备的不同金属纳米材料。可以看出,目前,采用sol-gel法制备的金属纳米材料主要包括Ni 11–14,20–29,31–33,43–51、Co13,21、Cu20,21,45,50,53、Bi13,21、Sb21、Te21、Ag21、Pt20、Pd20、Cd21、Sn21及Ni-Cu50,54、NiCo13,29、Ni-Pt20、Cu-Pt20、Bi-Sb21、Ni3Sn22、Ni3Fe10,21,29,30、Bi2Te321、Sb2Te321、Ag2Te21、NiTe1.521、、SnTe21、SnSb21、CoTe221、CdTe21、CoPt (含掺杂)34–38、Fe-Pt (含掺杂)8,9,19,39–42、、、CoCrCuNiAl55等金属纳米材料。其中研究最多的是Ni纳米材料。以下分别予以介绍。
3.1 单质金属纳米材料
Ni纳米材料由于具有优异的磁学性能11与催化性能67而受到研究者的广泛关注。2009年,南京大学杨绍光课题组报导使用柠檬酸为螯合剂制备Ni、Co、Cu、Ag、Bi及Co0.5Ni0.5纳米金属粒子13。其X射线衍射(XRD)测试结果如图2所示。其中,各种金属元素的衍射峰均对应于相应的标准物质的衍射峰,且没有第二相的杂质衍射峰出现。Co,Ni,Cu,Ag的物相结构均为面心立方(fcc)结构。Ni纳米粒子的晶粒尺寸在10–25 nm范围之间13。差热分析、质谱分析的结果表明13,在200–300 °C的温度范围内,出现放热反应峰以及H2和CH4、H2O、NO、CO2、NH3、NO2等气体。其中,H2、CH4、和NH3都具有一定的还原性。因此,还原性气体与氧化物的还原反应被认为是形成金属纳米材料的关键因素13。但是,应指出的是,柠檬酸有一定的还原性62。因此在图2中,Ag的形成更有可能来源于柠檬酸在溶液中直接还原Ag+离子,而并非形成溶胶与凝胶以及随后的热处理过程。
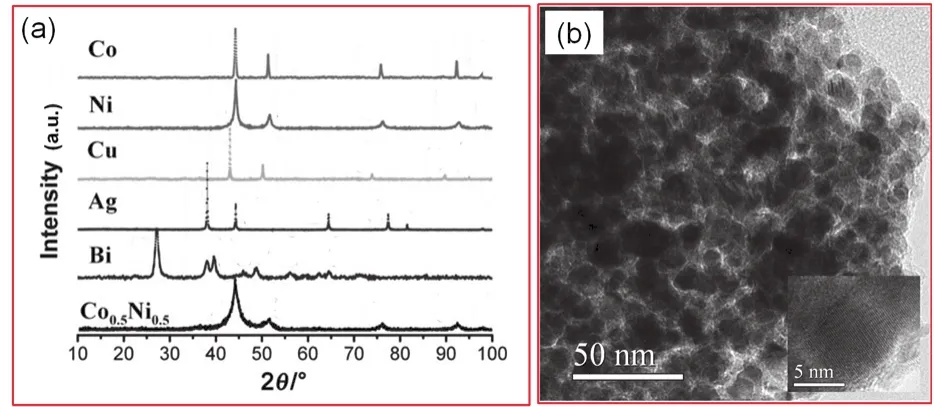
图2 采用柠檬酸为螯合剂制备的Co,Ni,Cu,Ag,Bi及Co0.5Ni0.5纳米粒子的X射线衍射(XRD)测试结果(a)及Co0.5Ni0.5纳米粒子的透射电子显微镜(TEM)图片(b) 13Fig.2 XRD profiles of Co, Ni, Cu, Ag, Bi and Co0.5Ni0.5 nanoparticles (a) and TEM images of Co0.5Ni0.5 nanoparticles prepared by using citric acid mediated sol-gel process 13.Adapted from John Wiley and Sons publisher.
随后,研究者对溶胶-凝胶法的实验技术路线开展研究。李平云等的研究结果表明20–30,溶胶-凝胶法既可在水溶液中实施,也可在乙醇、丙酮、正丙醇、异丙醇、N,N-二甲基甲酰胺等溶液中实施。螯合剂的选择也不仅限于柠檬酸,而是包含诸如有机酸、多元醇、醛、糖、胺、酚及明胶、淀粉等大分子物质,从而拓展该方法的实验技术路线。以最简单的乙二醇为例,当硝酸镍与乙二醇的摩尔比为1 : 1时,在水溶液中即可形成稳定的溶胶。最终在不同温度下热处理得到的样品的XRD测试结果如图3所示。其中,当热处理温度为350 °C时,出现的衍射峰与热处理温度为450和550 °C时出现的衍射峰不同。目前,研究者一般认为前者表明制备的Ni的物相为亚稳态的密排六方(hcp)结构,而后两者则表明制备的Ni的物相为稳定的面心立方(fcc)结构。类似的实验结果在表1中也多次出现。但是,应该注意,hcp结构的Ni的衍射角与四方结构的Ni3Cx的衍射角的差别低于0.4°,而且50°以下的衍射峰对应的衍射角度的差别低于0.1°,两者极为接近68。因此,仅仅通过XRD还不能确定在350 °C热处理的样品的物相结构68。预计可以通过改变硝酸镍与乙二醇的摩尔比以确定物相结构,因为hcp Ni的衍射角并不变化,而Ni3Cx的衍射角则随C含量的不同而有微弱变化69。图4a–d表示分别以柠檬酸(图a、c)、邻苯二酚(图b),戊二醛(图d)为螯合剂,溶剂为去离子水图(a、b)和乙醇(图c、d),采用溶胶-凝胶法在不同温度下热处理后得到的产物的XRD图案。从图4可知,改变螯合剂及溶剂种类时,都可得到fcc结构的Ni纳米材料。
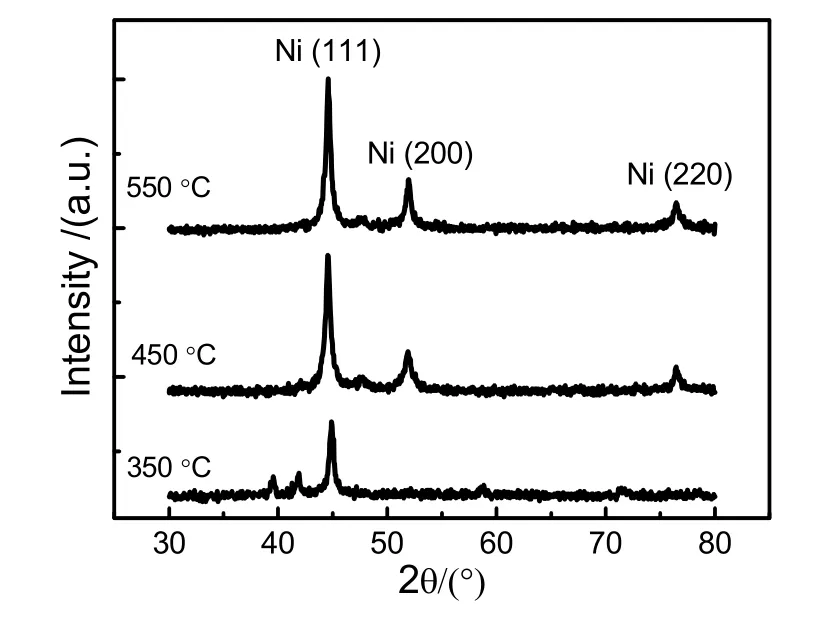
图3 以乙二醇为螯合剂(硝酸镍与乙二醇的摩尔比为1 : 1)时在不同温度下煅烧的产物的XRD谱图Fig. 3 XRD profiles of the products being calcinated at different temperatures by applying ethylene glycol mediated Sol-gel process where the molar ratio of Ni(NO3)2·6H2O: ethylene glycol is 1 : 1.
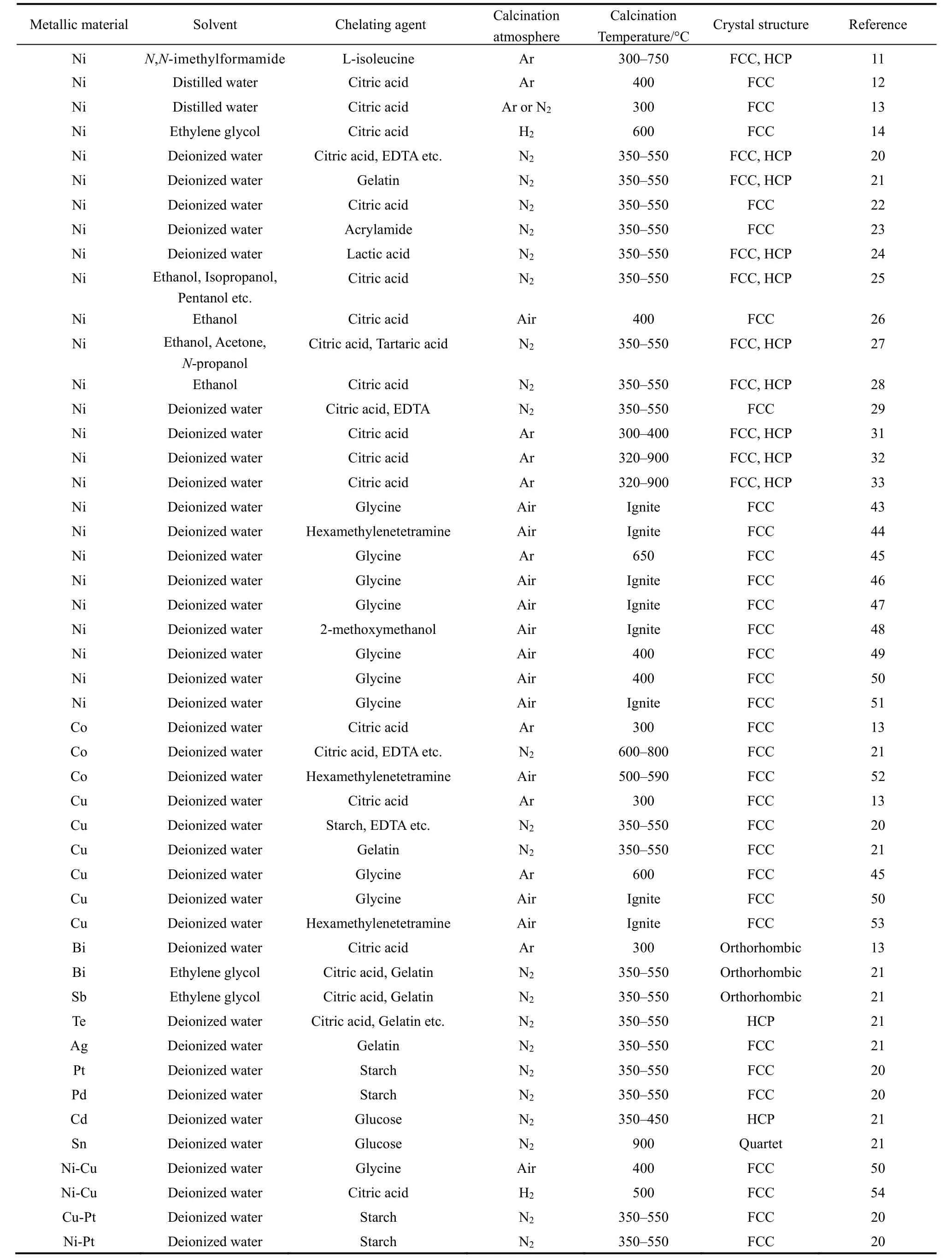
表1 溶胶-凝胶法制备的金属材料Table 1 Metallic nanocrystals being prepared by Sol-gel method.
对纳米金属Ni,螯合剂选择范围较为广泛的原因在于Ni2+离子的SEP较低(-0.2363 V),鉴于此,研究者也采用溶胶-凝胶法制备Cu、Bi、Sb、Te、Ag、Pd、Pt等金属纳米材料。以Ag为例,Ag+离子的SEP为0.7991 V64。因此,某些有机物质可能直接将Ag+离子在水溶液中还原。例如,柠檬酸可将Ag+离子在水溶液中还原(图5a)。煅烧后的样品中也含有Ag,但是Ag的形成不能归因于形成溶胶和凝胶以及煅烧过程,而是柠檬酸的还原性。但是,以乳酸为螯合剂,吐温20为分散剂时,乳酸却不能将Ag+离子在水溶液中还原(图5b),而只有在煅烧过程中形成fcc结构的Ag的晶相(图5b)。因此,在选择螯合剂时,应考虑降低螯合剂的还原性,使其还原性得到抑制。
为抑制螯合剂的还原性,可选择还原性较弱的大分子物质,如可溶性淀粉、明胶等。图6是使用可溶性淀粉为螯合剂,制备的Ag、Pt、Pd、Cu、Ni纳米粒子的XRD测试结果。在该图中,Ag、Pt、Pd、Cu、Ni的衍射峰均对应于相应的fcc结构的物质的衍射峰。此外,降低金属离子在水溶液中的SEP也可能是防止金属离子被直接还原的方法之一。例如,通过形成配合物可使金属离子的SEP得以降低。但是,相应的实验结果报导还较为少见。
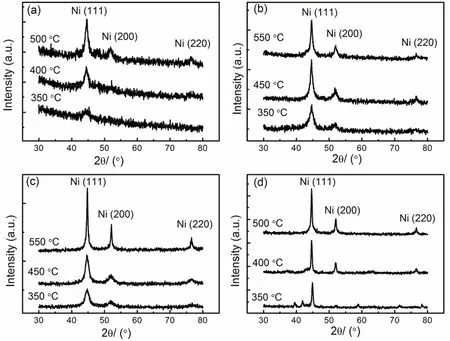
图4 溶胶-凝胶法制备的Ni纳米粒子的XRD谱图。(a)以阿拉伯糖为螯合剂,硝酸镍为镍源,去离子水为溶剂,聚乙烯吡咯烷酮(PVP、K-30)为分散剂;(b)以邻苯二酚为螯合剂,硝酸镍为镍源,去离子水为溶剂,PVP为分散剂;(c)以柠檬酸为螯合剂,乙酰丙酮镍为镍源,无水乙醇为溶剂,十八胺为分散剂;(d)以戊二醛为螯合剂,乙酰丙酮镍为镍源,tween 20为分散剂,无水乙醇为溶剂Fig. 4 XRD analysis results of Ni nanocrystals being calcinated at different temperatures by using sol-gel process.(a) L-arabinise was chelating agent, Ni(NO3)2·6H2O was nickel source, PVP was surfactant, and solvent was de-ionized water;(b) 1,2-benzenediol was chelating agent, Ni(NO3)2·6H2O was nickel source, PVP was surfactant, and solvent was de-ionized water; (c) citric acid was chelating agent, Ni(acac)2 was nickel source, octadecylamine was surfactant, and solvent was absolute ethanol. (d) glutaraldyde was chelating agent, Ni(acac)2 was nickel source, tween 20 was surfactant, and solvent was absolute ethanol.
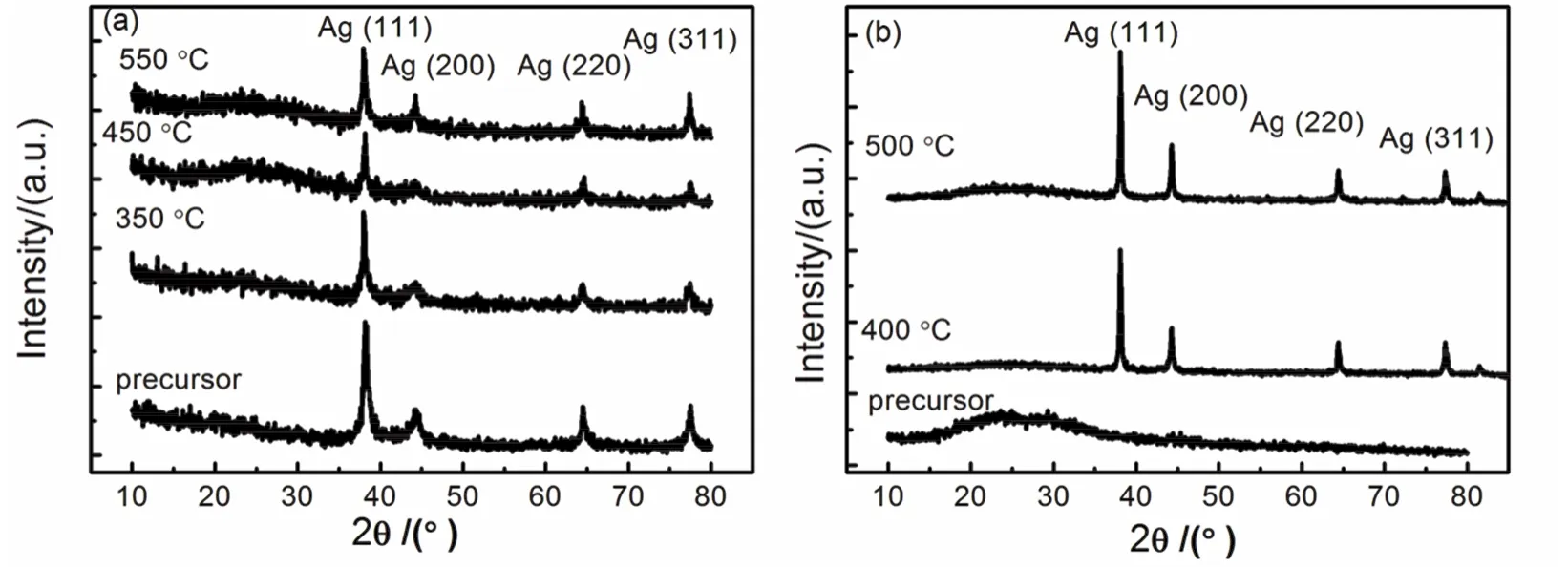
图5 分别以柠檬酸(a)和乳酸(b)为螯合剂、去离子水和硝酸银为溶剂和溶质、吐温20为分散剂时的前驱体与煅烧产物的XRD谱图时在不同温度下煅烧的产物的XRD谱图Fig. 5 XRD profiles of the precursors and products being calcinated at different temperatures by applying citric acid (a) and lactic acid (b) as chelating agent, de-ionized water and AgNO3 as solvent and solute, tween 20 as surfactant, respectively.
此外,Bi13,21、Sb21、Te21半金属纳米材料的制备也有所报导,热处理温度在350 °C即能出现相应的物相,而且也没有氧化物等杂质,螯合剂也可选择为可溶性淀粉、柠檬酸及明胶21。如图7所示,以琼脂为螯合剂时,琼脂和碲酸可以形成溶胶和凝胶,前驱体的XRD测试结果中没有出现衍射峰,只有在煅烧后的产物中出现Te的衍射峰。溶胶-凝胶法也能制备物相结构为纯Cd和纯Sn金属粉体21。但是,目前只有采用葡萄糖为螯合剂时才能通过煅烧得到纯Cd,而纯Sn的金属相只有在煅烧温度为900 °C时才能出现21,在热处理温度为350和450 °C时,产物中只出现SnO2氧化物,在温度为550 °C时,部分SnO2转变为Sn21,表明在热处理过程中,首先是出现氧化物,然后氧化物逐渐转变成相应的金属单质。
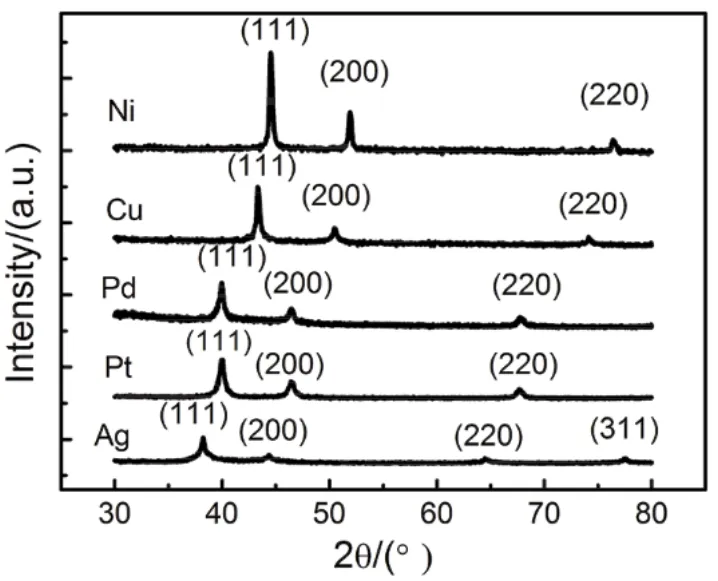
图6 使用可溶性淀粉为螯合剂,去离子水为溶剂,制备的Ag、Pt、Pd、Cu、Ni纳米粒子的XRD谱图20Fig. 6 XRD patterns of the Ag, Pt, Pd, Cu, Ni nanocrystals prepared by using starch as chelating agent, de-ionized water as solvent 20.Adapted from Royal Society Chemistry publisher.
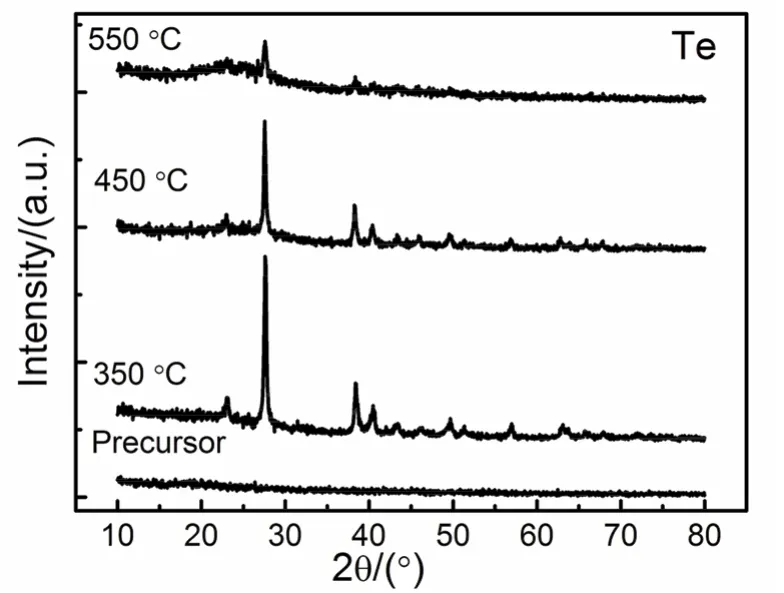
图7 使用琼脂为螯合剂,去离子水和碲酸为溶剂和溶质,煅烧的产物的XRD谱图Fig. 7 XRD patterns of the precursor and products being calcinated at different temperatures by employing agar as chelating agent, de-ionized and H6TeO6 as solvent and solute.
3.2 合金纳米材料
与单组份的金属纳米材料相比,合金纳米材料的成份及性能可在一定组成范围内调控,因此也获得了较为广泛的关注。形成合金纳米材料的关键在于不同的金属元素之间达到化学键合。该目标在传统的溶液还原法中难以达到70,71。原因在于不同金属离子的SEP一般不相同,因此在水溶液中还原时,SEP相对较高的金属离子可能首先被还原,然后SEP相对较低的金属离子被还原,第二种被还原的金属可能在第一种被还原的金属的表面生长形成核-壳结构,也有可能两种不同的金属原子具有明确的界面形成异质结构(heterogeneous structure)71。为促使形成合金物相,可对核-壳结构或异质结构的产物进行热处理,增强金属元素的扩散系数。如需得到物相结构为有序相的合金纳米材料,热处理温度可能高于700 °C72,但此时可能不可避免出现晶粒生长。在溶胶-凝胶法中,当选择合适的螯合剂时,不同的金属离子与螯合剂形成配合物,从而达到化学键合,可能只需在较低温度下热处理时即可形成合金相,特别是物相结构为有序相的合金相。例如,采用柠檬酸为螯合剂,可以在350–550 °C的温度范围内制备出晶粒尺寸低于10 nm的Ni3Fe合金纳米粒子,且合金的物相为热力学稳定的有序相29,30,在450–550 °C的温度范围内也可制备出晶粒尺寸为30–50 nm的Ni3Sn合金纳米粒子22。但是,对于含贵金属的二元合金体系,考虑到柠檬酸的还原性,为在较低温度下制备出二元纳米合金,需要选用还原性较弱的大分子物质如淀粉、明胶等为螯合剂。图8表示以可溶性淀粉为螯合剂、去离子水为溶剂,在350–550 °C的温度范围内煅烧得到的Cu3Pt纳米粒子的XRD图谱20。在图8中,除了出现常规的(111)、(200)、(220)等对应于fcc结构的衍射峰外,还出现(100)、(110)、(210)、(211)、(300)超结构衍射峰,表明该Cu3Pt纳米粒子的结晶物相为热力学稳定的有序fcc相。此外,以淀粉为螯合剂还可制备Ni-Pd、Ni-Pt合金纳米粒子20。
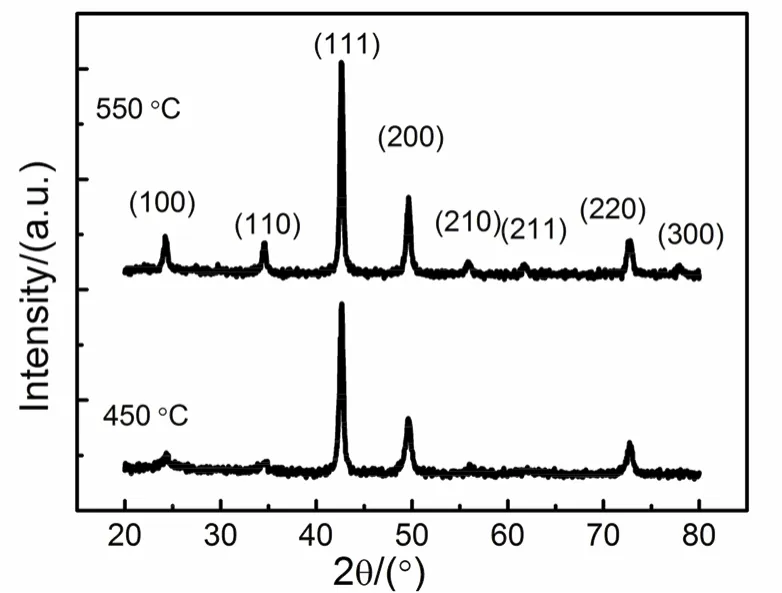
图8 使用可溶性淀粉为螯合剂,去离子水为溶剂,煅烧的Cu3Pt产物的XRD谱图20Fig. 8 XRD patterns of the Cu3Pt products being calcinated at different temperatures by employing starch as chelating agent, de-ionized as solvent 20.Adapted from Royal Society Chemistry publisher.
物相结构为有序相的L10结构的FePt、CoPt纳米合金是典型的硬磁材料,其矫顽力可高达20 kOe73,因此受到各国学者的广泛关注。目前,可采用多元醇还原乙酰丙酮铂和羰基合铁以及羰基合钴的热分解方法予以制备FePt、CoPt纳米合金粒子74,75。溶胶-凝胶法也可制备FePt8,9,39–42、CoPt34–38纳米粒子,其实验过程无需使用毒性较大的羰基化合物,因此显示出一定的优势。例如,使用甘氨酸为螯合剂,以去离子水为溶剂,在氩气保护下,在700 °C热处理可以制备物相结构为L10相的FePt纳米粒子19。透射电子显微镜(TEM)的测试结果表明(图9),FePt纳米粒子的平均晶粒尺寸为20 nm,且选区电子衍射(SAED)测试结果也出现(001)和(110)超结构衍射环,证明该FePt纳米粒子的物相结构为L10有序相19。此外,采用柠檬酸为螯合剂也可制备FePt8,9,39–42、 CoPt35–38纳米粒子,当在Ar保护性气氛下热处理时,热处理温度一般需要大于600 °C。但是,由于柠檬酸和甘氨酸具有一定的还原性,产生FePt、CoPt纳米粒子的机理尚需深入探讨。目前,采用弱还原性物质如淀粉、明胶等制备FePt、CoPt纳米粒子的研究尚未见报导。由于明胶、淀粉等与不同金属离子相互键合,预计可能在较低温度下(350–550 °C)得到L10结构的FePt和CoPt纳米粒子。
最近,原子比例为1 : 1 : 1的高熵合金由于具有优异的力学、磁学等性能也受到学术界的广泛关注76。高熵合金一般含有三种以上金属元素。2017年,有报导首次指出,采用柠檬酸为螯合剂,在氢气气氛下热处理时,可在300 °C的温度下制备出CoCrCuNiAl及CoCrCuNi高熵合金纳米粒子66。其中,CoCrCuNiAl高熵合金纳米粒子的物相结构为fcc + bcc (体心立方结构)相(图10a),晶粒尺寸分布范围为6–24 nm (图10b),CoCrCuNi高熵合金的物相结构为fcc相,且表现出典型的软磁行为66。该报导将溶胶-凝胶法的应用范围拓展至四元、五元纳米合金,从而显著扩展该方法的研究领域。
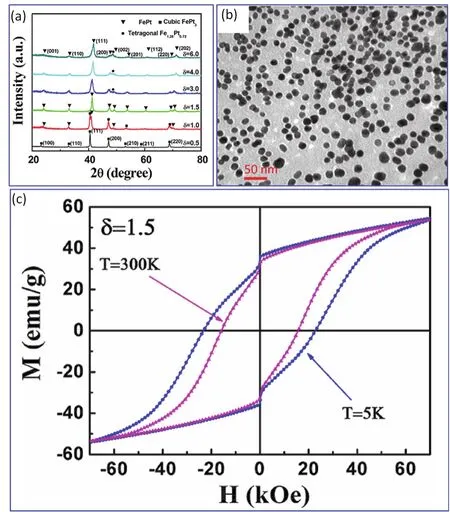
图9 使用甘氨酸为螯合剂,去离子水为溶剂,煅烧的FePt产物的XRD测试结果(a),TEM图像(b)及室温磁滞回线测试结果(c) 19Fig. 9 XRD profiles (a), TEM image (b) and room temperature magnetic hysteresis loop (c) of FePt nanocrystals being calcinated at 700 °C by using glycine as chelating agent, de-ionized as solvent 19.Adapted from American Institute of Physics publisher.
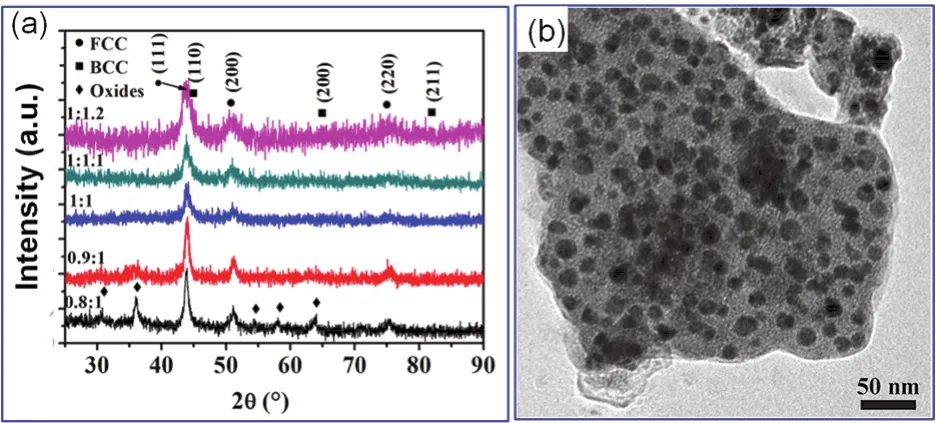
图10 使用柠檬酸为螯合剂,去离子水为溶剂,在氢气气氛下300 °C下煅烧的CoCrCuNiAl纳米粒子的XRD测试结果(a)及TEM图像(b) 76Fig. 10 XRD analysis results (a) and TEM image (b) of CoCrCuNiAl nanocrystals being calcinated at 300 °C by using citric acid as chelating agent, de-ionized as solvent 76.Adapted from Nature publisher.
4 溶胶-凝胶法形成金属纳米材料的机理
目前,溶胶-凝胶法能用于制备Ni、Cu、Ag、Pt、Pd等金属元素的纳米材料。相应的问题在于,该方法是否具有一定的普适性,以及该方法能够设计制备的金属纳米材料的种类。该问题涉及到溶胶-凝胶法制备金属纳米材料的内在机理。考虑到金属纳米材料的制备可能与金属元素的电负性相关77,78,我们首先考虑电负性的因素。根据鲍林标度的经典的电负性数据表64,Fe、Ni、Cu、Bi、Sb、Ag、Pt、Pd、Cd、Sn、Zn的电负性数值分别为1.8、1.91、1.90、2.02、2.05、1.93、2.28、2.20、1.69、1.96、1.65。Cd的电负性数值1.69大于Zn的电负性数值1.65,但是Zn难以被溶胶-凝胶法制备。Fe的电负性数值1.8小于Ni的电负性数值1.91,但是Fe也难以采用溶胶-凝胶法予以制备。因此,在溶胶-凝胶法中,电负性数值并没有显示出明显的规律。采用其它电负性标度值,如Allred-Rochow标度的电负性数值79,也难以发现明显的规律。我们在实验中发现,Ag+、Pd2+离子可以被柠檬酸直接还原为Ag和Pd。由此,金属离子的水溶液中的标准电极电位(亦即SEP)可能也有一定的影响。按照各种金属离子的电极电位表80,Cd2+、Ni2+、Sn4+、SbO+、Bi3+、Cu2+、Ag+、Pd2+、Pt4+、Zn2+离子的SEP分别为-0.403、-0.257、0.008、0.204、0.317、0.340、0.7991、0.951、1.118、-0.7621 V。Zn2+离子的SEP小于Cd2+和Sn4+离子的SEP,但是溶胶-凝胶法难以制备Zn,且制备Sn需要在温度为900 °C。因此,SEP也难以成为溶胶-凝胶法的决定性因素。
杨绍光等13采用质谱手段发现在煅烧过程中在200–300 °C的温度范围内出现H2、CH4等还原性气体,并认为Ni、Cu、Bi等金属相的出现与还原性气体相关。李平云等采用质谱分析的研究结果表明,以柠檬酸为螯合剂时,在室温至600 °C的温度范围内出现H2、CH4、NH3的特征峰20。结合在Sn的实验过程中首先出现SnO2的现象(图7)。我们初步推测,前驱体在保护性气氛下煅烧时,在热处理过程中首先分解出氧化物晶核以及H2、CH4、NH3等还原性气体,然后晶核被还原性气体还原为金属物相。为此,可计算金属氧化物被H2以及其它气体还原的反应的吉布斯自由能的变化量()。以Ni为例,其相应的氧化物与H2的还原反应为:
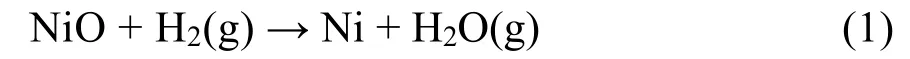
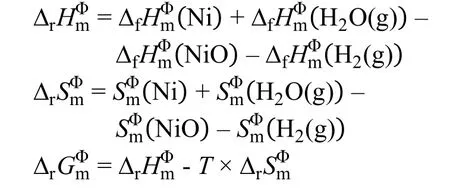
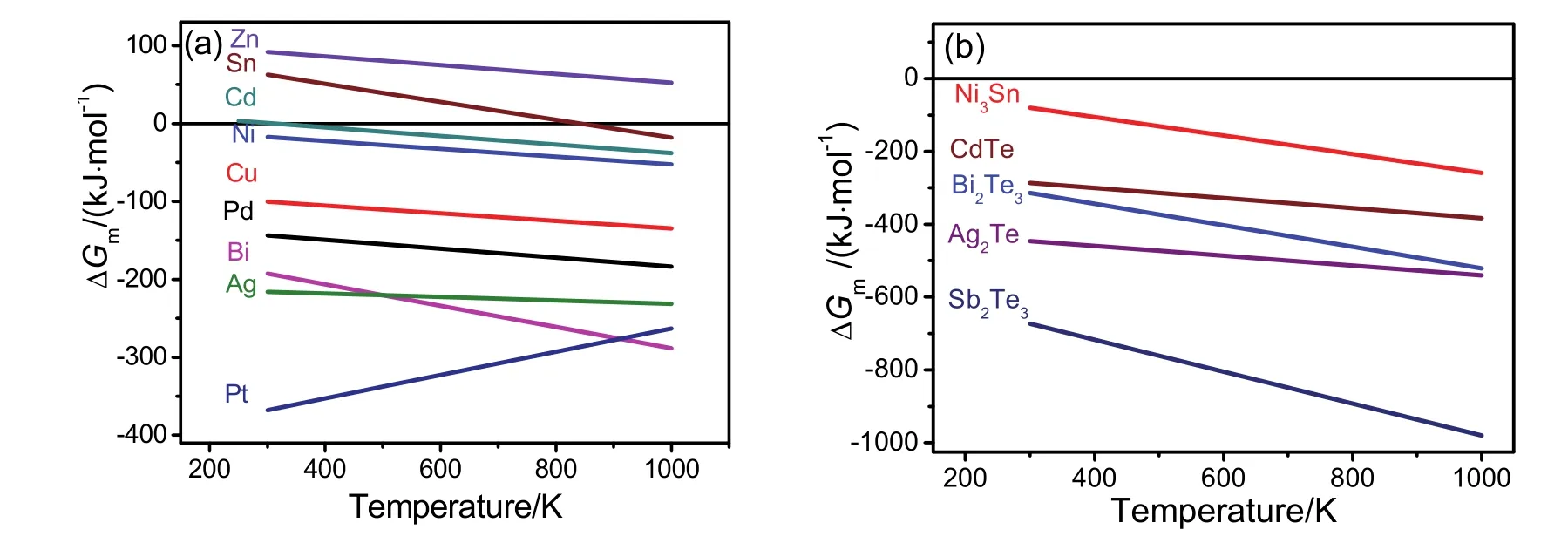
图11 根据热力学原理计算的吉布斯自由能变化量与温度的关系21Fig. 11 Theoretical results of the change of Gibbs free energies based on thermodynamical calculation 21.Adapted from Royal Society Chemistry publisher.
在图11中,Pt的计算结果较为特别,相应的方程式为:
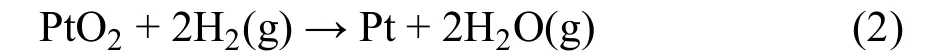
对于Zn、Cd、Sn,也可进行类似的计算。计算结果表明,反应的> 0,且> 0,在此将这种元素归类于第3类金属元素。此时,反应温度需大于某一临界温度也为与的比值),才能使得< 0。对于Cd元素,接近于300 K,因此采用溶胶-凝胶法可在较低温度下得到金属Cd;对于Sn元素,接近于900 K,此时只有在热处理温度高于900 K才能得到金属Sn。在图7c中,温度为900 °C (1173 K)时才出现Sn的衍射峰。因此,Sn的计算结果也能与实验结果相互印证。对于Zn,的计算值为1930 K (1657 °C)。因此,对于金属Zn,溶胶-凝胶法只能制备出ZnO。计算结果表明,几乎其它所有金属元素都可归类于第3类元素。而除了Cd、Sn之外,其它第3类元素的Tc2值一般高于1000 K。因此,第3类元素中,溶胶-凝胶法可能只能制备金属Cd和Sn。表2指出了所有的3类元素。氧化物晶核与其它气体如CH4的反应的的计算结果与图11a所示的结果大致相同。
对于二元体系,也可写出类似于反应式(1)和(2)的还原反应方程式,例如,对应于Bi2Te3的方程式为:

如能检索出Bi2Te3的热力学数据值,则也可采用相同的计算方法计算反应3的,且< 0的判据仍然有效。
图11b为针对Ni3Sn、CdTe、Bi2Te3、Ag2Te、Sb2Te3的计算结果。对于这几种二元体系,<0,且> 0。因此,可以认为,溶胶-凝胶法能够制备这几种二元体系“合金”(CdTe、Bi2Te3、Ag2Te、Sb2Te3实际上应为半导体)纳米材料。事实上,实验结果21,22也与计算结果一致。值得注意的是Ni3Sn与CdTe,其中Sn与Cd都属于第3类元素。Ni3Sn合金相的形成的温度范围可以为450–550 °C,CdTe相的形成的温度范围可为350–550 °C(图12),而且晶粒尺寸为纳米级21。根据以上结果,可以预测,第1类元素之间、第1类元素与第2类元素Pt形成的合金可以采用溶胶-凝胶法予以设计,第1类、第2类元素与第3类元素中的Cd、Sn形成的合金也有可能采用溶胶-凝胶法予以设计。
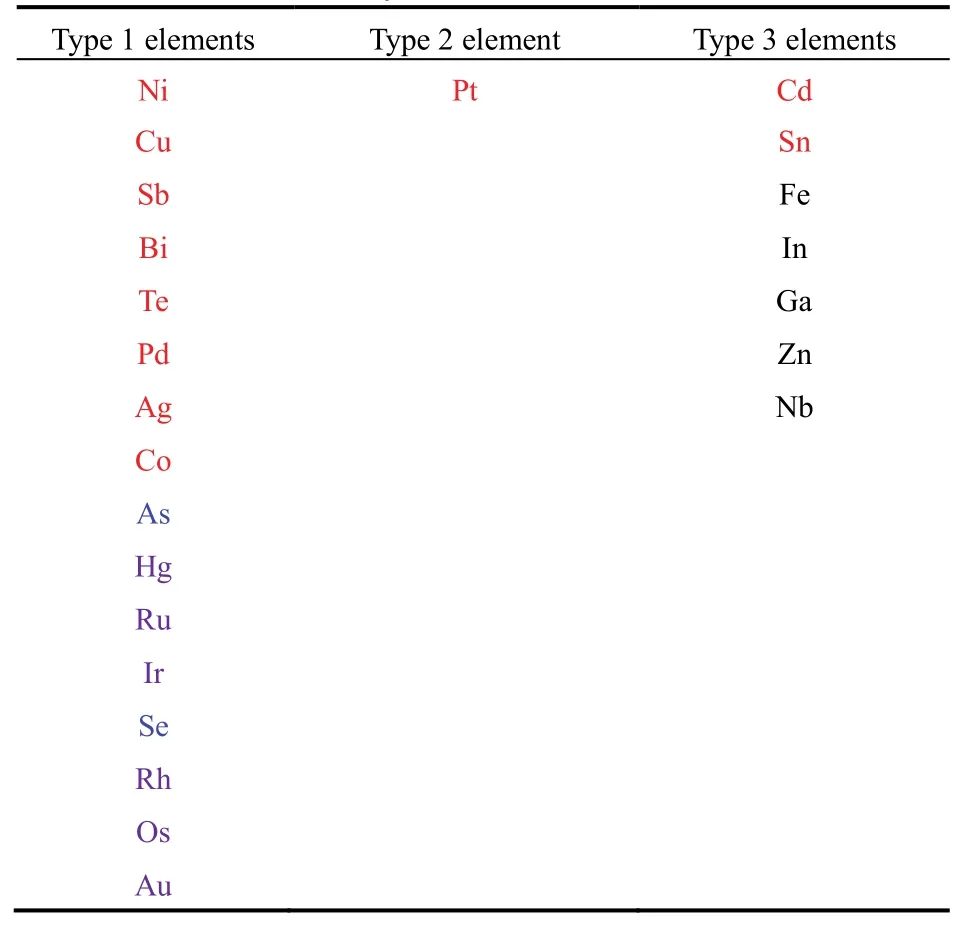
表2 根据热力学计算分类的第1,2,3类元素Table 2 The classification of first, second and third types of metallic elements according to thermodynamical calculation.
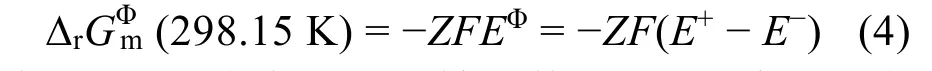
其中,Z是反应中的电子转移数目,F是法拉第常数,EΦ是将反应作为可逆反应的可逆电动势,E+与E-是相应的正极与负极的半反应的电极电位。对于一般的反应:
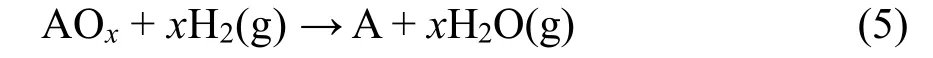
在室温下相应的半反应分别为:
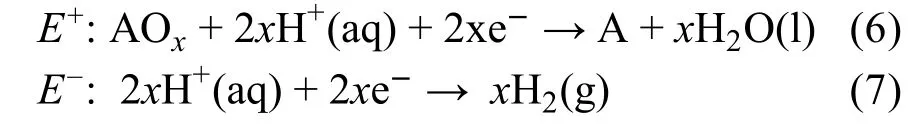
其中,A代表金属元素,E-对应的半反应即为标准的氢电极反应,因此E-= 0 V。从而(298.15 K) = -,因此,< 0就等价于E+> 0。
我们认为E+> 0即为Sol-gel法制备金属纳米材料的热力学判据。根据该判据,可以根据电极电位数据设计制备各种金属纳米材料。例如,TeO2、WO3、SiO2对应的半反应为:
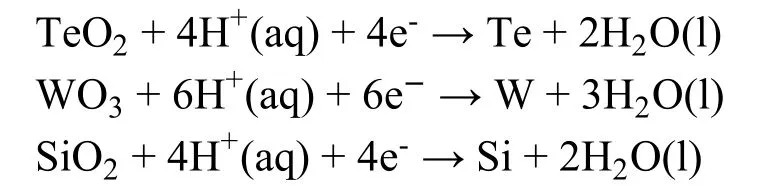
相应的E+分别为0.5285,-0.0909,-0.9754 V64。因此,可以预测,采用溶胶-凝胶法可以制备出Te,而不能得到W和Si,实验结果也与该热力学判据相符。
图13表示溶胶-凝胶法(红色部分)与传统的液相还原法的机理。从图中可以看出,两种方法的主要区别在于:金属离子与还原剂(螯合剂)的标准电极电位的相对大小。对于溶胶-凝胶法,应小于。当较小时(如Ni2+的SEP为-0.257 V),则螯合剂的选择范围应较为广泛。考虑到金属离子与螯合剂的有机官能团形成配合物,螯合剂的选择范围可能不仅限于有机酸、多元醇、醛、胺等化合物。自然界中的各种绿色物质中也含有各种有机官能团,其提取物也有可能作为螯合剂,从而制备金属纳米粒子。图14表示以八角金盘植物的叶子在水溶液中的提取物作为螯合剂,制备的Ni3Fe纳米粒子的XRD测试结果。提取物的制备过程如下:首先称取一定质量的植物的叶子,再将叶子浸泡在水溶剂中,然后使混合物在水溶剂的沸点附近煮沸2–3 h,过滤得到澄清溶液,再加入少量的硝酸银溶液以去除叶子中的氯离子,然后第二次过滤得到的清液即为提取物。在图14中,出现(111)、(200)和(220)晶面的衍射峰,与采用柠檬酸为螯合剂制备的Ni3Fe纳米粒子的XRD测试结果29,30相同。采用植物等绿色物质符合绿色化学的原理。在材料合成85以及能源催化等领域具有较大的应用潜力86。因此,研究在溶胶-凝胶法中采用自然界存在的绿色物质制备及应用金属纳米材料是后续研究的方向之一。
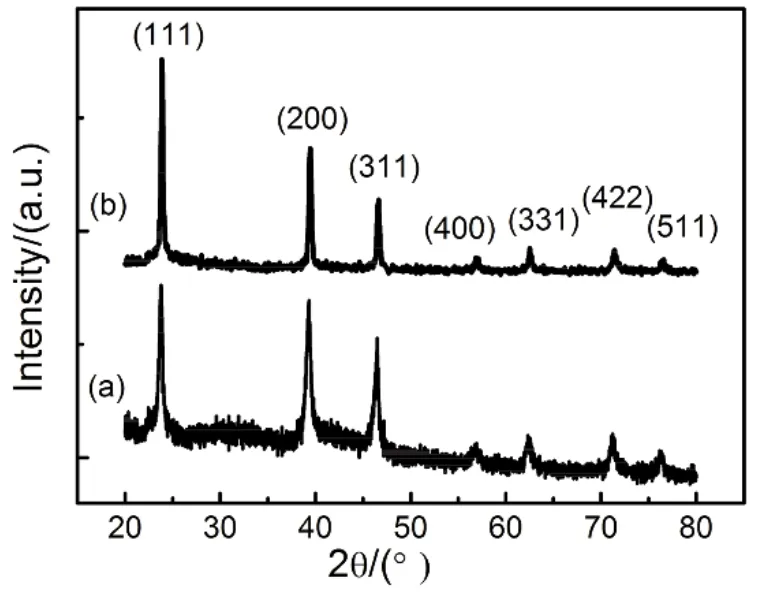
图12 以柠檬酸(a)和明胶(b)为螯合剂,在550 °C(N2气氛)煅烧制备的CdTe纳米材料的XRD测试结果21Fig. 12 XRD patterns of CdTe nanocrystals being calcinated at 550 °C by using citric acid (a) and gelatin (b) as chelating agent 21.Adapted from Royal Society Chemistry publisher.
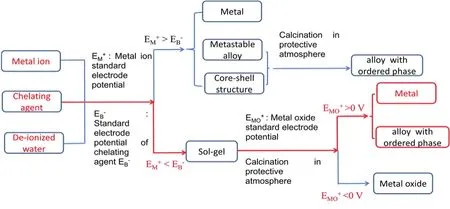
图13 溶胶-凝胶法与传统的液相还原法的原理图21Fig. 13 P rinciples of sol-gel method and conventional liquid phase reducing methods 21.Adapted from Royal Society Chemistry publisher.
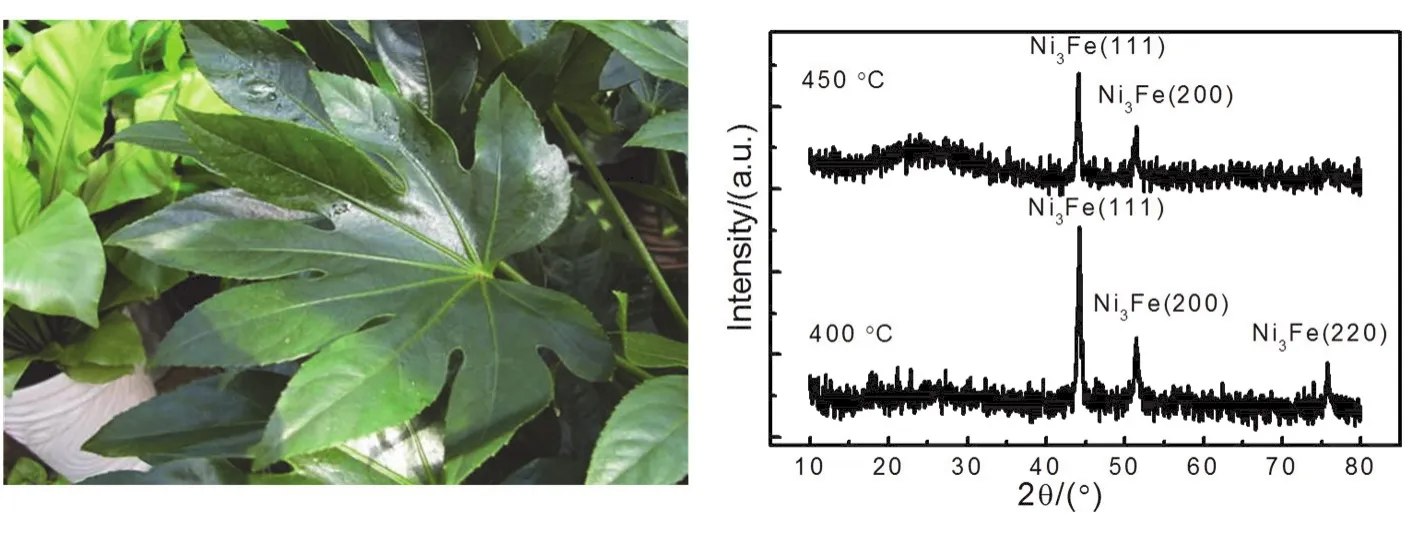
图14 以八角金盘叶子的提取物为螯合剂,制备的Ni3Fe纳米粒子的XRD测试结果Fig. 14 XRD analysis results of Ni3Fe nanocrystals prepared by using extract of leaf of fatsia japonica as chelating agent.
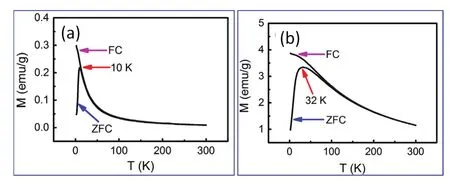
图15 以L-异亮氨酸为螯合剂,在300 °C (a)和750 °C (b)热处理制备的Ni3Fe纳米粒子的磁化强度–温度(M–T)曲线10Fig. 15 Magnetization-temperature (M–T) curves of Ni3Fe nanocrystals being calcinated at 300 °C (a) and 750 °C (b) by using L-isoleucine as chelating agent 10.Adapted from Elsevier publisher.
5 溶胶-凝胶法制备的金属纳米材料的应用
由于溶胶-凝胶法通常应用于制备金属氧化物纳米材料,制备金属纳米材料尚属于较为新颖的研究领域。因此,采用该方法制备的金属纳米材料的应用方面的报导并不多见。以下主要针对金属纳米材料在磁性和催化能源方面的应用予以讨论。
Ni、Co以及Ni-Co、Ni-Fe合金是典型的软磁材料,具有较小的矫顽力。当铁磁性纳米粒子的晶粒尺寸降低到某一临界值以下时,在室温下铁磁性可能会消失,而表现出超顺磁性87。超顺磁性纳米材料在抗菌88、磁共振89等领域已显示出应用潜力。图15表示以L-异亮氨酸为螯合剂,在Ar气保护下,300 (图a)和750 °C (图b)热处理制备的Ni3Fe纳米合金粒子的磁化强度–温度(M–T)曲线10。首先,室温下的磁滞回线测试结果表明,在300 °C制备的Ni3Fe纳米合金粒子,即使是在50 kOe的磁场强度下,磁化强度值也没有达到饱和,而且矫顽力为零,因此该纳米材料显示出明显的超顺磁性10。在图15a中,零场冷却(ZFC)曲线中在10 K处显示一最大值,有场冷却(FC)曲线在10 K以上与ZFC曲线完全重合,在10 K以下则与ZFC曲线分裂,表明该Ni3Fe纳米材料的“冻结温度”(blocking temperature)为10 K,且该纳米材料具有较窄的晶粒尺寸分布。根据冻结温度可计算出磁性纳米材料的磁晶各向异性常数10,90。750 °C制备的Ni3Fe纳米合金粒子在室温下的磁化强度比在300 °C制备的Ni3Fe纳米合金粒子的磁化强度高一个数量级,表明温度升高有利于提高材料的磁化强度值。在图15b中,Ni3Fe纳米粒子也表现出超顺磁性,其冻结温度为32 K,但是在32 K以上的FC曲线和ZFC曲线并不完全重合,表明在750 °C热处理的Ni3Fe纳米粒子有相对较宽的晶粒尺寸分布。李平云等的实验研究表明,采用柠檬酸为螯合剂时,制备的Ni3Fe纳米粒子也显示出超顺磁性,冻结温度约为50 K30。溶胶-凝胶法制备的Ni纳米粒子在室温下也可以显示出超顺磁性12,20,28,在5 K的温度下则表现出铁磁性12。
FePt合金则是典型的硬磁材料,具有较大的矫顽力。但是,FePt合金只有在晶体结构为L10的有序相结构时才能有较好的硬磁性74,当FePt合金的物相结构为无序的fcc结构时,其矫顽力较小,不具备实用的价值。在溶胶-凝胶法中,由于各种组织分均分混合,因此在热处理时能够一步获得晶体结构为L10的有序相,从而使FePt纳米粒子具有较高的矫顽力,得以应用于磁记录材料等领域。图9c表示以甘氨酸为螯合剂,在Ar气保护下,700 °C热处理得到的FePt纳米粒子(图9)的M–H曲线19。在图9c中,300 K时的矫顽力为15.8 kOe,在5 K时的矫顽力为23.2 kOe。以柠檬酸为螯合剂时制备的FePt纳米粒子的矫顽力也能达到10.1 kOe42。
除了材料的磁性之外,金属纳米材料在能源及催化领域可大显身手。例如,Pt/C是传统的析氢91反应及氧还原反应92的催化剂。采用溶胶-凝胶法制备的Pt纳米材料的催化性能还未见报导。此外,由于Pt的价格昂贵,且在地壳中的丰度较低。无贵金属Pt、Pd的催化剂的制备及应用是学术界关注的焦点之一。例如,Co-N-C93,94、Ni-N-C95,96材料对析氢、析氧反应也具有较好的催化性能。其中,C元素一般能导电,N元素则对C元素进行掺杂形成吡啶型和石墨型氮以便于电子传输97,金属元素Ni或者Co则可与N及C元素形成M-N98或MN4C499(M = Ni,Co)等活性中心,此外,金属纳米颗粒还能与导电型碳或者氮掺杂的碳产生协同效应,从而进一步增强催化效果。目前,常见的制备Co-N-C及Ni-N-C材料的制备方法包括金属有机框架(MOFS)的热分解100,101以及含M、N、C的混合物(例如,含有三聚氰胺的混合物102)热解法。在溶胶-凝胶法中,即使是在空气中煅烧前驱体时,也需要在高于800 °C的温度才能完全去除碳元素103。因此,采用保护性气氛热处理时,不可避免会有碳元素的存在20。在图9、图10中,纳米粒子分布于一层“衬底”上,可认为“衬底”主要由碳元素所组成。如在溶胶-凝胶法中引入N元素,则有可能制备出Ni-N-C及Co-N-C催化剂。但是,关于这方面的研究目前仅有零星的报导104–113,相关的研究还处于起步阶段。
2015年,包信和院士等采用EDTA四钠盐制备CoNi@NC材料(NC为N掺杂的C材料),并研究其对析氢反应的催化性能104。其实验过程如图16a–d所示。首先将硝酸钴、硝酸镍、EDTA四钠盐溶解于水和甲醇的混合溶剂,然后将溶液密封于40 mL的不锈钢反应釜中,在200 °C处理24 h,待温度降低至室温后再使沉淀物过滤、水洗及在100 °C干燥。得到的复合物称为“EDTA-CoNi”,然后在425–600 °C的温度范围内煅烧(Ar气气氛)3 h。最后在90 °C下用0.5 mol·L-1的硫酸溶液处理产物4 h、过滤及水洗得到最终产物。产物中CoNi合金纳米粒子的结晶相为fcc结构(图16e),且纳米粒子由1–3层的石墨烯所包覆(图16f),合金与包覆层形成核-壳结构104。其中,EDTA既可提供碳元素,也可提供氮元素。电催化测试的研究表明,在475 °C下得到的材料具有最好的析氢催化性能,其初始过电位(onset-over potential)仅仅约为30 mV,经过优化甚至可以接近于0 V,电流密度为10 mA·cm-2时,过电位为224 mV。文献104并没有提出形成溶胶及凝胶的过程。但是从图16可以看出,由于EDTA有比较强的螯合能力,在200 °C处理时很可能会形成溶胶及凝胶。
2016年,南京工业大学邵宗平教授等105将0.95 g硝酸钴与40 g EDTA或40 g柠檬酸溶解于水溶剂中并加入氨水搅拌。然后在60 °C的油浴温度下蒸发溶剂直至形成混合物并将混合物研磨至粉末状,在该过程中可能会形成溶胶及凝胶。在氮气气氛下,首先在600 °C煅烧1 h,之后煅烧温度升高至800 °C并保温1 h得到Co-N-C材料。XRD测试结果表明,产物中Co的衍射峰并不显著,原因可能是EDTA或柠檬酸的质量远大于硝酸钴的质量。此外,他们将40 g三聚氰胺与1 g盐酸葡萄糖胺在水溶剂中强烈搅拌形成均匀溶液,将0.95 g硝酸钴、0.48 g EDTA与1–3 mL氨水溶解于水溶剂中形成均匀溶液。将两种均匀溶液混合并搅拌,然后也在60 °C下油浴,研磨后也在用相同的热处理温度制度。产物的结晶相为CoOx与Co以及石墨碳,然后用3 mol·L-1的盐酸在室温下处理该产物72 h得到石墨碳包覆的单质Co,而且产物能较好地催化氧还原反应。
2017年,新加坡国立大学的Lee等研究人员106将1 g乙酸镍、1 g柠檬酸、1 g 氰胺溶解于4 mL水溶剂中形成澄清溶液(初始反应物也可加入硝酸锂),然后在120 °C下干燥。不难看出,干燥过程必然伴随溶胶的凝胶的形成。干燥的前驱体在N2气氛下煅烧,首先在550 °C煅烧1 h,然后温度提高至700 °C并保温2 h。产物经研磨、超声后,再用1 mol·L-1的盐酸处理30 min、水洗、醇洗及离心分离,在80 °C下干燥得到最终产物。在图17a中,当加入硝酸锂时,产物的结构类似于丝状结构,而在图17b中,当不加入硝酸锂时,纳米粒子则分布于碳支撑体上。XRD测试的结果表明(图17c),当不加入硝酸锂时,产物中出现fcc Ni及石墨碳的衍射峰106;但是,当加入硝酸锂时,产物中只出现石墨碳的衍射峰。析氧反应催化性能测试的研究结果表明:加入硝酸锂后,催化性能得到大幅度提高(图17d)。
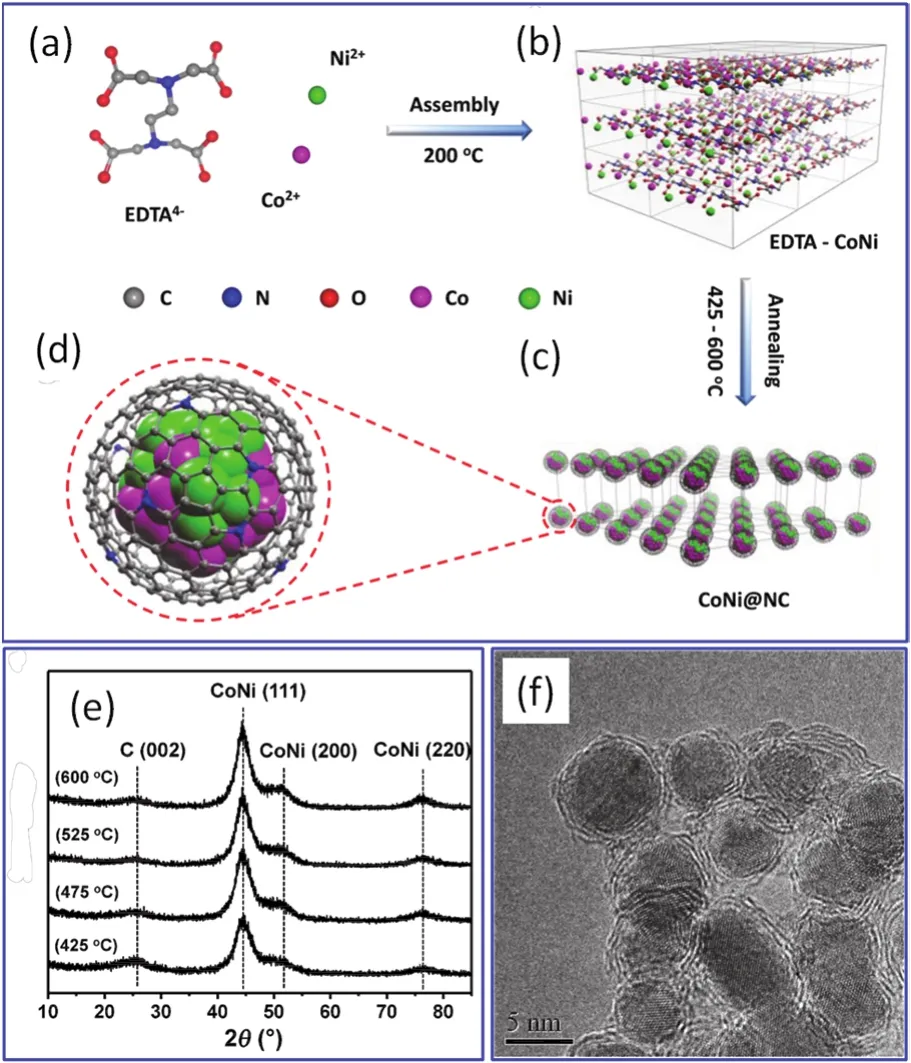
图16 以EDTA四钠盐、硝酸钴和硝酸镍为起始物质制备的CoNi@NC电催化剂的实验路线示意图(a–d),CoNi@NC纳米材料的XRD测试结果(e)以及在475 °C热处理制备的CoNi@NC纳米材料的高分辨透射电镜(HRTEM)图片104Fig. 16 Schematic of the preparation of CoNi@NC electrocatalyst by applying Na4EDTA, Co(NO3)2·6H2O, and Ni(NO3)2·6H2O (a-d), XRD profiles of CoNi@NC nanomaterials being calcinated at different temperatures (e) and HRTEM image of CoNi@NC nanomaterials being caicinated at 475 °C 104.Adapted from John Wiley and Sons publisher.
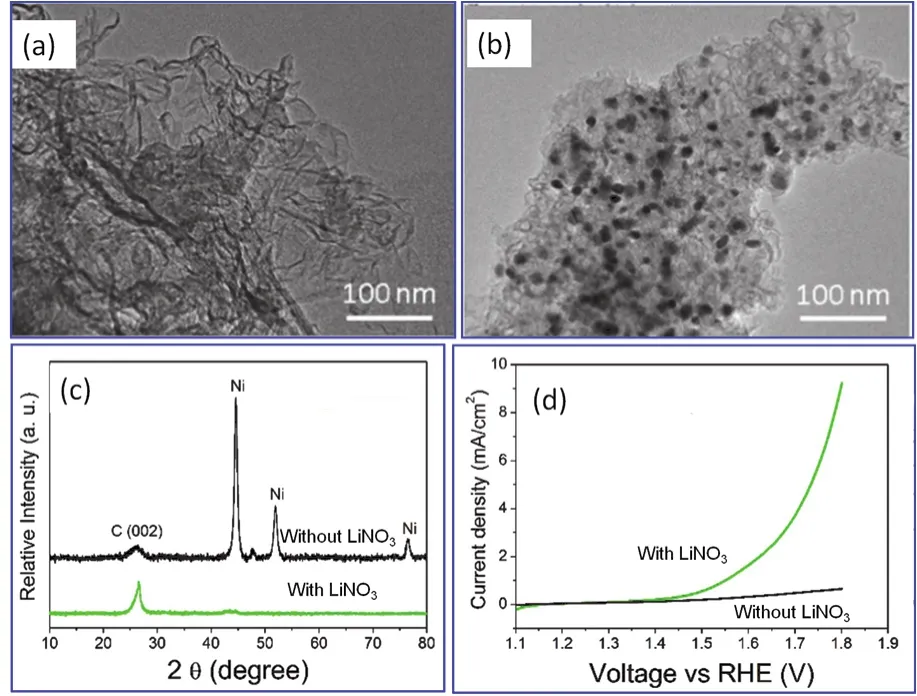
图17 以柠檬酸、乙酸镍、氰胺为起始物质,加入硝酸锂(a)及不加入硝酸锂(b)时在700 °C热处理(N2气氛)制备的产物经酸洗后的TEM图像以及XRD测试结果(c)和产物对析氧反应的催化性能(d) 106Fig. 17 TEM images of the products being calcinated at 700 °C followed by acid etching where citric acid, nickel acetate, cyanamide have been used as raw materials with LiNO3 (a), and without LiNO3 (b) 106, the XRD patterns (c)and catalytic behavior for oxygen evolution reaction of the products (d) 106.Adapted from Elsevier publisher.
2018年3月,西南大学汪敏、包淑娟等以丙三醇(甘油)及硝酸盐为初始反应物,制备出多孔碳包覆的Fe3C、Co、Ni纳米材料107。例如,将硝酸钴与丙三醇溶解于正丙醇溶剂中并搅拌形成澄清溶液。然后将该溶液转移至不锈钢反应釜中并在180 °C保温6 h得到“丙三醇钴”,然后使用Ar/H2(Ar : H2体积比为5 : 1)混合气将该“丙三醇钴”在650 °C还原得到金属Co并形成多孔碳的框架,随后将气体改变为乙烯,最终样品在Ar气氛下冷却至室温。“丙三醇钴”应该是丙三醇的基团与Co2+离子形成的配合物,在180 °C的处理过程中应该会形成溶胶和凝胶。图18为制备的Ni、Co纳米粒子的TEM图片及XRD衍射图案。其中,纳米粒子被多孔碳所包覆(图18b、f),且物相为导电石墨碳以及Ni或Co (图18e)。电催化测试的研究表明,制备的3种纳米材料对氧还原反应都具有较好的催化性能,Co-C纳米材料的催化性能甚至优于Pt/C材料的催化性能107。
2018年5月,意大利学者Vecchio等首先对碳黑(Ketjen black)进行过滤、超声等处理,然后以EDTA为螯合剂,乙醇和水为混合溶剂,硝酸钴或硝酸镍为金属源制备溶液,将碳粉与溶液超声混合,再使溶剂蒸发形成溶胶和凝胶,最后在N2气氛下在800或1000 °C下热处理得到CoNC或FeNC产物,并研究产物对氧还原反应的催化性能108。电化学测试的结果表明,800 °C煅烧的FeNC产物具有最优的催化性能,而在1000 °C下煅烧的产物的耐腐蚀性则最优108。
2018年7月,西安交通大学赵永席等使用单宁酸-甲醛体系,首先将单宁酸和甲醛溶解于乙醇和水的混合溶剂中,然后加入硝酸钴和/或硝酸铁,待溶质完全溶解后将溶液转移至反应釜中在100 °C处理24 h,然后离心分离,水洗及干燥。在反应釜中处理及干燥过程中形成溶胶和凝胶。然后将凝胶与双氰胺研磨得到前驱体,在800 °C下煅烧3 h (N2气氛),再用2 mol·L-1的盐酸处理产物24 h,离心分离、水洗、醇洗得到最终的Co-TA-C800、Fe-TA-C800、Co-Fe-TA-C800催化剂109。XRD的测试结果表明,Co-TA-C800的结晶相为石墨型碳与金属Co、Fe-TAC800与Co-Fe-TA-C800的结晶相为石墨型碳与Fe3C、Co和Fe3C。电化学测试结果表明,用溶胶-凝胶法制备的材料对氧还原反应都具有较好的催化效果,且反应的电子转移数接近于4。
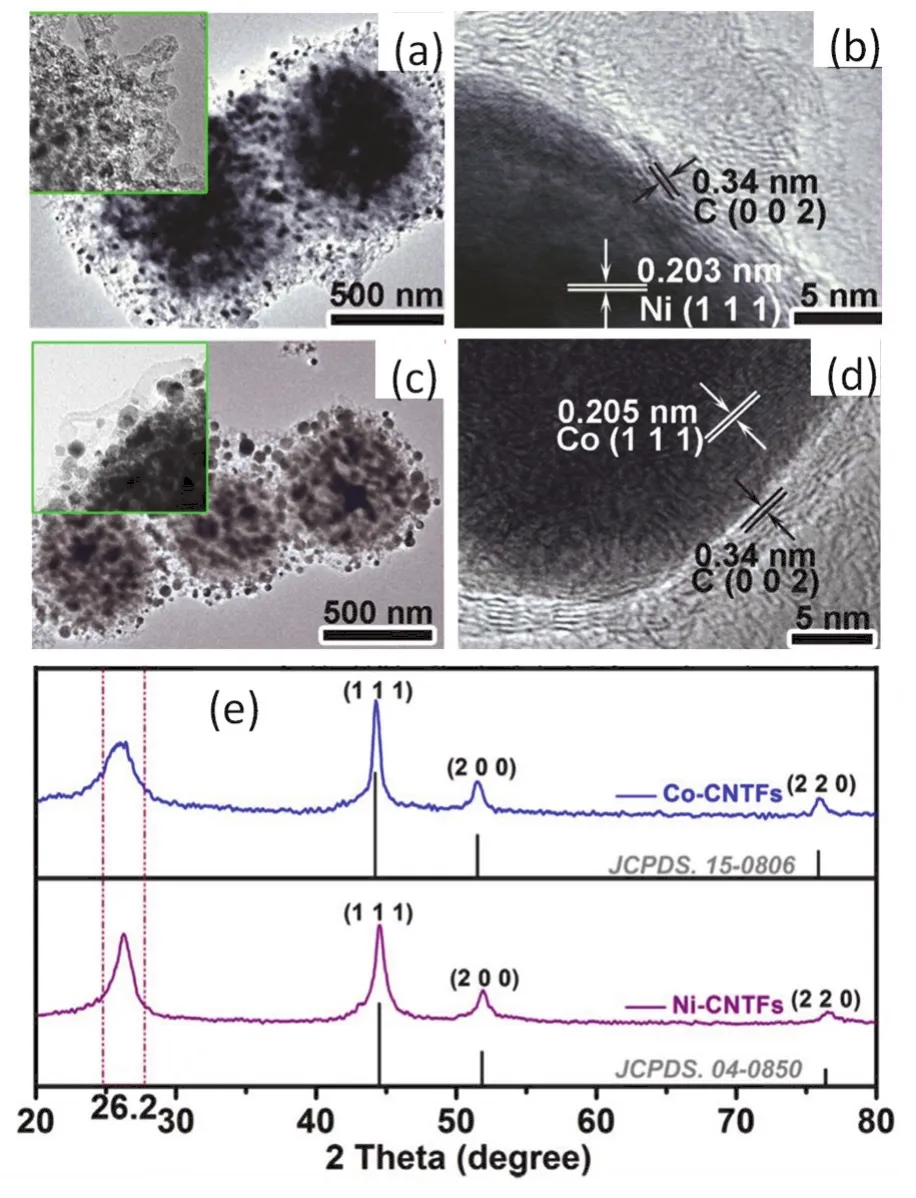
图18 以丙三醇为螯合剂,在650 °C下煅烧制备的Ni (a,b)、Co (c,d)纳米粒子TEM图片以及XRD衍射图案(e),其中纳米粒子被多孔碳包覆107Fig. 18 TEM images of porous carbon coated Ni (a,b) and Co (c,d) nanocrystals, and XRD profiles (e) of Ni@NCand Co@NC nanocrystalsbeing calcinated nated at 650 °C by using glycerol, ferric nitrate, cobalt nitrate, nickel nitrate 107.Adapted from Elsevier publisher.
单宁酸的分子内部含有多元酚,间苯二酚-醛类体系也是常见的能形成溶胶和凝胶的含酚类的体系。2018年7月,中国科学院上海硅酸盐研究所的刘茜等使用间苯二酚-康醛体系,在80 °C下干燥96 h以形成凝胶,然后冷冻干燥得到前驱体,在900 °C下煅烧(N2气氛)前驱体3 h,随后在350 °C(空气气氛)下激活0.7 h,再在325-525 °C的温度范围内,用NH3气氛煅烧2 h,随后用0.5 mol·L-1的硫酸或10% (w,质量分数)的硝酸处理煅烧的样品8 h,最终水洗干燥得到Co5.47N/NC、Co/NC、Ni/NC等产物,并研究产物对氧还原反应的催化性能110。研究结果指出,在酸洗之前,XRD可以探测到Co、Ni以及Co5.47N的衍射峰,且Ni和Co的晶粒尺寸均小于50 nm。电化学测试结果表明,Co5.47N/NC对氧还原反应的催化性能甚至要高于常见的Pt/C催化剂,且Co/NC与Ni/NC也有优异的催化性能110。此外,2018年9月,塞尔维亚学者Gavrilov等111以间苯二酚-甲醛体系,在85 °C干燥引发凝胶化反应,随后在惰性气氛(该文献未指出惰性气体种类)保护环境下,在800 °C热处理前驱体得到(Co、Ni)掺杂的有序多孔碳产物,并研究该物质在没有N掺杂时对氧还原反应的催化效果。由于Co和Ni掺杂的质量百分数不超过0.5%,XRD测试结果中并没有Co和Ni的衍射峰。但是,该产物在碱性条件下对氧还原反应仍有不错的催化效果。密度泛函理论的计算则表明,Co和Ni原子可以位于石墨烯的空位处,从而能激活氧分子并有利于过氧化氢的分解111。
2018年10月,哈尔滨工业大学威海分校的周薇薇等将柠檬酸和金属硝酸盐溶解于去离子水溶剂中,再加入乙二醇配置澄清溶液,随后在80 °C下加热4 h及在120 °C加热6 h。形成的凝胶快速转移至管式炉中,并在Ar气气氛下快速煅烧约1 min,此时形成大量的气体并使凝胶快速膨胀形成二维纳米片,Ni、NiCo纳米颗粒则分布于二维纳米片中112。该方法结合溶胶-凝胶法与气相热处理法的优点,被命名为“凝胶-膨胀”法112,得到的二维纳米片比较均匀,且纳米片的厚度为纳米级,宽度则可达到数百微米。此外,该方法也可制备含各种氧化物的二维纳米片(热处理过程中不使用Ar气)112。
图19为采用该方法制备材料的示意图以及凝胶前驱体和制备得到的Ni/NC材料的宏观图片。对Ni/NC、NiCo/NC材料的物相分析表明,材料中的主要物相为金属Ni、NiCo以及导电石墨碳(图20a,b)112、NiCo纳米粒子被石墨碳包覆(图20c)112。NiCo/NC材料对析氢反应的催化测试结果表明,反应的起始电位约为15 mV,电流密度为10 mA·cm-2时的过电位为163 mV (图20d)112。此外,制备的各种材料在锂离子电池方面也具有优异的性能。该方法使用常见的柠檬酸-乙二醇螯合体系,将溶胶-凝胶法的应用范围拓展至二维材料,且材料有优异的催化性能,在能源与催化领域必将有广泛的应用潜力。

图19 采用凝胶膨胀法制备的二维材料的实施过程(a),制备的凝胶前驱体(b), 干燥的凝胶前驱体和煅烧制备的黑色Ni/NC材料(c) 112Fig. 19 Schematic of preparation of various kinds of 2D materials by using gel-blowing method (a), image of the gel precursor (b), the dried gel and the black Ni/NC product being calcinated in Ar atmosphere (c). The basic initial chemicals are citric acid and ethylene glycol and metal nitrates. NC means N doped carbon 112.Adapted from John Wiley and Sons publisher.
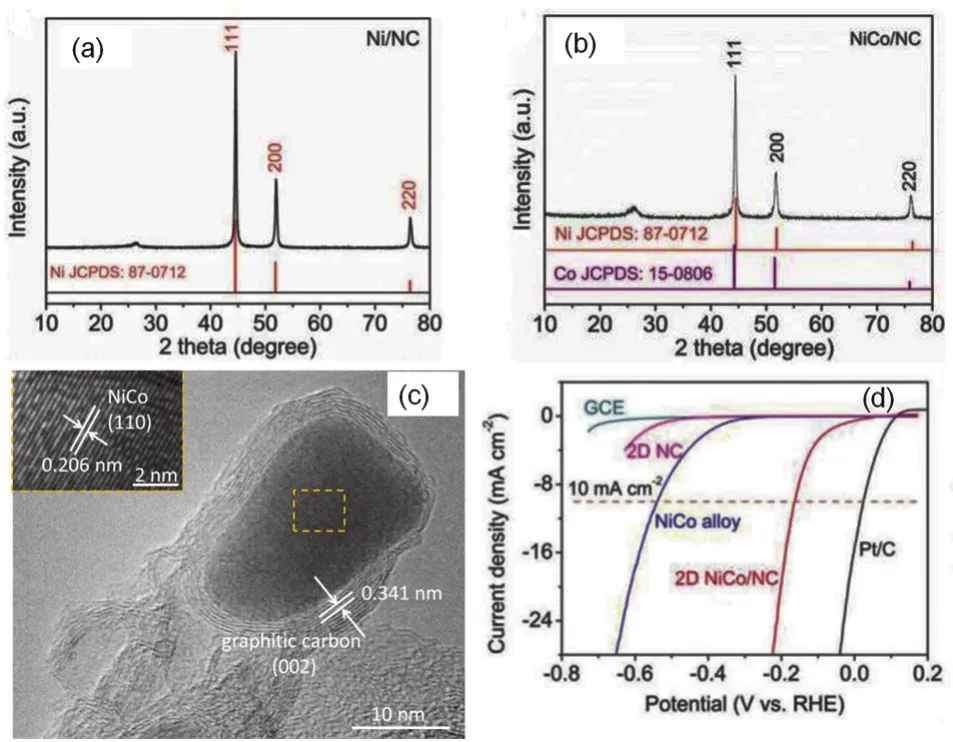
图20 采用凝胶膨胀法制备的Ni/NC, NiCo/NC材料的XRD图谱(a,b),NiCo/NC材料的HRTEM图片(c),以及NiCo/NC材料对析氢反应的催化效果(d) 112Fig. 20 XRD profiles of Ni/NC (a), NiCo/NC (b) materials prepared by using gel-blowing method, HRTEM mage of NiCo/NC material (c), and catalytic behavior for hydrogen evolution reaction of NiCo/NC material 112.Adapted from John Wiley and Sons publisher.
2018年11月,韩国学者Shanmugam等以甘氨酸(glycine)与柠檬酸为螯合剂,以硝酸钴为钴源制备干凝胶。干凝胶在Ar气气氛下,在700、800、900 °C下分别煅烧1 h。之后用0.5 mol·L-1的硫酸溶液在80 °C下处理煅烧产物8 h,最后水洗、醇洗并干燥得到最终产物113。XRD测试的结果表明,在酸处理之前,700、800 °C热处理的产物中均含有Co及Co的氧化物,900 °C热处理的产物中只含有Co。酸处理后则主要出现C的衍射峰。最终产物对氧还原反应与析氧反应都具有较好的催化效果。其中,700与900 °C煅烧并经过酸处理的产物在电流密度为10 mA·cm-2时的过电位分别为403和360 mV,都小于常见的RuO2催化剂对应的过电位(417 mV)。
综上所述,已有的实验结果证明溶胶-凝胶法制备的含过渡金属Ni、Co以及Fe的材料在催化能源领域具有极大的应用潜力。其中,柠檬酸、EDTA以及间苯二酚-甲醛或康醛、丙三醇、甘氨酸等均可引发产生溶胶及凝胶。煅烧温度则一般在600–900 °C之间,产物大多数均为导电的碳包覆的纳米粒子。在煅烧后可以使用酸洗,也可以不使用酸洗。一般而言,酸洗可以消除产物中的较大的粒子113,从而改善纳米粒子的晶粒尺寸分布。此外,热解法114及MOFs115,116热分解的实验研究表明,若产物中的过渡金属Co,Ni纳米粒子被强酸(硫酸或盐酸)完全溶解,此时在产物中除了多孔碳之外,还可能存在Co-N、Ni-N等催化中心,在催化反应中可能达到单原子催化的效果。但是,在溶胶-凝胶法中是否也可同样形成单原子催化尚需深入研究。因此,可以预测,溶胶-凝胶法制备的金属材料(包括二元及多元纳米合金以及贵金属)可能会在催化能源领域产生新的研究方向。此外,溶胶-凝胶法也可制备不含金属元素的氮掺杂的碳材料,且制备的材料也能用于催化氧还原反应117。其实验如下:首先将柠檬酸溶解于去离子水溶剂形成溶液A,然后将双氰胺在100 °C下也溶解于去离子水形成溶液B,然后将溶液A缓慢倒入溶液B,混合溶液在110 °C下加热干燥至水溶剂,此时逐渐形成溶胶及凝胶,溶剂完全挥发后得到白色的干凝胶前驱体,最后在Ar气氛,1000 °C的条件下使前驱体热解得到产物。不难看出,尽管该方法没有使用金属盐,但是仍然属于溶胶-凝胶法。由于不含金属元素(metal-free)的氮掺杂的碳材料也具有较好的催化性能118–120,采用溶胶-凝胶法制备氮掺杂的碳材料及其催化性能也是溶胶-凝胶法应用的方向之一。
6 结论
本文综述了溶胶-凝胶法制备金属纳米材料的实验技术路线、原理及应用方面的进展。不同于氧化物纳米材料,制备金属纳米材料时的热处理步骤必须在惰性气氛或者还原性气氛下进行。但是,气氛保护仅仅是制备金属纳米材料所要求的条件之一。根据热力学判据,相应的螯合剂的还原性应该被抑制,同时相应的金属氧化物的标准电极电位也必须大于零。该方法制备金属纳米材料的原理恰好与传统的液相还原法制备金属纳米材料的原理相反。对于后者,还原剂的标准电极电位应小于金属离子的标准电极电位。热力学计算也给出该方法能够制备的单组份以及双组份金属纳米材料的种类,从而为金属纳米材料的设计和应用提供新的研究思路。
尽管溶胶-凝胶法制备金属纳米材料在实验技术路线、原理及应用等方面都已取得进展。但是,作者认为,该方法仍然存在待解决的问题:
(1) 溶胶-凝胶法制备金属纳米材料时,必须要抑制螯合剂的还原性。为此,需要得到各种有机物的标准电极电位表,以使得螯合剂的标准电极电位大于金属离子的电极电位。目前,几乎没有相关的关于有机物的标准电极电位表可供查询。此外,目前只有淀粉、明胶、琼脂等能用于制备贵金属纳米材料,是否有更多物质能防止贵金属离子在溶液中直接还原还值得探索。此外,除了螯合物体系以及间苯二酚-甲醛(以及康醛)体系外,是否还有其它的体系(如环氧树脂体系)能够制备金属纳米材料也值得研究。
(2) 在热力学机理方面,单一组份的元素的热力学函数值易于被检索,但是二元合金材料的热力学函数值并不全面。例如,Ni-Fe、Ni-Cu、Ni-Co合金的标准摩尔生成焓及标准熵并不能被检索,此时难以采用热力学计算设计二元体系。三元及多元合金体系(例如高熵合金体系)的热力学函数值几乎难以查阅。因此,能否从第一性原理出发得出溶胶-凝胶法制备金属纳米材料的原理也值得深入研究。
(3) 溶胶-凝胶法制备的金属纳米材料在催化与能源方面的应用还处于起步研究阶段,还有大量的问题需要探索。例如,采用该方法制备过渡金属-贵金属合金的催化性能、该方法制备的M-N-C及N-C材料的催化性能以及催化机理等。

