氢化可的松的合成工艺改进
潘建洪,方从申,陈 凯,顾光志
(台州仙琚药业有限公司,浙江 台州 317016)
0 前言
氢化可的松(Hydrocortisone,1),化学名称为11β,17α,21-三羟基孕甾-4-烯-3,20-二酮,属肾上腺皮质激素类药物,具有重要的生理活性,如抗炎、抗病毒、抗过敏、抗休克等作用,临床上广泛应用于肾上腺皮质功能减退、类风湿性关节炎、痛风、慢性肾炎、系统性红斑狼疮、增生性皮肤疾患等疾病的治疗[1-2]。由于氢化可的松的临床应用范围广,市场需求大,其合成方法得到了医药工作者的高度重视,研究人员已报道了多种该药物的合成方法,经总结概括,主要可分为以下两种:方法(1)[4-7]:以16α,17α-环氧黄体酮(2)作为起始原料,经黑根霉菌氧化得到α-羟基化物(3),再经氧化及HBr 环氧开环得到中间体4,通过进一步的脱溴、碘代及取代反应得到化合物5后,再经保护、还原、脱保护、水解得到目标产物1(图2)。该工艺步骤长,总收率及原子经济性较低,三废排放量大,产业化难度较大。

图1

图2
方法(2)[8-12]:以17-羟基-4,9-二烯孕甾-3,20-二酮(2)为起始原料,经过溴羟化、脱溴、碘代、取代基水解等五步反应可制备得到氢化可的松(图3)。与方法(1)相比,方法(2)的路线更短,操作更简洁,更易实现产业化。
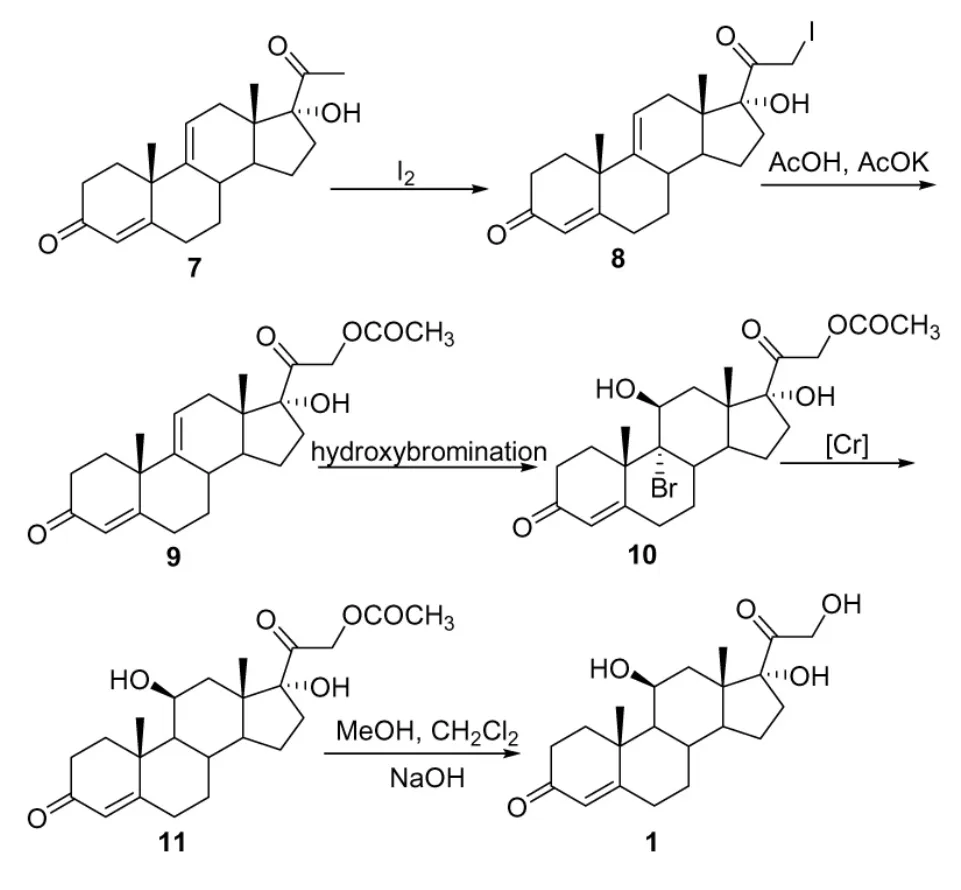
图3
本文在路线(2)的基础上作进一步改进,主要改进点为以下两方面:(1)用氢化三丁基锡代替传统的脱溴试剂铬;(2)溴代物不经分离纯化,直接用于下一步脱溴反应。经工艺改进后,整条路线无需柱层析,总收率达到68%,同时减少了三废的排放量。
1 实验
1.1 主要仪器和原料
Bruker 400 MHz 型核磁共振仪(CDCl3为溶剂,TMS 为内标);Buchi 数字熔点仪(温度未矫正);Thermo Finnigan 质谱仪。
化合物10 为企业自产;其余原料及试剂均为试剂级,阿拉丁试剂有限公司。
1.2 化合物的合成
(1)11 的合成
向100 mL 三口烧瓶中加入原料9(1.93 g,5 mmol),二溴海因(0.86 g,3 mmol),并加入50 mL 丙酮、0.2 mL 高氯酸(70%)及2.5 mL 水搅拌溶解完全后,冷却至0 ℃反应2 h。待反应结束后,向反应液中加入50 mL 二氯甲烷及25 mL水,萃取分层,有机层经无水硫酸钠干燥后低温真空浓缩至干。
将残留物溶于50 mL DMF 中,于N2氛围下缓慢滴加氢化三丁基锡(4.35 g,15 mmol),滴毕,升温至90 ℃保温反应,TLC 跟踪反应完全后冷却至室温,将反应液倒入200 mL 饱和NaCl 溶液中水析,过滤后烘干,得到白色固体氢化可的松-21-醋酸酯1.5 g,收率74%(以原料9 计)。熔点:218.2 ℃~220.6 ℃(lit.[13]:219 ℃~220 ℃).
(2)1 的合成
向100 mL 单口烧瓶中加入双羟基化合物11(2.02 g,5 mmol)、NaOH(0.3 g,7.5 mmol)、20 mL 甲醇及5 mL 二氯甲烷,于室温下搅拌,TLC 跟踪反应完全后,滴加醋酸至pH=7。减压浓缩蒸去大部分溶剂后,残余物冷冻结晶,得到白色固体氢化可的松1.67 g,收率为92%。熔点:219.5℃~220.8 ℃(lit.[14]:217 ℃);1H NMR δ:5.57(s,1H),5.18(s,1H),4.65(t,J=6.0 Hz,1H),4.51(dd,J1=6.0 Hz,J2=19.2 Hz,1H),4.32~4.22(m,2H),4.08(J1=6.0 Hz,J2=19.2 Hz,1H),2.62~2.53(m,1H),2.48~2.31(m,2H),2.24~2.05(m,3H),1.99~1.61(m,6H),1.54(d,11.6 Hz,1H),1.47~1.19(m,5H),1.07~0.92(m,1H),0.91~0.82(m,1H),0.75(s,3H);13C NMR δ:212.1,198.5,172.8,122.0,88.9,66.9,66.3,56.0,52.0,46.8,34.5,34.0,33.4,33.3,31.9,31.7,23.8,20.9,17.4。
3 结果与讨论
3.1 溴羟化反应影响因素研究
不同的溴代试剂在反应活性上存在一定的差异,考察了N-溴代丁二酰亚胺(NBS)、二溴海因(DBDMH)、三溴异氰尿酸(TBCA)等常用溴代试剂及其用量对反应的影响,结果见表1。由表1 中的数据可得:NBS,DBDMH 及TBCA 均适用于该溴羟化反应,而二溴海因表现出比其他两组更好的反应活性。随后对反应温度作了进一步优化,结果表明,适当降低反应温度有利于溴羟化产物的生成,当温度为0 ℃时,收率可提升至63%;但进一步降低温度时,由于反应速率变慢而导致收率降低。增加DBDMH 的用量至0.6 eq 时,反应收率可提高至69%;继续增大用量则对产物收率的提高并无促进作用。加入催化量的高氯酸(70%)对反应有明显的促进作用,收率可提升至76%。

表1 溴代试剂及其用量、反应温度等条件筛选aTable 1 Screening of brominated reagents and its loading,and reaction temperature

表2 反应溶剂及时间对化合物10 收率的影响aTable 2 Effect of solvents and reaction time on the yield of compound 10
在得到较优的溴代试剂及用量,并确定较佳反应时间后,对于溴羟化反应的溶剂及反应时间做了进一步考察,结果见表2。首先,将有机溶剂与水的比例设为10∶1,考察了除丙酮外其余常用有机溶剂对该反应的影响。当选用THF、CH3CN等与水互溶的溶剂时,反应可以顺利地进行,但收率要低于丙酮组反应;EtOAc 由于与水不互溶,导致反应在非均相中进行,使得产物收率大幅度降低。随后,进一步考察了丙酮与水的比例,将acetone/H2O 的比例调整至20∶1 时,产物收率可达86%;进一步降低含水量则对反应具有一定的抑制作用。最后,通过对反应时间进一步考察发现,2 h 即可使反应基本完全。
3.2 脱溴反应影响因素研究
化合物10 经过脱溴反应可以得到双羟基产物11。通过加入CrCl3与锌粉原位生成CrCl2是常用的脱溴方法。本项研究采用氢化三丁基锡(TBH)代替传统的CrCl3/Zn 脱溴体系,并考察了试剂用量、反应温度及反应时间对产物11 收率的影响,结果见表3。在控制脱溴试剂用量及反应时间相同的条件下,随着反应温度的升高,产物收率也随之提高,当温度升至90 ℃时,产物1 的收率可达71%。随后,对脱溴试剂TBH 的用量作了进一步筛选,实验结果表明,3 个当量的TBH即可使原料基本转化完全,收率可达83%。反应时间的优化实验表明,缩短反应时间至1 h 时,由于部分原料未转化完全,导致收率降低至65%;延长反应时间并未能促进收率的提高。
为了进一步简化实验步骤,增加反应总收率。尝试对溴代物经简单后处理后,不经分离,直接用于下一步的脱溴反应。反应结果表明,以9 为起始原料,在不分离溴代物中间体的情况下,经溴羟化、脱溴两步反应,以74%的收率得到目标化合物11。

表3 脱溴反应影响因素研究aTable 3 Investigation on the influencing factors on derbromination reaction
4 结论
综上所述,以17α-羟基孕甾-4,9(11)-二烯-3,20-二酮-21-醋酸(9)作为原料,经过溴羟化、脱溴及水解等三步反应得到产物氢化可的松(1),总收率达到68%。其中,采用氢化三丁基锡代替传统的铬试剂进行脱溴反应,减少了三废排放量;溴羟化中间体不分离而直接进行脱溴反应,简化了后处理步骤,提高了反应总收率。该工艺操作简单,所用试剂较环保,适合工业化生产。

