血清G-17、PGⅠ、CA50单独或联合检测对胃癌患者的诊断价值
孙彦峰,孟利军,郭卫军
(鹤壁煤业(集团)有限责任公司总医院,1、消化内科;3、检验科 河南 鹤壁 458000;2、新乡医学院第一附属医院消化内科,河南 新乡453100)
胃癌(Gastric cancer,GC)是一种发病率和死亡率极高的消化道恶性肿瘤[1],据统计[2]全球每年约有989000位新发GC患者,其中南亚、北美、澳大利亚、非洲东部及北部最低,东亚、东欧最高。目前GC确切病因尚不清楚,不能针对其病因治疗,故早期诊断成为改善GC患者预后的关键。长期以来,GC诊断主要依赖于胃镜检查[3],但该检查方法属于一项侵入性操作,实施风险大,具有设备依赖性,且患者依从性不好,使其在胃癌筛查中的推广应用存在一定局限性。血清学筛查[4]为一项非侵入性检测方法,具有无创、操作简便、诊断迅速等优点,在日本、韩国等国家已逐渐运用于GC筛查,而目前我国在血清学筛查方面的研究较少。本研究探讨血清胃泌素-17(Gastrin-17,G-17)、胃蛋白酶原(pepsinogen,PG)Ⅰ 、 癌 抗 原 50(Cancer antigen 50,CA50)单独或联合检测对胃癌患者的诊断价值,旨在寻找一种有效方法诊断GC,现报告如下。
1 对象与方法
1.1 研究对象 经鹤壁煤业有限责任公司总医院医学伦理委员会审批同意,选择2017年12月-2018年12月鹤壁煤业有限责任公司总医院消化科收治的GC患者75例作为GC组,男45例,女30 例;年龄 37~79 岁,平均年龄(65.03±6.33)岁;病理分期:Ⅰ期25例,Ⅱ期27例,Ⅲ期17例,Ⅳ期6例。同期收治的萎缩性胃炎(Atrophic gastritis,AG)患者75例作为AG组,男47例,女28例;年龄35~80岁,平均年龄(63.77±7.85)岁。 另选同期在院健康体检者75例作为对照组,男43例,女32例;年龄 36~81岁,平均年龄(64.22±7.02)岁。 纳入标准:①GC患者及AG患者均经胃镜检查及病理结果确诊;②病例资料详细;③入组前未接受药物及化学抗肿瘤治疗;④无心脑血管、肝肾脏器或血液系统疾病;⑤所有研究对象自愿参与本次研究;⑥凝血功能正常。排除标准:①认知功能障碍;②严重的心、肝、肾功能不全;③依从性不好;④有内镜黏膜层切除术(endoscopic mucosal resection,EMR)、内镜黏膜剥离术 (Endoscopic mucosal dissection,ESD)等胃部手术史;⑤合并其他恶性肿瘤;⑥入组前半个月内使用制酸剂、质子泵抑制剂(Proton pump inhibitor,PPI)、护胃剂等或正在服用阿司匹林、华法林等抗凝药。所有入选对象均了解本研究内容,并签订了知情同意书。
1.2 研究方法 所有研究对象入院后,抽取其空腹静脉血5ml,分离血清后,采用G-17 ELISA测定试剂盒(北京杰辉博高生物技术有限公司)检测血清G-17水平,采用PGⅠELISA测定试剂盒(上海研晶生物技术有限公司)检测血清PGⅠ水平,采用ARCHITECT i2000sr全自动免疫发光分析仪(厦门海菲生物技术有限公司)测定血清CA50水平。仪器及操作由专业人士严格按照说明书进行。
1.3 评价指标 ①比较三组血清G-17、PGⅠ、CA50水平;②比较不同临床病理分期GC患者血清 G-17、PGⅠ、CA50水平; ③比较 G-17、PGⅠ、CA50对GC的诊断效能;④分析G-17、PGⅠ、CA50对GC的联合诊断效果。
1.4 统计学方法 采用spss22.0软件进行统计分析。计量资料以均数±标准差表示,同时满足方差齐性检验及正态检验时比较单因素方差分析,偏态分布或不满足方差齐性检验比较采用Kruskal-Wallis H秩和检验。P<0.05表示有统计学差异。
2 结果
2.1 三组血清G-17、PGⅠ、CA50水平比较 AG组及GC组PGⅠ水平明显低于对照组 (P<0.05),AG组及GC组G-17、CA50水平明显高于对照组 (P<0.05),GC组PGⅠ水平明显低于AG组 (P<0.05),GC组G-17、CA50水平明显高于AG组 (P<0.05)见表1。
2.2 不同临床病理分期GC患者血清G-17、PGⅠ、CA50水平比较 GC患者血清PGⅠ、CA50水平随临床病理分期升高而升高,差异显著(P<0.05),GC患者血清G-17水平随临床病理分期升高而下降,差异显著(P<0.05),见表 2。
表1 三组血清G-17、PGⅠ、CA50水平比较()
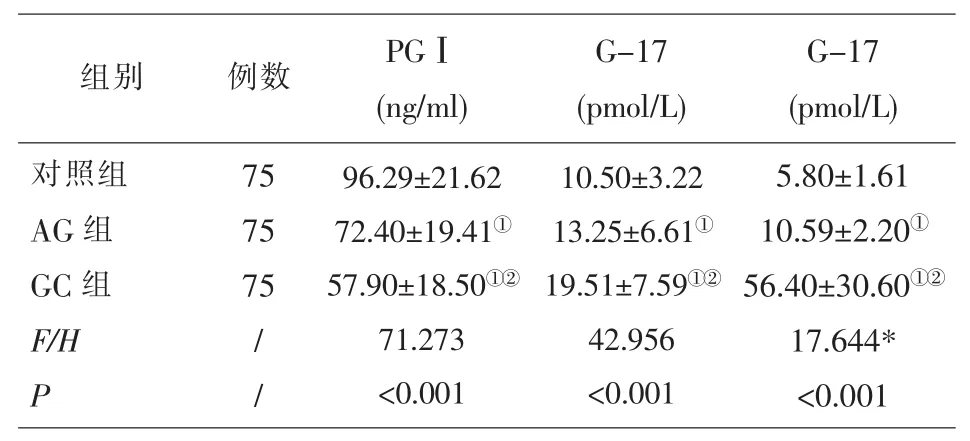
表1 三组血清G-17、PGⅠ、CA50水平比较()
注:与对照组比较,①P<0.05;与 AG 组比较,②P<0.05;*好表示H值
组别 例数 PGⅠ(ng/ml)G-17(pmol/L)G-17(pmol/L)对照组AG组GC组F/H P 75 75 75/ /96.29±21.62 72.40±19.41①57.90±18.50①②71.273<0.001 10.50±3.22 13.25±6.61①19.51±7.59①②42.956<0.001 5.80±1.61 10.59±2.20①56.40±30.60①②17.644*<0.001
表2 不同临床病理分期GC患者血清G-17、PGⅠ、CA50水平比较()

表2 不同临床病理分期GC患者血清G-17、PGⅠ、CA50水平比较()
注:与 I期比较,①P<0.05;与Ⅱ期比较,②P<0.05;与Ⅲ期比较,③P<0.05;*好表示 H 值
组别 例数 PGⅠ(ng/ml)G-17(pmol/L)CA50(μg/L)I期 Ⅱ期Ⅲ期Ⅳ期F/H P 25 27 17 6 / /56.33±4.16 45.82±4.56①35.37±4.48①②27.38±4.15①②③115.444<0.001 12.38±5.28 15.77±6.17①22.09±6.68①②28.87±5.48①②③17.441<0.001 27.90±5.39 52.40±13.71①86.20±22.29①②110.09±20.28①②③24.078*<0.001
2.3 G-17、PGⅠ、CA50对 GC的单项诊断 CA50对GC诊断效能明显优于G-17(P<0.05),PGⅠ对GC诊断效能明显优于CA50(P<0.05),见表3、图1。
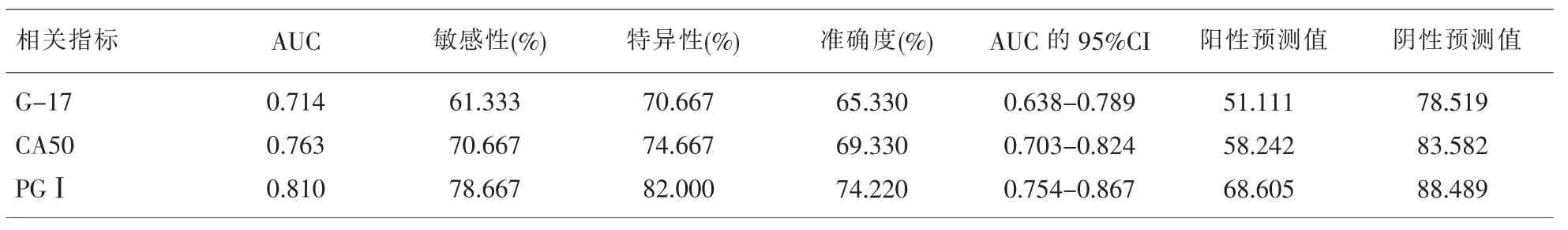
表3 G-17、PGⅠ、CA50对GC的单项诊断
2.4 G-17、PGⅠ、CA50对GC的联合诊断 G-17、PGⅠ、CA50联合诊断GC的ROC曲线下面积为0.923(95%CI:0.877-0.969),敏感度为 77.600%,特异度为100.000%,准确度为88.800%,阳性预测值为100.000%,阴性预测值为81.699%,G-17、PGⅠ、CA50联合检测对胃癌有较高的诊断价值,且G-17、PGⅠ、CA50联合检测对GC诊断效能明显优于单独检测(P<0.05),见图 1。
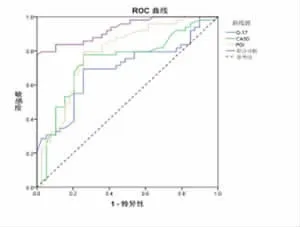
图1 血清G-17、PGⅠ、CA50单独或联合诊断胃癌的ROC曲线
3 讨论
早期GC无明显特异性症状,或出现食欲减退、上腹不适、恶心呕吐与胃炎、胃溃疡等类似的消化道症状[5],得不到患者重视,因此多数GC患者就诊时已为进展期,且由于部分患者惧怕胃镜检查带来的生理痛苦,拒绝行胃镜检查,导致病情进展,延误治疗。因此,寻找有效方法提高早期GC检出率对改善患者生存率十分迫切。肿瘤标志物[6]是在肿瘤发生、发展过程中由宿主对肿瘤的刺激反应或恶性肿瘤细胞异常所产生的物质,可反映肿瘤存在及肿瘤生长状态。当前,与GC有关的肿瘤标志物有 G-17、CA50、PGⅠ等。
G-17是由胃窦部区域G细胞合成和分泌的酰胺化胃泌素,也是反映胃窦分泌功能的敏感指标,可促进胃黏膜细胞增殖与分化,反映胃窦萎缩状况,且在GC发生、侵袭及转移过程中扮演重要角色[7]。Jianye Z等[8]发现G-17可导致高胃泌素血症,从而介导幽门螺杆菌(HP)感染,导致GC发生。另有研究发现[9]G-17在GC患者血清中水平显著升高,且与临床分期、癌变部位相关,这在本研究中也得到了证实。本研究中,AG组及GC组G-17水平明显高于对照组,GC组G-17水平明显高于AG组,且GC患者血清G-17水平随临床病理分期升高而下降,由此提示G-17可能参与GC发病及进展。Feng G X等[10]在我国西南地区纳入328例样本进行研究,发现血清G-17诊断GC的最佳界限值为10.58pmol/L,敏感度为52.78%,特异度为84.69%。本结果显示G-17诊断GC的AUC=0.923(95%CI:0.638-0.789),敏感度为 61.33%,特异度为70.66%,准确度为65.33%,可见G-17诊断GC的价值不高。正常细胞表面的糖脂或糖蛋白在正常细胞生长、分化中起着重要作用,而细胞恶变时糖基转化酶失活,造成细胞表面糖类结构及抗原性质改变,导致肿瘤标志物产生[11]。CA50是一种以唾液酸脂和唾液酸糖蛋白为主的糖脂抗原,也是一种非特异性的广谱肿瘤标志物,有研究显示[12]CA50在非小细胞肺癌(NSCLC)、胰腺癌、原发性肝癌等多种恶性肿瘤中有较高的阳性检出率,能反映肿瘤生长情况。本研究中,AG组及GC组CA50水平明显高于对照组,GC组CA50水平明显高于AG组,且其水平与GC患者临床病理分期呈正相关,提示CA50动态变化与GC病情发展有密切关系,可将其作为GC早期诊断的辅助指标。PG为胃蛋白酶(Pepsin)的无活性前体,也是反映胃黏膜功能和形态学状态的良好指标,当胃体萎缩时多伴PG下降,故PG常用来诊断胃黏膜萎缩[13]。又因GC由慢性胃炎、胃黏膜萎缩、瘤变逐级发展而来,因此PG还可用于GC筛查。根据其免疫活性特征可将PG分为PGⅠ和PGⅡ两种亚型,当胃黏膜发生炎症时,白细胞介素1(IL-1)、肿瘤坏死因子α(TNF-α)等细胞因子大量释放,导致患者血清中PGⅠ、PGⅡ水平上升,而当胃黏膜炎症发展到萎缩,胃粘膜固有腺体被肠化生,部分主细胞被假幽门腺代替,此时PGⅠ水平会则会下降[14],因此本研究中AG组及GC组PGⅠ水平明显低于对照组,GC患者血清PGⅠ水平随临床病理分期升高而升高。随后,我们研究PG对GC诊断价值 时发现PGⅠ对GC诊断效能明显优于G-17、CA50,但其诊断GC的准确度仍然未达到理想值。有研究认为[15]肿瘤标志物联合检测可提高GC诊断价值,此观点与本研究结果相符。本研究中,G-17、PGⅠ、CA50联合诊断 GC的 ROC曲线下面积为0.923,敏感度为85.330%,特异度为92.0%,准确度为 89.780%,可见 G-17、PGⅠ、CA50联合对GC诊断效能明显优于单独检测。由于血清学诊断简便易行且适合大规模筛查,因此可将G-17、PGⅠ、CA50联合检测应用于GC筛查,提高GC诊断率。
综上所述,G-17、PGⅠ、CA50联合检测对GC诊断效能明显优于单独检测,将G-17、PGⅠ、CA50联合检测应用于GC筛查,有助于提高我国GC早期诊断率,降低GC死亡率。

