FDA不良事件报告情况概述
文/王海燕
FDA 是美国卫生和人类服务部下设的一个机构,由办公室和四类职能部门组成。其中食品和兽医学办公室下设食品兽医学办公室、食品安全与应用营养中心、兽药中心[1]。食品安全与应用营养中心(CFSAN),是FDA 下属的六个以产品为导向的中心之一,负责食品和化妆品监管工作。膳食补充剂、婴幼儿配方食品和医用食品安全相关的法规及政策即由该中心负责[2]。
本文主要汇总了公众和企业向FDA提交不良事件报告的途径、形式和报告中包含的基本信息;简要介绍不良事件报告系统(CAERS);汇总并分析近年CAERS 数据库中收到的不良事件和投诉的数据信息;重点介绍关于膳食补充剂、婴儿配方乳粉和医用食品这三类产品不良事件报告的情况,为我国相关产品监管工作提供一定的参考。
一、向FDA 提交不良事件报告的系统
1.安全报告门 户(Safety Reporting Portal,SRP)
安全报告门户简化了向美国食品药品管理局(FDA)和美国国家卫生研究院(NIH)报告产品安全问题的过程。适用于在某些情况下,法律要求的具有某些专业角色的组织和人员提交的安全报告。比如食品制造商、加工商、包装商和证书持有人;研究人员;批准药品标签上标明的申请者或制造商、分销商或包装者;药品制造商;膳食补充剂制造商、包装商和分销商。其他如医护人员、公共卫生官员和其他专业人员,以及消费者和有关公民,如果遇到产品安全问题和/或他们认为与产品有关的不良影响,也可以自愿通过安全报告门户提交报告[3]。
2.MedWatch 报告系统
使用MedWatch 报告系统报告发生或怀疑与人类医疗产品相关的严重药物副作用、产品使用或药物治疗错误、产品质量问题,以及治疗失败的不良事件。包括以下几个方面:处方药或非处方药,住院患者或门诊输液中心患者使用的药物;生物制品[包括血液成分、血液和血浆衍生物、过敏原、人体细胞、组织和基于细胞与组织的产品(HCT/PS)];医疗器械(包括体外诊断产品);组合产品;特殊营养产品(婴儿配方食品和医用食品);化妆品;食品/饮料(包括严重过敏反应的报告)。
以下几类产品不能通过MedWatch系统报告:
(1)烟草:烟草产品问题应向安全申报门户报告。
(2)疫苗:在https://vaers.hhs.gov/.vent.html 上向疫苗不良事件报告系统(VAERS)在线报告疫苗事件。
(3)调查(研究)药物:根据研究规程的要求报告调查(研究)药物不良反应事件,将其发送到研究规程中列出的地址和联系人。
(4)受监管行业的强制报告。
(5)膳食补充剂报告。
(6)兽药产品报告[4]。
3.应通报食品注册系统(Reportable Food Registry,RFR)
应通报食品注册系统是专门针对食品的报告系统。2007年美国FDA 修正案(Pub.L.110-085)第1005 节要求FDA 建立一个电子门户,责任人必须在24 小时内向FDA 提交应通报食品注册报告。当企业有合理理由认为某食品导致严重不良事件时,通过应通报食品注册系统进行电子报告。报告采用跟踪模式和目标检查的形式帮助FDA 更好地保护公众健康。在通过电子入口收到报告后,FDA 必须审核并评估所提交的信息以确认应通报的食品,提交应通报食品注册项目,在FDA 认为必要时发出警告或通告,以及行使该法案赋予的其他现有食品安全权利来保护公众健康。
3.1 RFR 特点
应通报食品注册系统是FDA-NIH安全报告门户的一部分。新的、用户友好型的软件为报告者提供了便利。报告者可在系统中提前填写联系信息并存为草稿,或预先完成部分报告。同时,用户可查看他们已经向安全报告门户提交的任何内容。
3.2 适用范围
应通报食品注册系统适用于FDA 监管的除膳食补充剂和婴儿配方乳粉之外的所有食品和饲料。
根据FD&C 法案(21U.S.C.350d)第415(a)条,在美国境内生产、加工、包装或储存的人类或动物使用的食品企业,有合理理由认为使用、接触某种食品导致了对人类或动物健康不利的严重后果或死亡时,需强制报告。联邦、州和地方政府可自愿使用RFR 门户来报告相关信息[5]。
依 据FDA 350f.Reportable food registry,21 USC CHAPTER 9,SUBCHAPTER IV:FOOD,食品生产商、加工商、包装商或贮存商应作为责任方提交应通报食品注册报告。责任方确认某食品为应通报食品后的24 小时内,应通过电子门户提交报告。如果食品的掺假源于责任方,则调查掺假的原因。如果确责任方掺假、责任方在向该食品的另一人转让之前,监测出掺假行为或责任方纠正了掺假或销毁有问题食品的,可不需要提交报告[6]。
3.3 系统链接
在FDA官网“Reportable Food Registry for Industry” 点击“For Industry/Regulations,Submit a Report”, 同样是进入“Safety Reporting Portal”安全报告门户界面。
二、向FDA 提交不良事件报告的表格
1.PDF 形式报告表格
表格可在计算机上填写,或打印空白表格手填。有以下3 种类型:
a.FDA 3500 表格:自愿报告表格,供医护人员、消费者或患者使用。
b.FDA 3500B 表格:消费者自愿报告表格,属于消费者友好型版本。
c.FDA 3500A 表格:强制报告表格,供药物临床研究申请报告者,制造商,分销商,进口商,用户设施人员使用。
2.在线报告
在线报告人类医疗产品的严重不良事件,包括潜在的和实际使用中的产品使用错误、产品质量问题、以及质量不当或失败[7]。
根据上报产品类别和每个系统的适用范围。从上述3 个系统中选择合适的系统进行在线报告。
3.FDA 上报不良事件
报告需要填写的信息主要包括患者信息、不良事件或产品问题、产品可获得性、可疑产品信息、报告者(自愿报告)或企业信息(强制报告)。
基本信息见下表:
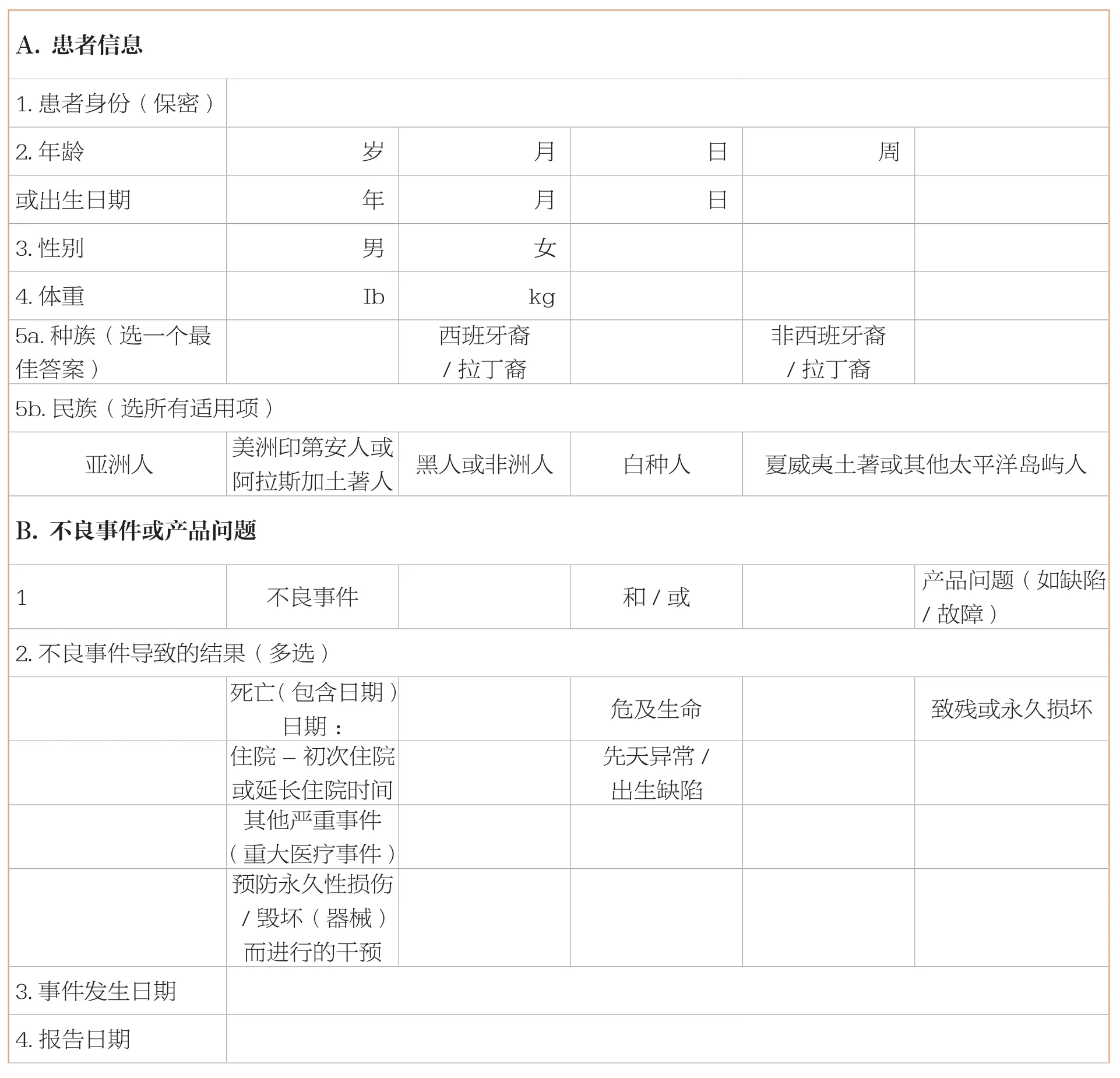
A.患者信息1.患者身份(保密) 2.年龄 岁月日 周 或出生日期年月日 3.性别 男 女 4.体重 Ib kg 5a.种族(选一个最佳答案)/拉丁裔 非西班牙裔/拉丁裔 5b.民族(选所有适用项)亚洲人 美洲印第安人或阿拉斯加土著人 黑人或非洲人 白种人 夏威夷土著或其他太平洋岛屿人西班牙裔B.不良事件或产品问题不良事件 和/或 产品问题(如缺陷/故障)2.不良事件导致的结果(多选) 1死亡(包含日期)日期: 危及生命 致残或永久损坏或延长住院时间 先天异常/出生缺陷 住院-初次住院其他严重事件(重大医疗事件) 预防永久性损伤/毁坏(器械)而进行的干预 3.事件发生日期 4.报告日期
续表

续表
三、CFSAN 不良事件报告系统及不良事件报告情况
1.基本情况
为提高透明度,为消费者、医护人员、研究者和学者提供获取政府数据的途径,CFSAN 于2016年12月6日开始公布从不良事件报告中提取的数据,即为CAERS 数据文件。CFSAN 不良事件报告系统(CAERS)是关于食品(含婴儿配方食品和医用食品)、膳食补充剂和化妆品产品不良事件和产品投诉报告信息的数据库。其设计目的是为支持CFSAN的安全监督程序,是FDA 用来监测食品和化妆品上市后安全性的工具之一。食品、膳食补充剂和化妆品有关的不良事件报告主要来自消费者和医护人员,在这些产品中,只有膳食补充剂的制造商有法律义务向政府机构报告不良事件(具体内容见膳食补充剂不良事件报告)。
在美国法律和FDA 规章允许的范围内,FDA 向公众提供从CAERS 数据库中提取的原始数据,这些数据以ASCII 格式提供,数据包括以下内容:人口统计和管理信息,以及CAERS 报告编号;来自案例报告的产品信息;来自报告的症状信息;从报告中获得的患者使用产品的后果。
数据文件包含消费者和医护人员报告的数据、行业自愿报告的数据,以及从2004年1月开始的膳食补充剂行业强制性报告的数据。CFSAN 将每季度提取原始数据,并适时发布。在CAERS中出现的不良事件报告,并不意味着FDA 已经确定所列出的产品是导致某不良事件的原因。报告中的信息并不足以确定报告的事件与产品的使用之间是否存在相关性。

1.1 CAERS 信息的使用
对于FDA 来说,CAERS 是一个有用的工具,例如寻找可能与市场营销产品相关的新的安全问题,评估制造商对报告要求的遵从性,并回应外部的信息请求。CFSAN 的临床评估人员对CAERS 的报告进行评估,以监测消费者使用产品的安全性。如果在CAERS中确定了一个潜在的安全问题,就会进行进一步的评估。根据对潜在安全问题的评估,FDA 可能会采取监管措施来提高产品安全性和保护公众的健康,向公众传达新的安全信息,或者在极少数情况下,将产品下架。
1.2 CAERS 报告主体
在美国,医护人员和消费者报告不良事件和产品投诉是自愿的。美国食品药品管理局可直接从医护人员(如医生、药剂师、护士和其他人)和消费者(如患者、家庭成员、律师和其他人)获得一些不良事件和产品投诉报告。医护人员和消费者也可能向产品制造商报告不良事件。如果制造商收到与膳食补充剂有关的严重不良事件报告,制造商必须按照法律规定将报告送交FDA。消费者、医护人员和制造商自愿提交的报告,以及膳食补充剂制造商的强制性报告,都被纳入了CAERS。
1.3 CAERS 中包含的不良事件类型
CAERS 数据库中收集任何与食品、膳食补充剂或化妆品有关的不良事件或投诉。这些可以包括小到重大的医疗事件,也可包括对产品的味道或色泽不佳,包装破损,以及其他非医疗问题的投诉。
1.4 CAERS 数据的局限性
CAERS 数据具有局限性。关于产品不良事件报告和该产品在CAERS 不良事件报告总数仅是报告信息的反映,并且不代表FDA 就此产品是否导致不良事件的发生作出了结论。对于任何给定的报告,都不能确定可疑产品是否引起了不良反应。
向FDA 提交的报告中,提供信息的质量和可靠性方面各不相同。有些向FDA 提交的报告并不一定包括所有数据,比如个人是否同时患有其他疾病,或者同时使用其他产品或药物;可能没有准确或完整的联系信息便于FDA 进一步了解不良事件更多信息,或者投诉者可能选择不参与后续调查。当一份报告中缺少重要信息时,FDA 将很难全面评估产品是否导致了不良事件。
鉴于这些报告中的信息并没有经过科学或其他方面去验证因果关系,因此不能用于评估影响(发生率)或评估风险。
1.5 CFSAN 对CAERS 数据的质量控制
当收到报告时,FDA 会删除重复的报告。例如,如果一个消费者提交了一个报告,而后他们的医生也提交了报告,FDA 就删除其中一个报告。然而,在向公众公布这些报告之前,FDA 并不一定会对这些报告进行调查。
1.6 CAERS 数据的公开
CAERS 的数据可以在法律和FDA规定范围内,以下列方式向公众开放:
a.CAERS 数据文件:提供从CAERS 数据库中提取单个案例安全报告原始数据。
b.openFDA:提供一个用于自动查询不良事件报告的API。
c.通过向FDA 发送信息公开(FOI)请求,也可以获得来自CAERS 数据库的信息[11]。
2.CFSAN 官网公布的 CAERS数据库中数据的收集情况
2.1 2004年至2018年3月总体情况
FDA 官网目前公布了两批CAERS数据库的相关数据,分别为2004年至2013年和2014年至2018年3月的数据。汇总2004年至2018年3月 CFSAN CAERS 收到的不良事件报告数据库中的数据,共收到报告104 578件。各年数据收到的不良事件报告总数基本呈逐年上升趋势。从报告产品类别来看,主要以Vit/Min/Prot/Unconv Diet(Human/Animal)为主,共收到报告52 549 件,占总报告数的50%;其次是化妆品相关的不良事件报告和投诉,共收到报告20 226 件,占总报告数的19%;收到其他产品的报告共计31 803 件,占总报告数的31%。2004年至2018年3月,不良事件报告情况见图1,不良事件报告产品分布情况见图2。
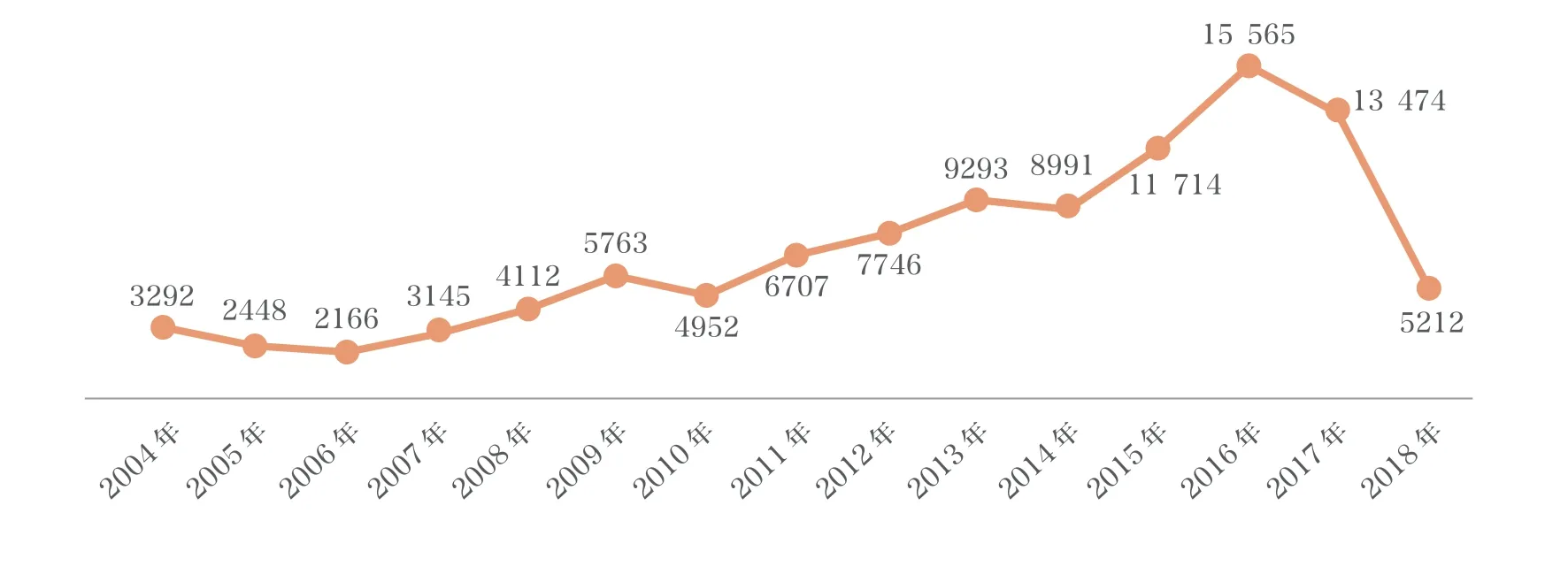
图1 2004年至2018年3月 CFSAN CAERS 收到的不良事件报告和投诉情况
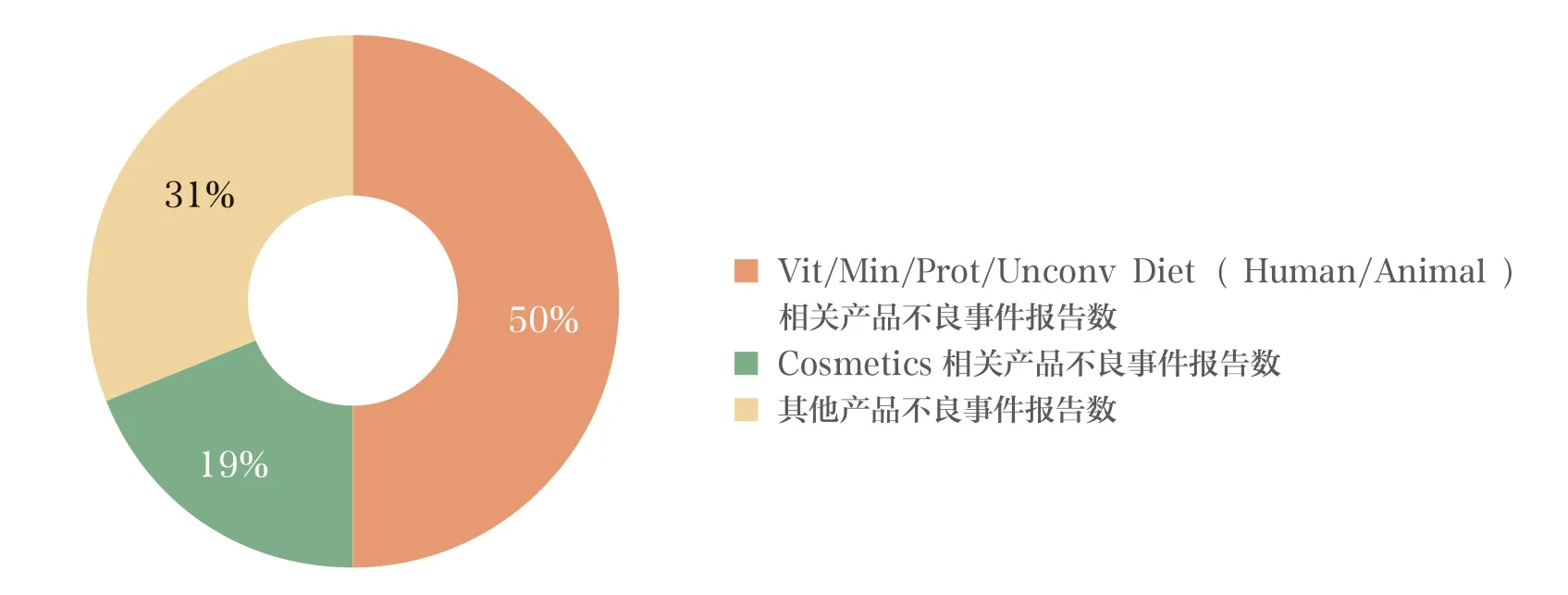
图2 2004年至2018年3月 CFSAN CAERS 收到的不良事件报告和投诉产品分布情况
2.2 两个时间段各自基本情况
2004年至2013年间,共收到报告49 624 件。从报告产品类别来看,主要以Vit/Min/Prot/Unconv Diet(Human/Animal)为主,共收到报告24 590 件,占总报告数的50%;共收到化妆品相关报告2661 件,占总报告数的5%;收到其他产品的报告共计22 373 件,占总报告数的45%。不良事件报告产品分布情况见图3。
2014年至2018年3月间,共收到报告54 956 件。从报告产品类别来看,主要以Vit/Min/Prot/Unconv Diet(Human/Animal) 为主, 共收到报告27 959 件,占总报告数的51% ;共收到化妆品相关报告17 565件,占总报告数的32% ;收到其他产品的报告共计9432 件,占总报告数的17%。不良事件报告产品分布情况见图4。
由此可见,Vit/Min/Prot/Unconv Diet(Human/Animal)类产品相关不良事件的报告比例在CAERS 数据库收集的数据总数中一直占有很大比例。2014年以后,化妆品相关的不良事件报告数量明显增多。
2.3 婴儿配方乳粉不良事件报告情况
2004年至2018年3月,CAERS数据库中共收到婴儿食品相关不良事件报告1286 件,占收到报告总数的1.23%。其中与婴儿配方乳粉相关报告16 件。具体信息见表1。
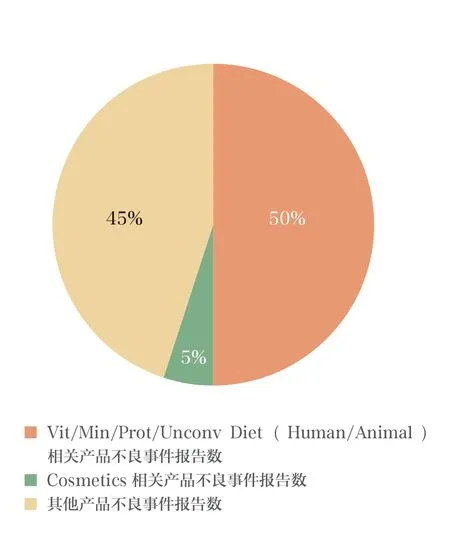
图3 2004年至2013年CFSAN CAERS 收到的不良事件报告产品分布情况

图4 2014年至2018年3月 CFSAN CAERS 收到的不良事件报告产品分布情况
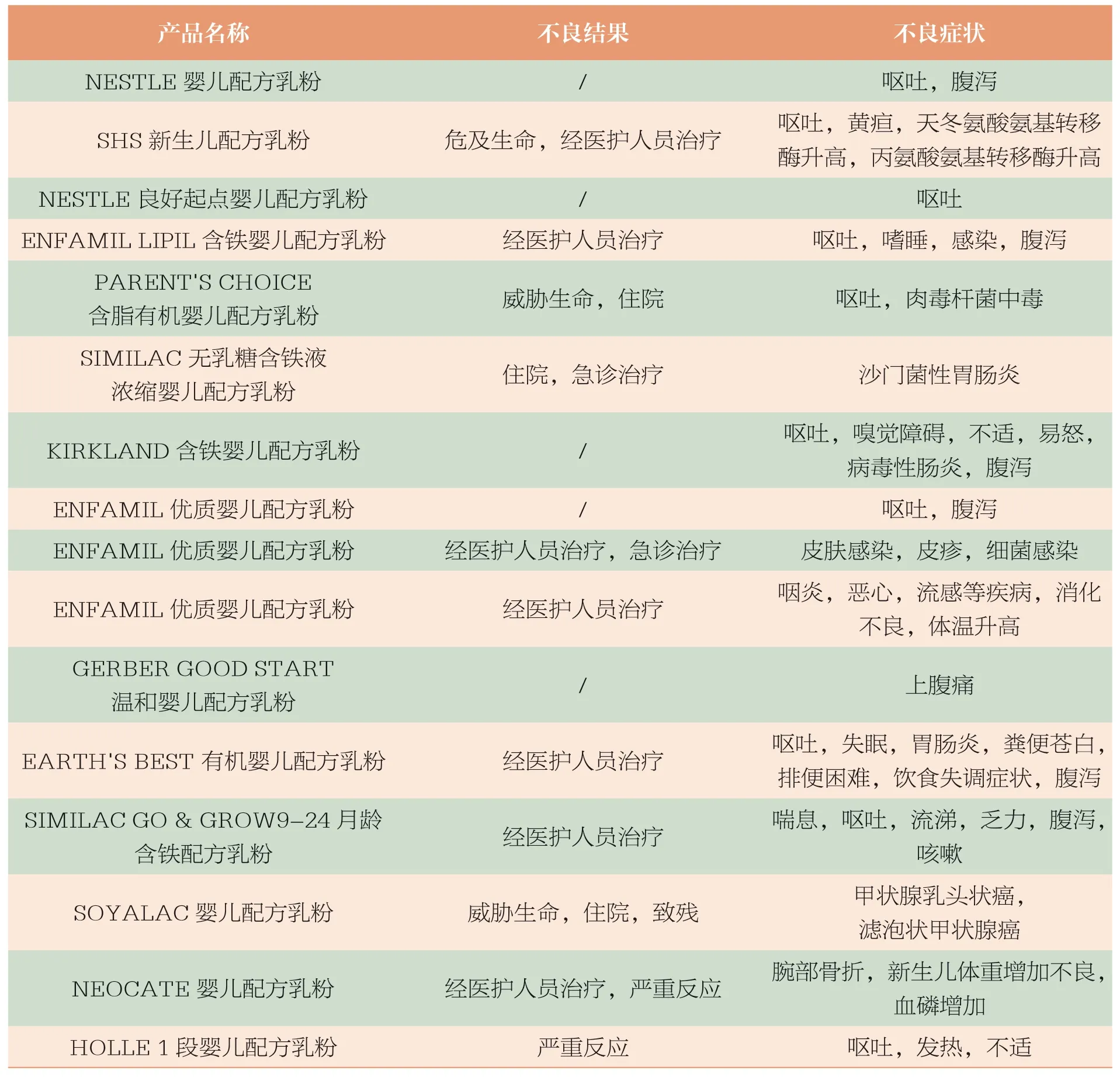
表1 CFSAN CAERS 2004年至2018年3月收到的婴儿配方乳粉不良事件报告情况汇总
2.4 医用食品不良事件报告情况
以“medical food”作为关键词在CAERS数据库(2004年至2018年3月)中“Reported Brand/Product Name”项下检索,共检索13 条报告记录。具体信息见表2。
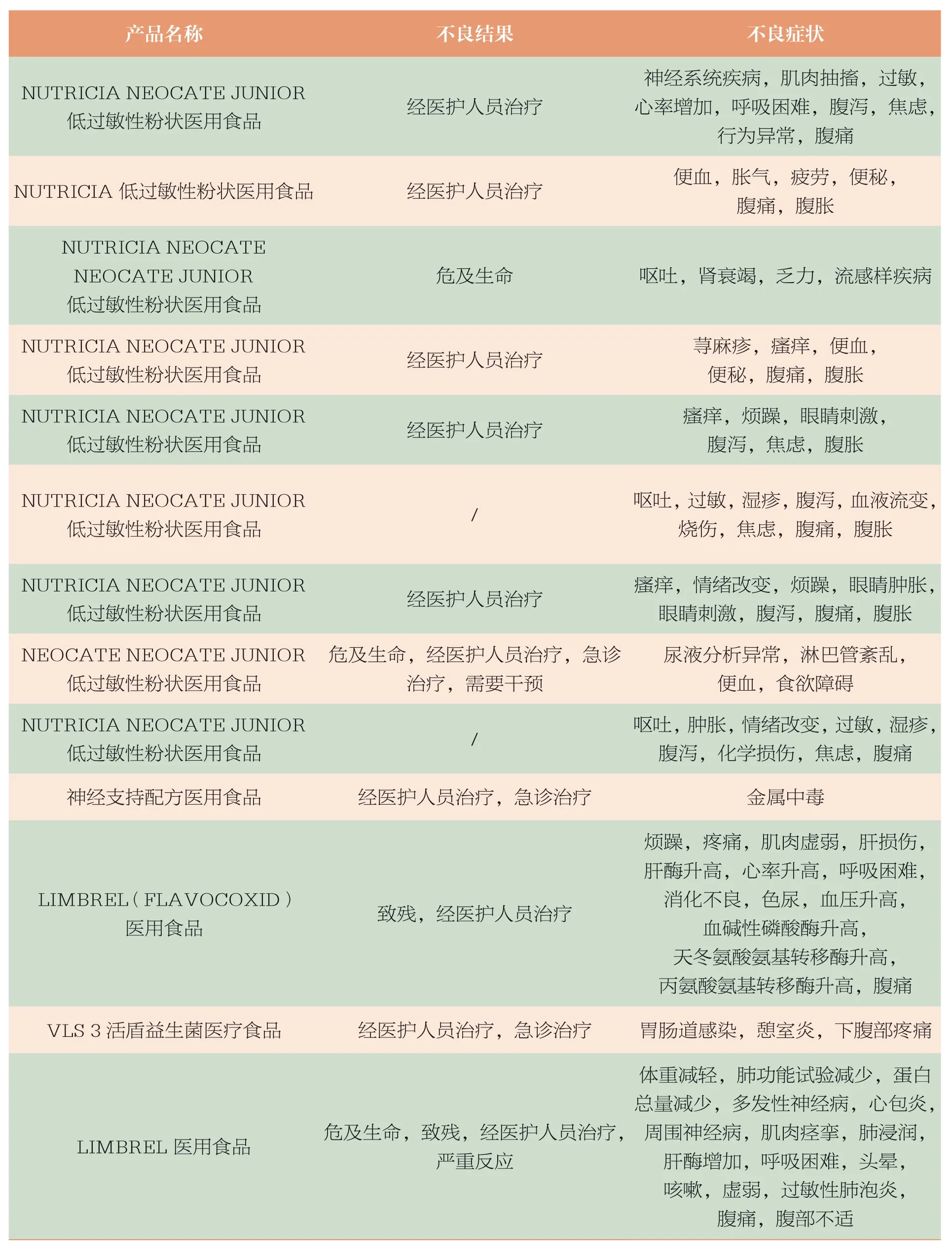
表2 CFSAN CAERS 2004年至2018年3月收到的医用食品相关不良事件报告情况汇总

表3 FDA 药品、器械和食品不良事件报告情况
2.5 openFDA 官网公布的不良事件收集情况
根据FDA 官网openFDA 网站公布的数据显示[12],自openFDA 系统运行截至2018年9月8日,收到药品、器械和食品不良事件报告数分别为:9 140 678 件、7 437 003 件和65 523件,其中食品不良事件报告占这三大类产品不良事件报告总数的0.4%。详见表3。
四、膳食补充剂不良事件报告
膳食补充剂包括维生素、矿物质、草本、氨基酸、乳清蛋白等,无须FDA 批准即可上市销售。因此,对消费者、医护人员和相关行业从业者来说,向FDA 报告使用膳食补充剂导致的健康相关严重反应或疾病(也称为不良事件)尤其重要,FDA 可依此采取行动来保护公众免受不安全产品的侵害。
根据FDA 官网公示信息,严重的反应或疾病主要包括:瘙痒、皮疹、荨麻疹、喉咙/ 嘴唇/ 舌头肿胀、喘息;低血压、晕厥、胸痛、气短、心悸、不规则心跳;严重、持续恶心、呕吐、腹泻或腹痛;排尿困难,排尿减少;疲劳、食欲减退、皮肤发黄、眼睛发痒、尿液发黑;严重关节/肌肉疼痛;说话含糊不清,一侧面部、手臂、腿、视力(中风)功能减弱;鼻或牙龈出血异常;尿液、粪便、呕吐物或痰中有血液;显著的情绪、认知或行为改变、自杀倾向;急诊就诊[13]。
1.《膳食补充剂和非处方药消费者保护法》及《膳食补充剂严重不良事件报告》
2006年12月22日,总统签署了《膳食补充剂和非处方药消费者保护法》(Pub.L.109-462)。该法修改了《联邦食品药品和化妆品法案》(FD&C 法案)中关于无须申请批准的情况下销售的膳食补充剂和非处方药品的不良事件报告和记录。《膳食补充剂和非处方药消费者保护法》于2007年12月22日生效,不适用于除膳食补充剂以外的其他食品[14]。根据《膳食补充剂和非处方药消费者保护法》的要求,CFSAN营养产品、标签和膳食补充剂办公室(ONPLD),膳食补充剂项目部制定了关于膳食补充剂不良事件报告和记录保存问答的行业指南。同时,该法中的膳食补充剂严重不良事件报告部分作为一个独立的法规章节,被收录在《联邦法规》21CFR 9H 严重不良事件报告第379aa-1 部分。

2.膳食补充剂不良事件报告基本术语
2.1 不良事件
是指任何与食用膳食补充剂相关的不利于健康的事件。
2.2 严重不良事件
是指导致以下结果的事件:a.导致死亡,危及生命,住院治疗,永久性或严重致残或丧失劳动能力,先天性畸形或出生缺陷;b.基于合理的医学判断,需要采用医学或治疗干预才能阻止“a”中描述的结果发生。
2.3 严重不良事件报告
是指当膳食补充剂的制造商、包装商或分销商收到与美国膳食补充剂的使用有关的严重不良事件报告时,必须向FDA提交的报告[14]。
3.基本要求
3.1 报告主体
名称根据FD&C 法案第403(e)(1)的要求出现在美国境内销售的膳食补充剂标签上的制造商、包装商或经销商,必须向FDA 提交与膳食补充剂有关的所有严重不良事件报告。《膳食补充剂和非处方药消费者保护法》将需要向FDA 提交严重不良事件报告的实体称为“责任人”。
3.2 零售商
零售商通常不需要提交严重的不良事件报告。是否要求零售商提交其销售的膳食补充剂的严重不良事件报告主要有两个决定因素:①零售商的名称是否出现在膳食补充剂的标签上;②如果是,零售商是否与膳食补充剂的制造商或包装商签订了协议,将获知的所有与膳食补充剂相关的不良事件直接报告给制造商或包装商,再由制造商或包装商按要求提交报告。
膳食补充剂标签上标明其名称的零售商,可以协议授权膳食补充剂的制造商或包装商向FDA 提交该食品补充剂所需的不良事件报告。通过膳食补充剂标签上的地址或电话号码向零售商报告的与该膳食补充剂有关的所有不良事件,零售商将这些信息提供给制造商或包装商。如果订立了此类协议,并且零售商遵守其将收到的膳食补充剂不良事件报告转发给另一方(即制造商或包装商)的义务,则零售商没有义务向FDA 报告膳食补充剂的任何严重不良事件。同样,如果零售商的名字没有出现在膳食补充剂的标签上,也不用向FDA 报告膳食补充剂的任何严重不良事件。
4.报告的提交
4.1 报告时间
通过膳食补充剂标签上标识的地址或电话号码报告的严重不良事件报告,以及责任人在首次报告后1年内收到的与已报告的严重不良事件相关的新的医学信息的后续报告,应当自收到报告后15 个工作日内提交。尽管FD&C 法案第761(c)中没有明确规定责任人通过其他方式(邮件或传真)收到的严重不良事件报告的期限,FDA 建议责任人在收到所有严重不良事件报告后均应在15 个工作日内提交。
及时提交严重不良事件报告对公众健康是重要的。如果不及时通知与膳食补充剂有关的所有严重不良事件,FDA 将无法迅速进行调查和跟踪,这反过来可能导致发现安全问题时延迟向公众报警。因此,仅仅因为向责任人报告不良事件的媒介而延迟向FDA 报告某些严重不良事件将降低不良事件报告作为膳食补充剂可能存在安全问题的早期预警信号的有效性。因此,CFSAN ONPLD 的膳食补充剂项目部制定的关于膳食补充剂不良事件报告和记录保存问答的行业指南中建议责任人收到的所有严重不良事件报告应在收到后15 个工作日内向FDA 报告,而不考虑责任人以何种途径收到初始报告。一旦责任人收集到所有最小数据元素(即,可识别的患者、初始报告者、负责人的身份和联系信息、可疑的膳食补充剂和严重不良事件),15 个工作日的时钟就开始运行。该日期为第0 天,并应在上报表格中相应栏目中填写收到初始报告的日期。

4.2.严重不良事件报告中的最小数据元素
关于膳食补充剂的任何严重不良事件报告应至少包括以下5 个数据元素。这些要素对FDA 避免其不良事件报告数据库中的重复、解释不良事件的重要性、促进随访和检测欺诈是必要的:
a.可识别的患者信息;b.可识别的初始报告人信息;c.责任人的身份及联系方式(如向FDA 提交报告的生产商、包装商或分销商);d.可疑的膳食补充剂;e.严重不良事件或致命结果。
4.2.1 可识别的患者信息
具有可识别的患者信息意味着提供足够的信息来证明某个人经历了严重的不良事件。如在“患者标识符”下填写“一些消费者”是不够的;但如果将患者标识符列出为“老年妇女”或“青年男子”的报告就足够了,因为有足够的信息来评估特定的人群经历了严重不良事件。可识别信息包括:年龄或年龄类别(例如,青少年、成年人、老年人)、性别、首字母、出生日期、姓名或患者识别号码。比如一份报告说,“一个老年妇女有过敏反应”或“一个年轻人经历过敏反应”,这样的信息就足够了。
如果提交给责任人的报告涉及一些群体或不清楚涉及人数,如“一些大学生发生过敏反应”,责任人应跟踪了解患者的数量,然后针对每个可识别的患者向FDA 提交单独的报告。责任人应区分每个患者,以便明确单独的严重不良事件报告不是单个不良事件的重复报告。
为了保护患者的隐私,不应该用姓名或地址来标识他/她;相反,责任人为每个严重不良事件报告指定代码(例如,受伤者的姓名)。在责任人需要跟踪的情况下,所分配的代码将允许责任人交叉引用患者的识别信息和联系信息。
4.2.2 可识别的初始报告者信息
最初的报告人是首先将严重不良事件通知责任人的人,可以是患者、家庭成员或某些其他人(例如医生、药剂师)。可识别的初始报告者信息包括个人标识符(例如姓名)、从业标识符(例如医生、护士、药剂师)或联系信息(例如电子邮件地址、电话号码)。除了在表格上要求的联系信息之外,如果可能的话,还应该提供最初的报告者的电子邮件地址。
有时需要个人判断来决定报告者是否会被认为是可识别的。如果最初的报告者是第三方,并且只提供有限的关于严重不良事件的信息(例如“我的邻居告诉我一个朋友服用某个产品后得了重病”),那么责任人应该设法获得了解不良事件发生个人的相关人信息(例如电话号码或电子邮件地址)。然后,责任人应跟踪该人以获得足够的信息,向FDA 提交严重不良事件报告。
如果最初的报告者要求责任人不要将报告者的姓名和联系信息转发给FDA,则责任人可以在不识别报告者的情况下提交报告,只要责任人将联系信息保存在档案中,以便FDA 或企业需要备查。对于这些报告,责任人应该在报告表格的初始报告者信息栏中填写“要求匿名”。
4.2.3.责任人的身份及联系方式
指向FDA 提交报告的生产商、包装商或分销商的位置信息及具体位置联系方式。
4.2.4 可疑的膳食补充剂
对于可疑的膳食补充剂,提供完整的产品名称,包括品牌名称和任何其他已知的产品属性。所提供的信息应足以唯一地识别可疑产品并将其与其他类似命名的产品区分开来。例如“维生素C”或“多维生素”将不被认为是完整的产品名称。需要唯一地识别产品的信息包括产品的物理形式(例如片剂、粉末、凝胶帽、棒);规格(例如120 mg);口味(如果有的话);包装形式和大小(例如120 片/瓶)。
如果严重不良事件涉及由同一责任人制造、包装或分销的多种膳食补充剂,则该责任人应仅向FDA 提交一份严重不良事件报告,在表格或上报系统中列出所有可疑产品的信息。
如果严重不良事件涉及不需批准可销售的非处方药产品以及由同一责任人制造、包装或分发的膳食补充剂,并且最初报告人认为每种产品都是可疑的,则该责任人应向CDER 和CFSAN 均提交严重不良事件报告。报告中应列明两个可疑产品的信息,并且应该使用一个制造商的报告编号。
如果严重不良事件涉及多个可疑的膳食补充剂,这些可疑的膳食补充剂是由一个以上的责任人(例如制造商A 和B)制造、包装或分销的,并且如果事件被报告给一个责任人(制造商A),则该责任人(制造商A)必须向FDA 提交一份严重不良事件报告,该报告“可疑产品”部分中应标识其自己的产品和制造商B的产品,并提交制造商A 的产品标签的副本。制造商A 还应向制造商B 发送提交的报告副本(包括制造商A 的报告编号)。如果制造商B 收到这样的报告,那么制造商B 必须提交他自己的严重不良事件报告,并在报告中引用制造商A 的报告编号。同时提交制造商B 的产品标签的副本。
只要责任人收到该公司产品在美国使用时发生严重不良事件的信息,就应该提交报告。如果严重不良事件涉及已停产的膳食补充剂,责任人仍必须向FDA 提交报告。责任人应在报告中说明产品已停产的情况。
4.2.5 严重不良事件或致命后果
除了死亡之外的严重不良事件至少应根据体征(包括异常实验室发现)、症状或疾病诊断进行描述,以便报告。因此,一份声称患者“遭受了不确定的伤害”“遭受了不可弥补的损害”“生病了”的报告是被认为不够具体的。如果初始报告人没有提供任何体征、症状或诊断,则责任人应根据需要跟进,以便从初始报告者、患者或(在患者许可下)医护人员那里获得更多信息。
即使导致死亡的事件是未知的,致命结果(死亡)的报告也应满足严重不良事件的最低描述。这种报告还应当包括与死亡有关的任何其他可用信息(例如与死亡有关的不良事件)。
4.3 严重不良事件报告提交的材料
4.3.1 膳食补充剂的标签需随报告一起提交
责任人应提交患者使用的产品完整的外包装/容器标签和内包装标签的副本。如果患者使用的产品已经明确标识,但责任人没有患者自己的标签的副本,责任人应当提交与患者使用的产品标签相同或相近的原件或复印件,或者责任人尽量提交与患者使用标签信息接近的标签。
由于某种原因,无法确定患者食用膳食补充剂的确切标签,比如标签随时间变化或无法确定患者使用的具体产品,则责任人可提交最有可能是患者食用产品的标签副本。或者可以提交最有可能与报告相关多个产品的标签。此外,如果标签自不良事件发生以来已经改变,则责任人也可以提交产品当前标签的副本。
对于提交纸质FDA 3500A 表格的责任人,以上信息应与严重不良事件报告一同邮寄;对于通过FDA 安全报告门户提交电子版的责任人,应当以“附件”形式上传标签的电子版。
4.3.2 产品标签以外的其他材料
作为严重不良事件报告的一部分,FDA 建议责任人酌情附上下列文件:a.医院出院情况摘要;b.尸检报告;c.相关实验室数据;d.其他重要临床数据。这些文件或信息可以由责任人选择并随报告一同提交。
4.3.3 膳食补充剂样品不需要提交
4.4.严重不良事件报告的提交方式
4.4.1 强制报告
膳食补充剂制造商、包装商和分销商必须使用纸质MedWatch 表格、FDA 3500A 表格或FDA 安全报告门户提交与其产品相关的严重不良事件。

4.4.2 自愿报告
与膳食补充剂相关的不良事件自愿报告可以使用MedWatch 表格、FDA 3500 表格或FDA 安全报告门户提交。
膳食补充剂不良事件自愿报告包括:
(1)由消费者、医护人员或除膳食补充剂制造商、包装商或经销商之外的其他主体提交的任何不良事件报告。
(2)由膳食补充剂制造商、包装商或分销商为其产品提交的非严重不良事件报告。
(3)由膳食补充剂制造商、包装商或分销商为其产品提交的严重不良事件报告,而该企业并不是必须报告严重不良事件的“责任人”。例如,经销商的名字出现在膳食补充剂标签上,经销商是严重不良事件的“责任人”,但膳食补充剂的制造商可能选择向FDA 提交严重不良事件报告。在这种情况下,FDA 将接受同样的严重不良事件的自愿报告和强制报告。
4.5 新的医疗信息
在初次报告1年内收到的任何新的医疗信息必须提交FDA。鉴于新的医疗信息是与严重不良事件报告有关的记录,因此FDA 要求即使新的医疗信息是在严重不良事件报告后1年以后收到的,虽不必报告,也必须将其放在严重不良事件的文件中保存6年。虽然在向FDA 提交严重不良事件1年后收到新的医疗信息不强制要求提交,但FDA 鼓励自愿提交这些信息,以便能获得一份完整的评估报告。
4.5.1 提交时间
这些新的医疗信息必须在制造商、包装商或经销商收到后15 个工作日内提交FDA。
4.5.2 提交方式
提交新的医疗信息(例如,医疗记录)不需要在FDA 3500A 表格或FDA 安全报告门户上填写新报告。FDA 安全报告门户允许用户以电子方式更新先前通过门户提交的严重不良事件报告。提交后续报告,首先电子访问先前提交的报告:①访问作为账户持有人提交的报告:从安全报告门户的主页登录。从“提交的后续报告”列表中选择适当的以前提交的报告。②访问作为客户提交的报告:从“安全报告门户”主页中,单击“作为客户报告”。在“新客户报告”屏幕上,选择“跟踪以前作为客户门户用户提交的报告”。在出现的文本框中输入适当的报告标识键。
一旦选择了适当的报告进行随访,在随访报告的附件部分附上新的医疗信息的电子版本。如果之前提交的严重不良事件报告是采用纸质表格FDA 3500A 的形式,提交新的医疗信息则仅需将初始严重不良事件报告的副本附在同一表格中新的医疗信息的副本上。没有必要从初始严重不良事件报告中重新提交任何附件。
4.5.3 报告的合并
首次报告是通过FDA 安全报告门户提交的,责任人会收到一封电子邮件,包含提交报告时印有时间戳的副本。该副本中包含一个单独的案例安全报告编号,以便在后续报告中标识首次报告。如果采用纸质表格提交首次报告,则FDA 不向责任人提供此编号。
因此,使用纸质版本报告有关新的医疗信息,如果新的医疗信息中包括MedWatch 表格3500A 中初始严重不良事件报告的副本时, FDA 将把首次提交的报告和新的医疗信息报告合并为一份报告。使用电子版本提交新的医疗信息报告,系统将通过报告编号自动将新的医疗信息报告与初始报告相关联。
4.6 记录的保存与检查
4.6.1 保存
依据Pub.L.109-462,责任人应将收到的不良事件报告记录保存6年。责任人必须保存每一个严重不良事件报告相关的所有记录,保存期限为6年。这些记录至少应包括以下复印件:
a.责任人向FDA 提交的严重不良事件报告,含附件。
b.责任人收到的与严重不良事件相关的新医疗信息。
c.向FDA 报告的与严重不良事件相关的新医疗信息。
d.责任人与初始报告者、提供与不良事件有关信息的任何其他人之间通信和记录。
同时,向相关膳食补充剂的制造商、包装商或分销商提交的非严重不良事件的报告,应连同其他任何相关记录(例如与不良事件报告人的通信记录)一起保存,并应记录责任人对此事件的评估是非严重的。所有此类非严重不良事件报告同严重不良事件报告一样,必须保存6年。
严重的和非严重的不良事件的记录可电子化保存与维护。为满足FD&C 法案[21 U.S.C.379aa-1(e)(1)] 第761(e)(1)条的要求而创建和维护的电子记录,须符合《联邦法规》21 章第11 款(简称:21CFR 11 款)的要求。因此,如果以电子方式维护记录,则必须符合21CFR 11 款中所包含的电子记录要求。
4.6.2 数据检查

依 据Pub.L.109-462 和FD&C 法案第704 节(21U.S.C.374),责任人应准许一位被授权人有权查阅保存的记录。被授权人指卫生和人类服务部的职员或雇员,应取得相应证书,人选由秘书长决定,且所查阅内容也由秘书长决定。被授权者可以查阅膳食补充剂制造商、包装商和分销商必须保存和维护的所有不良事件报告记录。
4.7 信息保护
根据要提交的严重不良事件报告,包括按规定提交新的医学信息,以及资源提交的不良事件报告,均应遵循:
a.FD&C 第756 节规定获得的安全报告,且同时附有一份声明,该声明作为报告的一部分,公开披露,企业提交该报告或记录并不是承认不良事件是由该产品直接导致或促成的。
b.《美国法典》第5 篇第552a 节(通常指《隐私权法案》)规定获得的个人记录,以及医疗档案或类似档案,上述资料的披露将违反《美国法典》第5 篇第552a 节的规定(通常指《信息自由法案》)(除非所有个人身份信息都经过编辑,否则不得公开)[15]。
五、关于婴儿配方乳粉
1.基本情况
FD&C 将婴儿配方乳粉定义为“接近母乳或完全或部分作为母乳代用品,仅适用于婴儿的特殊膳食食品”[16],并将婴儿定义为不超过12 个月的人[17]。由于婴儿配方食品是食品的一种,因此食品法规亦适用于婴儿配方乳粉。婴儿配方乳粉通常被弱势群体在生长和发展的关键时期用作唯一的营养来源,因此除了食品的法规要求之外,FDA 制定了额外要求,即FD&C 法案第412 节、第106 节和107节。食品安全与应用营养中心(CFSAN)负责婴儿配方乳粉的管理。营养产品、标签和膳食补充剂办公室(ONPLD)对婴儿配方乳粉具体事项责任。食品添加剂安全办公室(OFAS)负责食品配料和包装。
ONPLD 评估婴儿配方乳粉制造商是否符合FD&C 第412 条要求,并向OFAS 咨询婴儿配方乳粉成分和婴儿配方乳粉包装材料的安全性。OFAS 依据FD&C 第201 节和409 节评估拟用于婴儿配方乳粉或与婴儿配方乳粉接触物质的安全性。婴儿配方乳粉上市不需经过FDA 批准。但在美国销售的所有配方乳粉必须满足《联邦法规》中的相关营养要求,婴儿配方乳粉制造商必须在销售新配方乳粉之前通知FDA[16]。
2.关于不良事件报告情况
FDA 没有专门制定婴儿配方食品不良事件报告相关的文件,依据FD&C 第412 条规定的责任监管婴儿配方食品。
2.1 制造商
法规要求婴儿配方乳粉制造商在生产和货架期内测试产品组成,保存每批婴儿配方乳粉的生产、测试和分销记录,并执行良好生产规范和质量控制程序。
此外,法规要求婴儿配方乳粉制造商保存所有投诉的记录,其中一些投诉经过审查,可以揭示产品可能存在对健康的危害。依据21 CRF,Chapter1,part 106,制造商应制作和保存定期排查的与审计有关的记录,包括审计计划和程序、审计结果以及根据这些发现做出的任何改变的清单。制造商应随时提供审计计划和程序以及定期进行的审计的保证书,供授权检查。制造商应维护审计程序,说明如何处理有关婴儿配方乳粉的所有书面和口头的投诉,并应严格遵循这些程序。程序中应包括审查涉及婴儿配方乳粉的任何投诉,和确定是否需要调查可能存在危害健康的规定。当婴儿配方乳粉的食用与婴儿死亡之间存在因果关系可能性时,制造商应在收到此类信息15 天内,按照FD&C法案第106.150 条要求进行调查并通知相关政府部门。制造商应将投诉文件分为两类:一类是指婴儿因食用该产品生病或需要医护人员治疗的投诉;另一类是指可能涉及可能危害健康,但不涉及婴儿生病或需要由医护人员治疗的投诉。制造商应在投诉文件中包含与投诉有关的下列信息:a.婴儿配方乳粉的名称;b.生产总量;c.投诉人的姓名;d.投诉或电话谈话或会议的备忘录、与投诉人所有信件的复印件;e.通过查阅或者复印,对投诉进行评估所需的所有相关制造记录和投诉调查记录。当这些记录的副本没有保存在投诉文件中时,它们必须在FDA 要求的24小时内提供;f.对投诉采取的一切行动;g.投诉的所有发现和评估。
制造商应在指定文件中保存与其收到的投诉有关的所有记录,并应确保制造商和FDA 都能在24 小时内获得这些记录[18]。
2.2 FDA
FDA 对制造婴儿配方乳粉的所有工厂进行年度检查。FDA 也在新工厂早期生产运行期间进行检查。此外,如果FDA 确定掺假或冒牌生产的婴儿配方乳粉对人体健康构成危险,FDA 将授权专门机构发起强制召回[16]。
六、关于医用食品
医用食品是指在医生的指导下使用,基于公认的科学原理、根据医学对特定疾病或状况下独特的营养需求评价之上,专门配制或食用的食品[见21 CFR101.9(j)(8)]。该词最初出现在《孤儿药修正案》中[1988,21,USC360ee(B)(3)]。此定义以引用方式于1990年11月纳入《营养标签与教育法》(P.L.101-535),于1993年1月被纳入强制性营养标识规定中。
一般来说,医用食品必须至少符合下列标准:a.为口服或管饲食品;b.被标记为一种医疗紊乱、疾病或状况下食用的食品;c.在医生指导下使用,并且是主要通过医院、诊所和其他医疗机构获得。医用食品一词并不指患者食用的所有食品。医用食品是针对严重疾病或需要该产品作为主要治疗模式的患者而专门配制和加工的食物(而不是天然状态下使用的天然食品)。典型的医用食品是肠内营养产品,即通过胃肠道提供、口服或通过管或导管提供的产品。医用食品可分为以下四类:a.全营养配方;b.非全营养配方,使用前可与其他产品混合的组件产品(例如蛋白质、碳水化合物或脂肪组件);c.12 个月龄以上患者代谢(遗传)障碍配方;d.口服补液产品。1972年以前,FDA 将医用食品纳入药品模式管理。为促进产品的发展和应用,1972年将这类产品从药品分类中分离出来,归为特殊营养食品。目前,市场上的医用食品广泛应用于危重患者和老人来作为其维持生命的一种方法。这些产品仅需要遵守美国法规中对普通食品的安全和标签规定[19]。因此,在美国,医用食品没有独立的不良事件报告体系。关于一般食品的不良事件报告程序和途径亦适用于医用食品的不良事件报告。由于医用食品食用人群的特殊性,FDA 通过对美国境内和国外医用食品企业实施年度检查来确保产品持续安全性和完整性。

