A型流感病毒感染BALB/c小鼠炎症模型的建立
孙海伟,史馨瑾,陈艳艳,钟秋萍,张萌,吕璐,王俊,陈鸿军
(中国农业科学院 上海兽医研究所,上海 200241)
A型流感病毒(influenza A virus,IAV)属于正黏病毒科(Orthomyxoviridae)甲型流感病毒属,由8条负链RNA片段组成和编码流感病毒蛋白,具有囊膜,除少数流感病毒呈丝状,一般呈球形,直径约为80~120 nm。IAV根据血凝素(hemagglutinin, HA)与神经氨酸酶(neuraminidase, NA)的抗原性,可以将其分为不同亚型。迄今,HA共有18种(H1 ~ H18),NA共有11种(N1 ~ N11)[1]。
流感病毒感染的宿主广泛,包括人、禽、猪等[2-5]。其中,H9N2因其高度接触传染性及分布广泛性,且为H5N1、H7N9及H10N8等提供了部分内部基因,造成了其他流感病毒的基因重排,进而产生新的病毒亚型或基因型[2,6-8],所以H9N2危害十分严重[9-13]。H1N1病毒能引起家禽发生严重的疾病并可能导致疫情或人类流感大面积传播[14-15],如1918年的“西班牙大流行”的流感病毒(H1N1)就造成了近5000万人的死亡[16],2009年的H1N1大流行造成了近1.7万人的死亡[17-18]。因此,本文将本实验保存的A/swine/Jiangsu/C1/08 (H9N2) (H9C1)、A/swine/Shandong/731/2009 (H1N1) (SD731)和A/Puerto Rico/8/34 (H1N1) (PR8)毒株作为模式病毒进行致病机制研究。
高致病性流感病毒致使动物或者人死亡的一个重要原因是其引起细胞因子风暴以及肺损伤[19-20]。此外,研究指出流感病毒感染宿主后,IL-6和TNF-α等炎症因子招募巨噬细胞和中性粒细胞到病毒感染的肺部,引起肺部发生急性炎症反应,从而造成肺部急性损伤,增强疾病程度,甚至引起宿主死亡[21-23]。然而,流感病毒致炎的具体的分子机制至今尚不清楚,建立合适的流感病毒感染动物模型成为阐明其致病机制并开发出有效疫苗和药物的重要工作。本文将对BALB/c小鼠进行H9N2及H1N1致病性实验,建立BALB/c小鼠炎症动物模型以分析流感病毒的致病性。
1 材料与方法
1.1 材料
1.1.1 实验动物
5周龄SPF级雌性BALB/c小鼠44只,体重15 ~ 20 g,购自北京维通利华实验技术有限公司,动物合格证号【SCXK(沪)2016-0002】。动物实验在上海兽医研究所进行,实验许可号【SYXK(沪)2016-0010】,并通过了研究所实验伦理委员会的审查,批准号:SHVRI-SZ-20131102-02。
1.1.2 毒株
A/swine/Jiangsu/C1/08 (H9N2) (H9C1)、A/swine/Shandong/731/2009 (H1N1) (SD731)和A/Puerto Rico/8/34 (H1N1) (PR8)流感毒株由本实验室保存,三株流感毒株均在9 ~ 11日龄SPF鸡胚上繁殖扩增,将扩增的病毒分装至1.5 mL离心管中,每管500 μL,冻存于-80℃。
1.1.3 仪器和试剂
多功能酶标检测仪购自美国Thermo公司;Mouse IL-6 及TNF-α ELISA试剂盒购自BD Ebiosicience公司。
1.2 方法
1.2.1 动物分组
小鼠按照体重随机分成PBS对照组、H9C1、SD731和PR8流感病毒感染组,共4组,每组11只。
1.2.2 攻毒
小鼠用干冰进行麻醉,将1×106TCID50/50 μL的流感病毒液用移液器滴入小鼠鼻腔;对照组小鼠滴入50 μL PBS。接毒后的小鼠正常饲养,供给饲料为标准日粮,饮高压灭菌水,足量供给[24]。攻毒开始前标记为0 d,攻毒后每天观察记录1次,连续观察14 d,小鼠体重低于接毒前初始体重的25%即判定为死亡,并给予安乐死处理。在攻毒后的第1、3天,每组3只经CO2麻醉静脉放血处以安乐死,采集小鼠肺组织用于检测肺组织的病毒载量和IL-6、TNF-α的水平。
1.2.3 小鼠肺组织病毒载量测定
小鼠肺组织病毒载量用TCID50进行标定,步骤如下:首先称量小鼠肺的重量并记录,加入1 mL体积的含1000单位双抗的PBS缓冲液,进行无菌研磨。将组织匀浆液5000 r/min离心15 min,收获上清。取100 μL上清液用无血清的DMEM培养基连续10倍倍比稀释,将其接种到MDCK细胞板上进行TCID50的测定,以确定流感病毒在肺中的病毒含量。
1.2.4 ELISA kit检测小鼠肺组织的IL-6、TNF-α水平:
(1)将Capture抗体用100 μL coating buffer稀释后加入到96孔板中,并4°C进行过夜包被;
(2)弃掉96孔板中的coating buffer,并用250 μL的PBST洗涤3次;
(3)每个孔中加入200 μL 1× ELISA稀释液室温封闭1 h;
(4)用1×ELISA稀释液倍比稀释细胞因子标准品及待检样品,稀释之后每孔加入100 μL,4°C孵育过夜或常温孵育2 h;
(5)250 μL PBST洗涤3 ~ 5次,每孔加入100 μL 1× ELISA稀释液的细胞因子检测抗体,室温孵育1 h;
(6)250 μL PBST洗涤3 ~ 5次,每孔加入100 μL 1× ELISA稀释液稀释的Avidin-HRP抗体,室温孵育30 min;
(7)250 μL PBST洗涤5 ~ 7次,每孔加入100 μL 1× TMB溶液,室温孵育15 min,孵育后加入50 μL 2 M硫酸溶液终止反应;
(8)多功能酶标检测仪检测450 nm波长下的OD值;
(9)根据测出的OD绘制标准曲线,计算目的样品的细胞因子含量。
1.2.5 HI实验
(1)96孔血凝板中加入生理盐水,再加入25 μL收集的血清,进行连续2倍倍比稀释;
(2)每孔中加入25 μL/4个凝集单位的H9N2各抗原;
(3)混匀,室温孵育30 min,观察血凝结果。
1.3 统计学分析
统计学分析使用GraphPad 7.0软件(GraphPad软件公司,San Diego,CA,美国)。两两比较使用t检验。多重比较分析采用双向方差分析(Two-ways ANOVA)。P< 0.05为差异有统计学意义。
2 结果
2.1 A型流感病毒感染BALB/c小鼠的症状和体征
为了研究三株A型流感毒株对BALB/c小鼠的致病性差异,本研究选用1×106TCID50的接毒剂量感染5周龄BALB/c小鼠,连续观察14 d,每天记录体重变化及死亡情况,体重变化曲线及死亡曲线分别见图1A、图1B。结果显示:BALB/c小鼠在接种SD731和PR8病毒的第2天体重开始明显减轻,至第3天开始出现临床症状,主要表现为精神不振,弓背,蜷缩,竖毛,颤抖、反应差、活动少、扎堆。PR8攻毒组小鼠在攻毒第4天出现死亡,小鼠体重持续下降,至第6天全部死亡。SD731攻毒组在第5天和第7天各死亡1只,第9天死亡2只,至14 d,死亡4只,死亡率达到80%。H9C1攻毒组小鼠体重在第2天开始下降,至第4天降至最低为93%,此后小鼠体重逐渐恢复,H9C1感染期间小鼠临床症状不明显,无小鼠死亡。

注:A. 小鼠滴鼻感染流感病毒后体重变化;B. 小鼠滴鼻感染H9N2病毒后存活率。图1 小鼠体重变化曲线及死亡曲线Note. A. Body weight changes of the mice inoculated with influenza A virus. B. Survival rate of the mice inoculated with H9N2 virus.Figure 1 Body weight changes and survival rate of the mice after virus inoculation
2.2 肺的病毒载量及抗体滴度
为了分析这三株A型流感毒株在BALB/c小鼠的致病性的不同,本研究在BALB/c感染IAV后的第1、3天,随机处死3只小鼠,解剖收集肺组织研磨后检测其病毒。结果显示:H9C1、SD731和PR8三株A型流感病毒在小鼠肺内均能良好的复制,感染后的第1、3天后小鼠肺的病毒载量均超过9×103TCID50/mL,其中PR8的复制能力最好,第1天肺病毒载量是105.3TCID50/mL,第3天为106.3TCID50/mL;其次是SD731,第1天肺病毒载量是104.4TCID50/mL,第3天为105.4TCID50/mL;H9C1病毒感染的第1天肺病毒载量是103.9TCID50/mL,第3天为105.5TCID50/mL(图2A)。感染14 d后,将剩余的BALB/c小鼠经安乐致死,采集并分离血清,测定HI效价。结果显示:H9C1和SD731感染组HI效价均在210以上(图2B),表明经滴鼻途径使BALB/c小鼠成功感染流感病毒,PR8组小鼠全部死亡,故不列入此次统计。
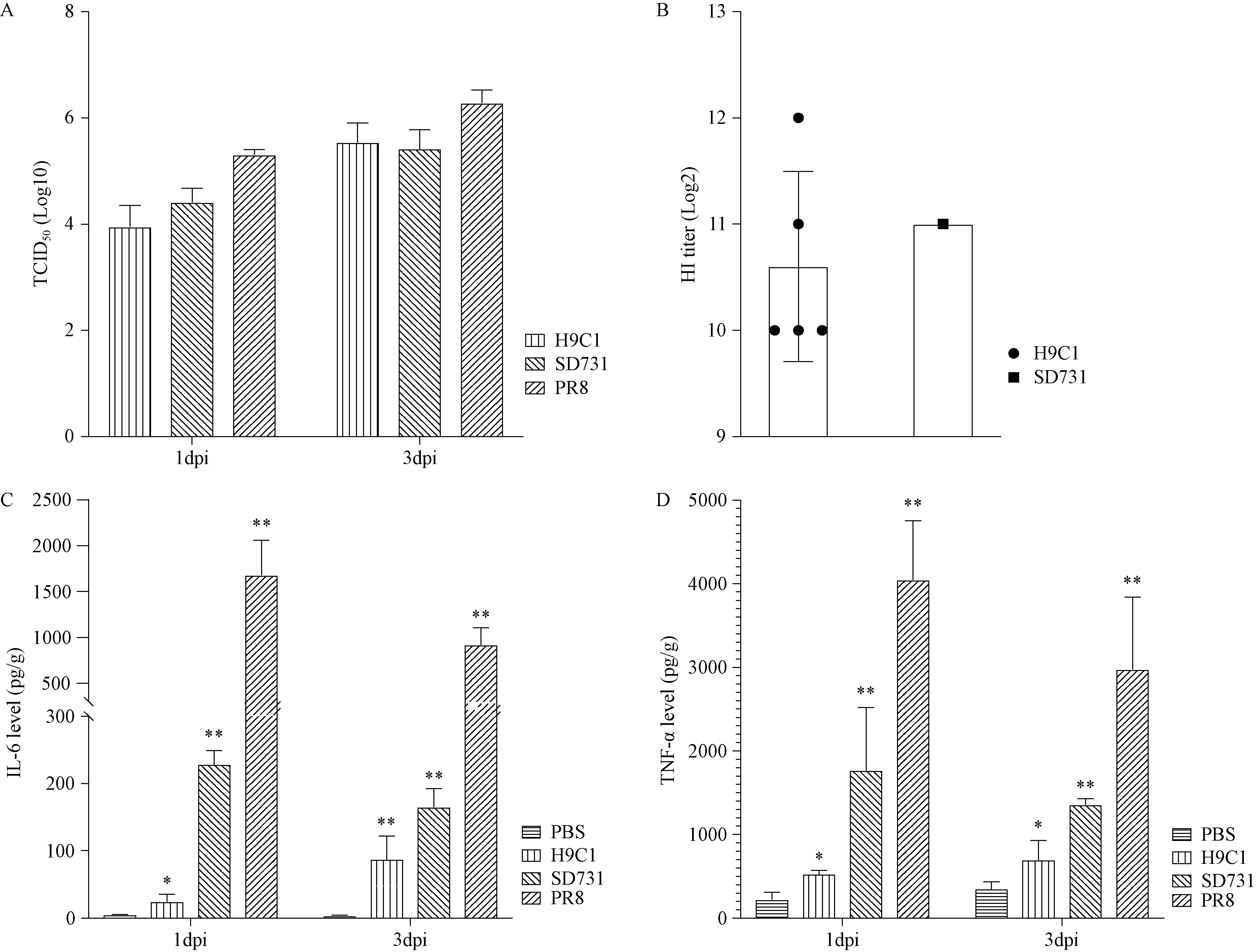
注:A. 在感染病毒的第1、3天,采取感染小鼠肺组织(n=3)进行病毒载量的测定。B. 流感病毒感染14 d后,小鼠血清HI测定。C. 小鼠肺组织炎症因子IL-6。D. 小鼠肺组织炎症因子TNF-α。流感病毒感染组与PBS对照组相比较,显著性为*P < 0.05或者**P< 0.01。图2 A型流感病毒感染BALB/c小鼠Note. A. Viral titers in the mouse lung tissues at 1 dpi and 3 dpi after inoculation. B. HI titers of rest mice at 14 dpi. C. IL-6 levels in the mouse lung tissues. D. TNF-α levels in the mouse lung tissues. Significance is shown as *P < 0.05 or **P < 0.01.Figure 2 BALB/c mice infected with influenza A virus
2.3 肺炎症因子IL-6、TNF-α的测定
为了评估小鼠感染IAV后,小鼠肺组织的IL-6、TNF-α的水平将用评估小鼠感染流感病毒的炎症水平。ELISA结果显示:对比PBS阴性对照,H9C1病毒感染第1 ~ 3天,IL-6和TNF-α的蛋白水平分别升高4.21 ~ 22.66倍和0.98 ~ 1.32倍;SD731病毒感染第1 ~ 3天,IL-6和TNF-α的蛋白水平分别升高41.74 ~ 47.24倍和2.85 ~ 6.78倍;PR8病毒感染第1 ~ 3天,IL-6和TNF-α的蛋白水平分别升高242.11 ~ 354.42倍和7.46 ~ 16.82倍(图2C、D)。因此,BALB/c小鼠致病性实验中,SD731和PR8病毒引起的炎症反应水平显著高于H9C1。
3 讨论
3.1 建立IAV感染动物炎症模型动物的选择
鉴于目前流感病毒高变异性,新型抗流感病毒药物及疫苗的研发都需要合适的动物模型进行进一步的评价。因此,合适的动物模型是将理论成果转化到实际应用的必不可少的技术支撑。BALB/c小鼠作为实验动物用于流感病毒的致病性研究有着独特的优点:① BALB/c小鼠对流感病毒敏感,有明显的症状和体征[25];② BALB/c小鼠的生长周期短,遗传背景明确,伦理问题少,便于操作[26]。
3.2 建立IAV感染动物炎症模型方法的选择
现已确认的促炎细胞因子主要有IL-6和TNF-α等[27-28],这些炎症因子在生物损伤和病毒感染的发生、发展的病理过程中扮演重要的角色。因此,本次研究中我们选用IL-6和TNF-α的水平来评估小鼠感染流感病毒后的炎症反应。本文中,我们以1×106TCID50的H9C1、SD731和PR8经滴鼻方式感染BALB/c小鼠,通过连续观察小鼠体重变化及死亡情况,感染第1、3天小鼠肺组织病毒载量及炎症因子的水平来跟踪流感病毒感染对小鼠的致病性。本实验所得结果显示:SD731和PR8的致病性要显著高于H9C1,SD731致死率达到80%,PR8致死率达到100%,而H9C1感染不致死小鼠;同时,SD731和PR8病毒引起的肺组织的炎症反应水平显著高于H9C1。该结果进一步证实了流感病毒的致病性强弱与炎症反应以及病毒的复制呈正相关。
3.3 建立IAV感染动物炎症模型方法的意义
本研究建立的小鼠炎症模型,在临床表现、体重变化、死亡率、病毒复制及炎性反应等指标方面都能达到A型流感病毒疾病模型的造模要求。此模型的建立对研究A型流感病毒的致病机制、评价药物和疫苗治疗效果等具有一定的参考意义。

